盐酸二甲双胍片溶出度的测定分析
- 格式:doc
- 大小:78.50 KB
- 文档页数:3

复方盐酸二甲双胍片溶出度测定方法的研究张岱州;王功霞;梁大连;梁慧【期刊名称】《药学研究》【年(卷),期】2004(023)009【摘要】目的考察复方盐酸二甲双胍片体外释放行为,制定合理的溶出度测定条件.方法 (1)以1000ml水为溶出介质,转速75rpm,45min时取样,采用UV法于233nm的波长处测定.(2)以0.02%三(羟甲基)氨基甲烷250ml为介质,转速为75rpm时,45min取样,采用HPLC法于228nm测定格列本脲的溶出度.结果盐酸二甲双胍的水溶液在1.62~8.12μg·ml-1浓度范围内,吸收度与浓度呈良好的线性关系;平均回收率99.80%.格列本脲溶出液在4.10~6.16μg·ml-1浓度范围内,吸收度与浓度呈良好的线性关系;平均回收率100.16%.结论本品溶出迅速,主药在45min内均可完全溶出,且均一性好,达到了很好的体外释放效果.【总页数】2页(P36-37)【作者】张岱州;王功霞;梁大连;梁慧【作者单位】山东省医药工业研究所,济南,250100;山东省医药工业研究所,济南,250100;山东省医药工业研究所,济南,250100;泗水县人民医院,泗水,273200【正文语种】中文【中图分类】TP460.7+2【相关文献】1.复方水飞蓟素-丹参素滴丸溶出度测定方法的研究 [J], 祝冬青2.复方氨溴索氯雷他定胶囊溶出度测定方法的研究 [J], 毛秀梅;韩蕊;杨金荣3.复方左炔诺孕酮片溶出度测定方法研究 [J], 胡楚楚;郑国钢4.复方氨酚烷胺胶囊溶出度测定方法的研究 [J], 巴哈提古丽·多尔达什;加娜尔·塔力哈提;帕里罕·阿吾汗5.复方芦丁片溶出度测定方法的研究 [J], 张平;陈睿;王彦;闫超因版权原因,仅展示原文概要,查看原文内容请购买。



盐酸二甲双胍缓释片的释放度实验研究目的:探讨盐酸二甲双胍缓释片的体外释放特性。
方法:用盐酸二甲双胍缓释片参照《中国药典》2000年版二部所收栽的盐酸二甲双胍缓释片片的溶出度测定方法,采用pH8.6的磷酸盐缓冲液1000ml为释放介质,转蓝法,每分钟150转。
结果:测得2、4、10h的累积释药量分别为26.95%、47.40%和93.12%,结论:该片剂处方较为合理,可为糖尿病患者提供一个服用次数少,药效稳定,副作用小的新剂型。
标签:盐酸二甲双胍缓释片;释放度;实验研究盐酸二甲双胍缓释片是主要的口服降血糖药,得到广大医生和专家的一致好评,现在已成为我国第一线口服降糖药,并列入国家基本医疗保险药品目录。
糖尿病在我国是仅次于心血管和肿瘤之后威胁人类健康的第三大杀手,而且目前糖尿病的治疗,仍处于只能良好控制,不能根治的水平,患者需终生服药,我国人口众多,治疗糖尿病药物市场潜力极大。
盐酸二甲双胍缓释片主要成份为盐酸二甲双胍,其化学名称为: 1,1-二甲基双胍盐酸盐。
其化学结构式为:分子式:C4H11N5·HCl分子量:165.63,为白色长条形片。
规格:0.5g(以C4H11N5·HCl计),2型糖尿病使用本品治疗高血糖时没有固定的剂量。
在不超过最大推荐剂量,即2000毫克/日的情况下,剂量根据作用和耐受必须个体化。
缓释片是一种新剂型,采用独特的缓释技术,利用高粘度高分子材料吸水膨胀形成凝胶,制成每天只需服用一次的缓释片,可使盐酸二甲双胍缓释片在体内缓慢释放,延缓药物在体内的滞留时间,血药浓度平稳,维持有效血药浓度时间长,更具长效性,从而减少了用药的次数,同时又可降低毒副作用,另外由于剂量低(规格为30mg/片),治疗成本也大幅下降。
现将国产盐酸二甲双胍缓释片的释放度进行实验研究,得出结论其释放速率平稳,是糖尿病人的良药。
1 材料与方法1.1 仪器与试药UV一754紫外分光光度计(上海第三分析仪器厂);RCA一8A型智能药物溶出仪(天津大学仪器厂生产):盐酸二甲双胍缓释片(成都恒瑞制药有限公司):原料药及对照品(天津新新药业有限公司);对照片(法国施维雅公司);聚乙烯吡咯烷酮(沈阳东北制药总厂),乳糖(上海制药厂);淀粉(上海葡萄糖厂)。
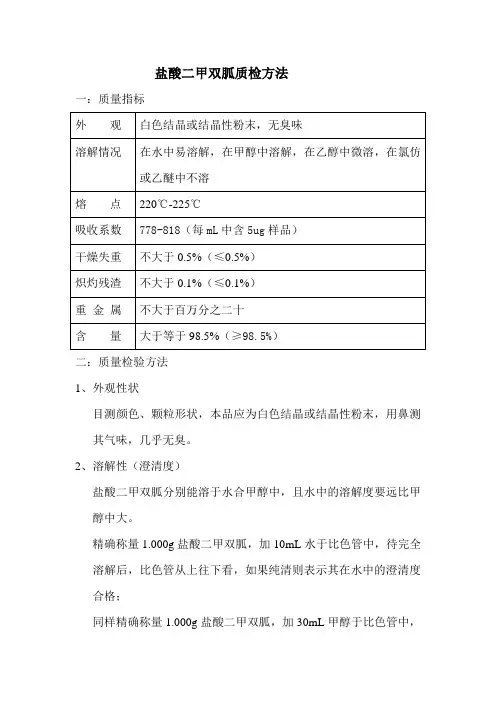
盐酸二甲双胍质检方法一:质量指标二:质量检验方法1、外观性状目测颜色、颗粒形状,本品应为白色结晶或结晶性粉末,用鼻测其气味,几乎无臭。
2、溶解性(澄清度)盐酸二甲双胍分别能溶于水合甲醇中,且水中的溶解度要远比甲醇中大。
精确称量1.000g盐酸二甲双胍,加10mL水于比色管中,待完全溶解后,比色管从上往下看,如果纯清则表示其在水中的澄清度合格;同样精确称量1.000g盐酸二甲双胍,加30mL甲醇于比色管中,边晃动边使其慢慢溶解,待完全溶解后,比色管从上往下看,如果纯清则表示其在甲醇中的澄清度合格。
3、干燥失重精确称重1.000克样品于一称量皿中,放于105℃干燥炉中4小时至恒重,取出后放于一干燥皿中至室温,称重计算,减重不超过0.5%为样品合格。
计算方法如下:干燥失重=(m样—m干)÷m样4、炽灼残渣600度坩埚,先在高温箱中600℃加热1小时,而后取出放入干燥皿中冷却,精确称重。
准确称重1.000g样品放于坩埚中,直接放电炉加热至没有青烟(约半小时左右)凉至室温加0.5mL 硫酸,继续放电炉加热至无烟(低温加热至硫酸蒸汽,全部除尽),而后放于600度高温炉中2小时,取出放于干燥皿中完成冷却,精密称量后,再在600-800℃炽灼至恒重,称重计算,小于0.1%为合格。
计算:A最后残渣质量÷m样品质量5、有关杂质(双氰胺对照试验)取二甲样品0.5g,加无水甲醇5mL(沿壁加入)于试管1中,水浴加热至完全溶解(加热取出多次,防止沸出试管),而后自然降温至35度,再加5mL乙醚搅拌冷却至20度,静止30分钟,用滤纸过滤,再用2.5mL乙醚洗试管,同样过滤合并滤液。
滤液。
滤液置水浴上蒸发至干,(可先用电炉蒸干一部分水),残渣加水0.5mL溶解,作为备用样品。
双氰胺对照试样,取双氰胺对照品0.004g,溶于10mL水中,作为备用对照(即没1mL中含0.4mg)展开剂配比:正戊醇、吡啶、水(1:2:1.8),分别取样品5mL、10mL、9mL混合于瓶中备用。


盐酸二甲双胍缓释片——溶出曲线对比研究项目信息¾项目名称 盐酸二甲双胍缓释片与参比制剂溶出对比研究¾制剂规格 500mg¾参比制剂GLUCOPHAGE XR®(格华止缓释片)¾介质选择水、0.1N盐酸、 pH6.8磷酸盐缓冲液、pH4.5醋酸缓冲 液;¾研究结果 此研究成果符合国家局一致性再评价要求。
自制制剂与 参比制剂四条溶出曲线f2因子均大于55。
一.主要内容测定盐酸二甲双胍缓释片在多条介质中的溶出曲线二.产品信息自制制剂药品名称:盐酸二甲双胍缓释片规格:500mg批号:MET4-1片重:800mg参比制剂药品名称:盐酸二甲双胍缓释片(GLUCOPHAGE XR®)规格:500mg批号:0436730-10032生产地址:百时美施贵宝公司(bristol-myers squibb)片重:1030mg三.溶出方法USP37:盐酸二甲双胍缓释片溶出检测方法1实验装置:采用装置2转速100rpm检测仪器:紫外分光光度计检测波长:232nm溶出曲线测定过程如下:3.1 pH6.8磷酸盐缓冲液中溶出曲线的测定3.1.1 溶出介质的配制方法:取6.8g磷酸二氢钾,加适量水溶解,并用水稀释至1000mL,用0.2N氢氧化钠调节pH至6.8±0.1,摇匀,即得。
3.1.2溶出介质体积:1000mL3.1.3取样时间点:1,3,5,7,10,12h3.1.4参比溶液的配置:精密称取20mg二甲双胍对照品至250mL容量瓶中,采用3.1.1中介质溶解,定容,作为母液。
另移取6mL原液至100mL容量瓶中,采用3.1.1中介质定容,摇匀,即得对照品溶液。
测定吸光度。
3.2 pH4.5醋酸缓冲液中溶出曲线的测定3.2.1溶出介质的配制方法:详见USP。
3.2.2溶出介质体积:1000mL3.2.3取样时间点:1,3,5,7,10,12h3.2.4参比溶液的配置:精密称取20mg二甲双胍对照品至250mL容量瓶中,采用3.2.1中介质溶解,定容,作为母液。


盐酸二甲双胍片的处方工艺研究摘要:目的采用湿法制粒压片技术制备盐酸二甲双胍包衣片。
方法以30 min 溶出率为指标,采用单因素试验筛选并优化了各辅料的用量和包衣增重等处方因素。
以参比制剂为对照,比较了优化包衣片与参比制剂溶出曲线。
结果制得的盐酸二甲双胍片符合30min内溶出率超过80%的要求。
结论 3批验证产品的工艺重现性良好、质量稳定。
自制与参比制剂在四种溶出介质中溶出行为相似。
关键词:盐酸二甲双胍;片剂;体外溶出盐酸二甲双胍(metformin hydrochloride)为双胍类抗高血糖口服液,起作用主要是通过增强外周组织胰岛素介导的葡萄糖摄取和氧化代谢。
目前公开报道的文献均是以中美施贵宝公司的500mg规格(格华止)为参比制剂,但不同规格不能豁免体内生物等效性试验(BE)[1],根据国家食品药品监督管理总局网站最新公布的第五批参比制剂目录,250mg规格以日本新药株式会社的盐酸二甲双胍片为参比制剂[2],考察多条溶出曲线相似性。
1 仪器与试药万能粉碎机(上海化工设备);型湿法混合制粒机(重庆科旭);型沸腾干燥机(长江药机);双锥混合机(重庆长征制药机械);旋转压片机(北京翰林航宇科技);高效包衣机(北京航空工艺研究所)原料药 (山东科源,含量 99.68%,批号P031- 1708012);对照品(中检院,含量100%,批号100664-201604);参比制剂[3],(日本新药株式会社,规格0.25g,批号357901) ;甘露醇 (广西南宁化学) ;羟丙甲纤维素(HPMC,美国陶氏);玉米淀粉(山东聊城);硬脂酸镁(山东聊城) ;欧巴代(卡乐康);甲醇、乙腈为色谱纯,水为纯水,其他试剂均为分析纯。
2方法与结果2.1 产品的制备盐酸二甲双胍属于BCSⅢ类,具有高溶解低渗透特性,溶解度属于非 PH 依赖型,不受酸碱影响。
制剂规格250mg,片重约278mg,处方中原料占比达90%,流动性差,故采用湿法制粒改善流动性。

当代化工研究Modern Chemical Research4本刊特稿2020•16盐酸二甲双脈片体夕h溶出度牙口生物等效研究*毕德忠(上海信谊天平药业有限公司上海201108)摘耍:目的:研究盐酸二甲双脈片体外溶出度试验,并达到体内与参比制剂生物等效.方法:通过对溶出度试验方法深入研究,确定不同pH溶出介质的检测方法和要求.结果:自制制剂与参比制剂的溶出度基本一致,人体内餐前和餐后试验呈现一致性.结论:经过对自制盐酸二甲双脈片溶出度和生物等效研究,自制制剂和参比制剂具有质量和疗效一致性.关键词:盐酸二甲双脈片;溶解度测定;制剂中图分类号:R96文献标识码:AStudy on Dissolution and Bioequivalence of Metformin Hydrochloride Tablets in VitroBi Dezhong(Shanghai Xinyi Tianping Pharmaceutical Co.,Ltd.,Shanghai,201108)Abstracts Objective:To study the dissolution test of metformin hydrochloride tablets in vitro and achieve bioequivalence with reference preparations in vivo.Methods:Through in-depth study of d issolution test methodjin,the detection methods and requirements of d issolution media with different p H were determined.Results:The dissolution rate of t he self-made preparation was basically the same as that of t he reference preparation, and the pre-meal and post-meal tests in human body were consistent.Conclusion:After studying the dissolution and bioequivalence of s elf-made metformin hydrochloride tablets,the self-made preparation and reference p reparation have the same quality and curative effect.Key words:metformin hydrochloride tablets determination of s olubility-^preparation下转第5页上接第3页(H20)n^nH20(1)•2H20(2) M z++nH20^[M(0H2)n]z+(3)X z-+kH20^[X(0H2)k]z-(4)M^+nRjO^W[M(RjORpn]z+(5) 3.结论使用鲸蜡硬脂基葡糖昔和硬脂醇聚醸-21作为复配的非离子型乳化剂组合,搭配增稠剂径乙基丙烯酸盐/丙烯酰二甲基牛磺酸钠共聚物,能够在乳化配方中实现对2.5%的AA2G 进行稳定的承载。

过程分析考察不同厂家盐酸二甲双胍片的溶出度
赵昕;张鹏;许志军;杨林;王锦;张广春
【期刊名称】《解放军药学学报》
【年(卷),期】2009(025)006
【摘要】目的利用光纤溶出度过程分析方法,监测盐酸二甲双胍片的溶出度,通过实时在线监测药片溶出情况反映不同厂家生产的药片质量的差异.方法采用<中国药典>中规定的检测盐酸二甲双胍片溶出度的条件,利用光纤传感溶出度实时过程分析方法对6个不同厂家的盐酸二甲双胍片进行了实时监测.结果 6个厂家的溶出曲线明显不同,可真实地反映每粒药片的溶出过程.结论光纤溶出度过程分析,真实地反映了不同厂家药片的溶出行为,对评价药品内在品质提供了有效方法.
【总页数】3页(P542-544)
【作者】赵昕;张鹏;许志军;杨林;王锦;张广春
【作者单位】
【正文语种】中文
【中图分类】R927.1
【相关文献】
1.不同厂家盐酸二甲双胍片体外溶出度考查 [J], 姚秋燕;黄碧莹;黄伟侨;唐蕾;刘怡;林婉贞
2.过程分析考察不同厂家尼莫地平片的溶出度 [J], 孔彬;李新霞;张奇洲;胡旭;熊海江;刘欢;陈坚
3.对14个厂家盐酸二甲双胍片溶出度的考察 [J], 余继英;许民;陈旭光;孙世明
4.光纤传感过程分析比较不同厂家盐酸左氧氟沙星片溶出度 [J], 张明玥n;李新霞;王伟萍;刘扬
5.不同厂家盐酸二甲双胍片体外溶出度的比较 [J], 李雪梅;魏宇宁
因版权原因,仅展示原文概要,查看原文内容请购买。
Vitro dissolution of metform hydrochloride uncoated tablets and sustained--release tablets produced by different manufacturers 作者: 王志强 吴继禹 胡卢丰 张秀华
作者机构: 温州医学院附属第一医院药剂科,浙江温州325000
出版物刊名: 中国农村卫生事业管理
页码: 160-163页
年卷期: 2011年 第2期
主题词: 盐酸二甲双胍 含量测定 溶出度 紫外分光光度法
摘要:目的:建立盐酸二甲双胍片的溶出度试验方法,对6个厂家生产的盐酸二甲双胍普通片和4个厂家生产的缓释片含量和溶出度进行测定。
方法:以纯化水1000ml作为溶出介质,采用转篮法测定溶出度,转速均为100r·min-1,温度为(37.0±0.5)C,用紫外分光光度法测定含量,测定波长为233nm,并对溶出参数进行了S-N—K统计学处理。
结果:各厂家生产的盐酸二甲双胍片含量均符合药典规定,但各厂家盐酸二甲双胍片的溶出参数(T50、Td、m)差异明显。
结论:不同厂家生产的盐酸二甲双胍片的溶出度行为明显不一致,进行溶出度检查有助于控制质量。
盐酸二甲双胍片的研究徐捷(常州工程职业技术学院)摘要:糖尿病是一种常见的内分泌代谢紊乱性疾病,已经成为继心脑血管疾病和肿瘤之后威胁人类健康的“第三号杀手”。
20世纪50年代,降糖药物二甲双胍片开始应用于肥胖伴胰岛素抵抗的2型糖尿病患者,然而传统制剂存在辅料陈旧、溶出度偏低、生物利用度低等缺点。
为此,本文进行了二甲双胍片的处方优化、新型辅料选择进行了研究。
通过辅料选择和处方相溶性研究确定了所用的新型辅料,应用固体制剂体外质量评价法一溶出度测定,及考察片剂质量的其余指标,进行处方筛选,确定了新处方组成为盐酸二甲双胍,乳糖,糊精,低取代羟丙基纤维素,羟丙基纤维素,PVP,二氧化硅。
关键词:二甲双胍;新型辅料;相容性;溶出度;片剂引言:盐酸二甲双胍(Metformin Hydrochloride) 是双胍类降糖药, 因不良反应较小, 广泛用于II 型糖尿病的治疗,成为双胍类药物的典型代表[ 1, 2]。
它具有明显的降低血压和降低血液中的谷胱甘肽和肝脏中的Mg2+浓度的作用, 有保护肝脏的功能, 是续苯乙双胍(降糖灵)之后的一个疗效肯定, 副作用小, 介于磺脲类和胰岛素之间治疗糖尿病的首选药品,能单独或分别与磺脲类或胰岛素合用, 治疗非胰岛素依赖型糖尿病[ 3]。
但由于盐酸二甲双胍片剂处方中所用的辅料一般沿用老辅料,如淀粉、糊精、滑石粉等上世纪50~60年代的辅料,其溶出度偏低经常处在80%左右,导致药物进入体液的量降低,从而影响人体吸收,相对降低了该药物的生物利用度;且其片剂经常出现松片、裂片、分层等现象。
针对这一问题,在参阅国内外文献的基础上,对二甲双胍片的处方中的辅料进行了优化,选择合适的新型辅料。
通过对二甲双胍片的处方中的辅料改进后,二甲双胍片的溶出度明显提高,片剂的外观质量也得到显著提高。
片剂的溶出度提高后药物进入体液的浓度增加,从而提高了机体吸收,相应地提高了二甲双胍的生物利用度,对疗效的提高起积极的作用[4]。
盐酸二甲双胍肠溶片释放度测定魏青;王彦东;杨建军;秦荣【摘要】目的:探讨采用高效液相色谱法测定盐酸二甲双胍肠溶片释放度。
方法:采用HPLC法,流动相为甲醇-水(含2.5 mmol/L庚烷磺酸钠,0.14%三乙胺)(5∶95),用磷酸调pH至7.4,紫外检测器,检测波长233nm。
结果:盐酸二甲双胍在31.375-551.0μg/mL的浓度范围内线性良好,线性方程为Y=75610 X+600(r=0.9992);平均回收率为102.28%,RSD=0.75%。
结论:HPLC法测定盐酸二甲双胍肠溶片释放度,此方法准确、灵敏度高,能够更好地控制药品质量。
【期刊名称】《内蒙古医科大学学报》【年(卷),期】2014(036)005【总页数】4页(P415-418)【关键词】盐酸二甲双胍;高效液相色谱法;释放度【作者】魏青;王彦东;杨建军;秦荣【作者单位】【正文语种】中文【中图分类】R284.1Abstract:Objective:Research for release in vitro of Metformin Hydrochloride Enteric-coated Tablets.Methods:HPLC method was adopted,the mobile phase was methanol-water(containing 2.5 mmol/L sodium heptanes,0.14%triethylamine)(5∶95),adjusted to pH 7.4 withphosphoric acid,UV detector,detection wavelength of233nm.Results:Metformin hydrochloride concentration range inside31.375~551.0μg/mL,linear regression coefficient was 0.9992;average recovery was 102.28%,RSD=0.75%.Conclusion:Method of HPLC for the determination of the release of metformin hydrochloride enteric-coated tablets was presents the superordinary accuracy,high sensitivity,and better capability to control the quality of drugs.Key words:metformin hydrochloride;HPLC;release盐酸二甲双胍肠溶片在《中国药典》2005年版增补本中,释放度测定采用紫外吸收系数法,由于盐酸二甲双胍在0.1mol/L盐酸溶液中发生波长位移,所以酸中释放度采用采用紫外吸收系数法并不能测得其释放的准确值[1]。
盐酸二甲双胍片溶出度的测定分析
摘要:目的:分析盐酸二甲双胍片的溶出度,为临床合理用药提供依据。
方法:按照《中国药典》2005年版规定的溶出度测定法。
结果:3个厂家的产品均符合规定。
对照品、B厂产品各个时间点溶出度的标准差很小,反映出这2个厂家产品每片之间溶出度差异很小,质量均一、稳定,而A厂产品各个时间点溶出度的标准差较大,反映A厂产品各片之间溶出度差异较大,提示A厂产品质量均一性较差,需查找原因,改善其产品质量。
结论:吸收速度受溶出速度限制的药物,其生物利用度与溶出速度有较好的相关性。
提示药品生产部门应加强对药品溶出速度的监测,以便在生产中控制制剂的内在质量。
关键词:盐酸二甲双胍片;溶出度;测定
盐酸二甲双胍是一种双胍类降血糖药,可降低肝糖元的异生,促进组织摄取葡萄糖[1],其作用主要是通过增强外周组织胰岛素介导的葡萄糖摄取和氧化代谢,且不刺激胰岛素的分泌,不引起低血糖,价格相对较低,目前在糖尿病的治疗中占有重要地位。
由于市售的盐酸二甲双胍片的种类较多,笔者选择了河南兴源制药有限公司的产品进行溶出度检查,并与其它厂家的产品进行比较,以期为临床用药提供参考。
1 仪器与试药
1.1 仪器
UV2100型分光光度计(日本岛津);ZRS-8型药物溶出仪(天津大学无线电厂);AG245电子天平(瑞士Mettler-Toledo公司);微孔滤膜及过虑装置(Millipore USA)。
1.2 试药
盐酸二甲双胍对照品(中国药品生物制品检定所,批号:100666-200501),盐酸二甲双胍供试品(河南兴源制药有限公司,250mg/片);另外2个厂家的盐酸二甲双胍片(分别为A:国产,250mg/片;B:进口,250mg/片);超纯水(自制)。
1.3 方法
1.3.1 储备液的制备
精密称取盐酸二甲双胍对照品约25mg,置50mL量瓶中,加蒸馏水溶解,摇匀,即得0.5mg/mL的对照品储备液。
1.3.2 标准曲线的制备
吸取盐酸二甲双胍对照品储备液0.05、0.10、0.25、0.50、0.75、1.00、1.25和1.50mL置50mL量瓶中,加水稀释至刻度,摇匀,配成0.5、1.0、2.5、5.0、7.5、10.0、12.5和15.0μg/mL的标准溶液。
以水为空白,在200~300nm波长范围内扫描,其最大吸收波长为233nm,故选233nm为测定波长。
以吸光度A对浓度C进行线性回归,得回归方程为A=0.0784C-0.0036,r=0.9997。
1.3.3 含量测定
随机取各厂家样品20片,精密称定,分别研细,精密称取适量样品(约相当于盐酸二甲双肌l0mg)各2份,分置于100mL量瓶中,加水75mL,充分振摇15min,使二甲双胍溶解,加水至刻度,摇匀,滤过,精密取续滤液5mL,置100mL量瓶中,加水稀释至刻度,摇匀后,分别在233nm波长处测定吸收度并换算成百分含量,结果见表1。
1.3.4 溶出度测定
按《中国药典》2005年版中的溶出度测定法[2],采用转篮法,转速为100r/min,温度为37±0.5℃。
各厂样品分别取6片,投入已调好温度的1000mL脱气蒸馏水中,自投药开始计时,分别于5、10、15、25和45min取样10mL,同时补液10mL,样品立即用0.45μm微孔滤膜滤过,精密吸取续滤液1mL置于50mL量瓶中,加水稀释至刻度,摇匀,于波长233nm波长处测吸光度,以标准曲线计算各时间点的累积溶出百分率。
根据威布尔(weibull)分布模型,计算出溶出50%的时间(t50)、溶出63.2%的时间(td)、形状参数(m)等溶出参数[3]。
结果见表2。
2 结果
中国药典规定盐酸二甲双胍片45min时的溶出度不得少于标示量的70%。
从结果看3个厂家的产品均符合规定。
对照品、B厂产品各个时间点溶出度的标准差很小,反映出这两个厂家产品每片之间溶出度差异很小,质量均一、稳定;而A厂产品各个时间点溶出度的标准差较大,反映A厂产品各片之间溶出度差异较大,提示A厂产品质量均一性较差,需查找原因改善其产品质量。
3 讨论
溶出度是指药物从片剂货胶囊剂等固体制剂在规定溶剂中溶出的速度和程度[4],它是评价一种药物制剂不同品种、不同厂家产品、不同批次间质量的重要数据。
口服药物进入胃肠道后,必须经过分解、溶出才能被机体吸收,溶出速率的快慢会对药效产生影响,可作为固体制剂的质量控制指标。
测定药物的溶出度,研究药物的溶出曲线并计算出若干溶出参数,对控制药品质量尤其对难溶性药物来讲显得尤为重要。
盐酸二甲双胍片主要用于单纯饮食控制不满意的2型糖尿患者,尤其是肥胖者,已经成为临床一线药物。
因此,盐酸二甲双胍是一类重要的降糖药,而其合理用药在临床中亦很重要,其药品质量应当受到关注。
从本次测定结果中可以看出,所测厂家盐酸二甲双胍片均符合中国药典要求。
而A厂产品各个时间点溶出度的标准差较大,反映A厂产品各片之间溶出度差异较大,提示A厂产品质量均一性较差,需查找原因改善其产品质量。
综上所述,吸收速度受溶出速度限制的药物,其生物利用度与溶出速度有较好的相关性。
提示药品生产部门应加强对药品溶出速度的监测,以便在生产中控制制剂的内在质量。
参考文献:
[1]简龙海,李丽敏,丁黎,等.盐酸二甲双胍/格列本脲复方片剂在人体的药代动力学[J].中国药理学报,2004,20(3):334-337.
[2]中华人民共和国药典委员会.中国药典(二部)[S].北京:化学工业出版社,2005:73.
[3]彭永富,董慧.药物溶出度Weibull分布的计算机求解[J].中国药学杂志,1996,31(10):606-608.
[4]魏世杰,文友民,杨小英.九种国产盐酸二甲双胍片溶出度的比较[J].宁夏医学院学报.2008,30(4):537-539.。