铝及其化合物知识框架图
- 格式:doc
- 大小:21.00 KB
- 文档页数:1

△ 铝 及 其 化 合 物一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA 族;铝原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A.铝粉可以在氯气中燃烧,产生白烟2Al+3Cl 22AlCl 3B.铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O22Al 2O 3 注意:在金属活泼性顺序中铝排在铁的前面,而铁在空气中易生锈而铝在空气中不易被腐蚀的原因:铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应: 2Al + Fe 2O 3= 2Fe + Al 2O 3 现象:发出耀眼的光芒、放出大量的热、有熔融物生成。
(4)与沸水微弱反应:2Al+6H 2O ========= 2Al (OH )3 + 3H 2↑ (5)与酸反应::2Al+6HCl ====== 2AlCl 3+H 2↑ 2Al+3H 2SO 4 ====== A l 2(SO 4)3+ 3H 2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
钝化:某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:第一步:2Al+6H 2O ====== 2Al(OH)3 +3H 2↑第二步2Al+6H2O+2NaOH = 2NaAlO2+3H2↑+4H 2O三、铝的重要化合物1、氧化铝(Al2O3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
硅 是一种亲氧元素,在自然界总是与氧相互结合,自然界无单质硅
硅在元素周期表中位置:第三周期第ⅣA族
集成电路、芯片、半导体材料、硅太阳能电池、光伏电池(光能直接转换为电能)等硅
高纯硅的制备;
二氧化硅
硅及其化合物
(2)新型无机非金属材料
合金:在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金
Al元素位于:第三周期第ⅢA族,地壳中含量最多的金属元素(O、Si、Al、Fe),自然界中以化合态存在
铝比铁更耐腐蚀的原因:铝与氧气形成一层致密的氧化铝薄膜
,保护铝不再被氧化,而铁锈(主要成分FeO)疏松吸水
1、
2、
3、
4、Al遇浓硫酸、浓硝酸会钝化,因此,常温下用铝制容器来盛装浓硫酸或浓硝酸
Al的性质
两性氧化物
制备(氯化铝溶液中滴加氨水):
两性氢氧化物
受热分解:
典型工业流程
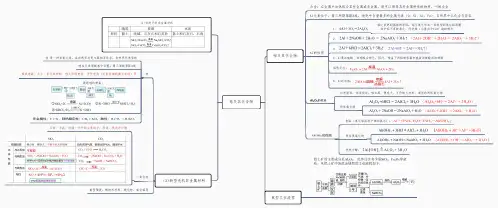
铝及其化合物
(1)传统无机非金属材料
石英、水晶、玛瑙、沙子的主要成分,用途:做光导纤维
新型陶瓷:碳纳米材料,碳化硅,氧化铝等
白色固体,性质稳定,熔点高,硬度大,可作耐火材料,典型的两性氧化物
6、Al的冶炼:
铝热反应:。

第二节铝及其化合物一、知识思维导图二、知识要点解读知识点1:金属铝知识点2:铝的化合物知识点1:金属铝1.铝的物理性质:具有银白色金属光泽的轻金属,具有良好的延展性、导电性和导热性老年性痴呆症与铝有密切关系铝的存在:铝元素占地壳总量的7.73%,是地壳中含量最多的金属。
由于铝是活泼的金属,因此铝元素在自然界中均以化合态的形式存在。
铝元素在地壳中的主要存在于铝土矿中,其主要成分Al2O3,还含有少量的Fe2O3、SiO2。
铝元素在地壳中的主要存在于铝土矿中,其主要成分Al2O3,还含有少量的Fe2O3SiO2。
2、铝的化学性质:Al的化学性质活泼,具有较强还原性(1)与非金属反应(2)与酸反应(3)与碱反应(4)与盐溶液反应(5)与某些氧化物反应—铝热反应1)与氧气的反应:4Al + 3O2 === 2Al2O3生成致密的氧化物起保护作用铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
2)与强酸溶液反应:2Al +6HCl == 2AlCl3 + 3H2↑2Al + 6H+ == 2Al3+ + 3H2↑说明:铝的“钝化”——在冷的浓硫酸和浓硝酸中,铝不溶解(表面形成致密的氧化膜)3)与强碱反应2Al+2NaOH+2H2O==2NaAlO2+3H2↑反应的实质:分两步进行(1)2Al+6H2O=2Al(OH)3+3H2↑(2)Al(OH)3+NaOH=NaAlO2+2H2O将(1)+(2)×2:2Al+2OH-+2H2O==2AlO2-+3H2↑2Al + 6H+ == 2Al3+ + 3H2↑说明:等量的铝分别与足量的盐酸和氢氧化钠反应生成氢气的量相等4)与氧化物反应——铝热反应2Al+Fe2O3=高温=2Fe+Al2O34Al+3MnO2=高温=3Mn+2Al2O3实质:Al的强还原性[现象]:发出耀眼的光芒、放出大量的热、有熔融物生成。


△ 点燃△ 铝 及 其 化 合 物一、铝得结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA族镁原子核外有三个电子,在化学反应中,容易失去最外层得三个电子,显+3价。
二、铝单质得性质1、物理性质:银白色金属,硬度与密度小,具有良好得导电导热性与延展性。
在空气中具有很好得耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2Al Cl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4A l+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁得前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中得氧气反应生成致密得氧化膜并牢固地覆盖在铝表面,阻止了内部得铝与空气接触。
(2)与盐溶液反应:2A l+3CuSO 4 =3Cu +Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + F e2O 3 == 2Fe + Al 2O3铝热剂[现象]:发出耀眼得光芒、放出大量得热、有熔融物生成。
[试一试]:写出Al 分别与M nO2 、V 2O5 得反应方程式(4)与沸水微弱反应:2Al+6H 2O ========= 2A l(OH)3 + 3H 2↑(5)与酸反应::2A l+6HCl ====== 2AlCl 3+H2↑2A l+3H 2S O4 ====== Al 2(SO 4)3+ 3H 2↑注意:铝在冷得浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密得氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应:2Al+2NaOH +2H 2O=2NaAlO 2+3H 2↑ 反应得实质:分两步进行:(2)A l(OH)3+NaOH ======== NaAl O2+2H 2O化合价降低,被还原,得6e —(1)化合价升高,被氧化,失6e —+4H 2O—得6×e —三、铝得重要化合物1、氧化铝(Al2O3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
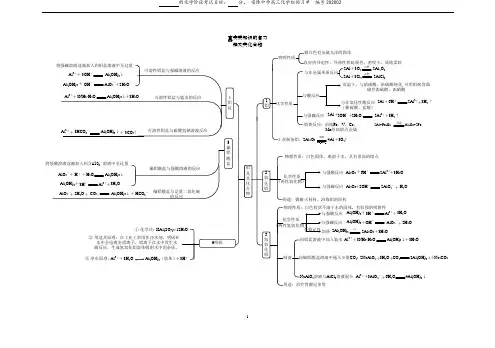
1事实类知识的复习 铝及其化合物良好的导电性、导热性和延展性,密度小,质地柔软与非金属单质反应2Al +3O 2 2Al 2O 33H 2 Al 2O 3点燃2Al +3Cl 2 2AlCl 3点燃与酸反应常温下,与浓硝酸、浓硫酸钝化,可用铝制容器储存浓硫酸、浓硝酸2Al+6H +2Al 3++与强碱反应3H 2↑2Al+2OH -2Al 3++2H 2O +铝热反应:2Al 2O 3电解Na 3AlF 64Al +3O 2↑物理性质:白色固体,难溶于水,具有很高的熔点与强酸反应与强碱反应Al 2O 3 3H 2O +6H +2Al 3+++2OH -2AlO 2- H 2O+Al(OH)3 2Al 2O 3+3H 2O 3H 2O +3H +Al 3+++OH - AlO 2- 2H 2O +△Al(OH)32Al(OH)3向铝盐溶液中加入氨水NaAlO 2溶液与AlCl 3溶液混合向偏铝酸盐溶液中通入少量CO 2:Al 3++3NH 3·H 2O 3H 2O +Al(OH)3↓2NaAlO 2 3H 2O CO 2++ 2Al(OH)3↓Na 2CO 3+Al 3+3AlO 2-++ 6H 2O4Al(OH)3↓冶炼Fe 、V 、Cr 、Mn 等高熔点金属2Al+Fe 2O 3 Al 2O 3+2Fe高温↑1镁及其重要化合物●●●镁单质○-○-物理性质具有良好的导电、导热性○-化学性质氧化镁○-物理性质氢氧化镁白色固体、不溶于水、熔点高化学性质○-物理性质能与酸反应化学性质白色固体、不溶于水与氧气反应:2Mg +O 2 == 2MgO 点燃与CO 2反应:2Mg +CO 2 == 2 MgO +C点燃与酸反应:Mg +2H +=Mg 2++H 2↑与某些盐反应:Mg +Cu 2+=Mg 2++Cu与水反应:Mg +2H 2O =Mg(OH)2+H 2↑工业制法○-电解熔融的氯化镁:MgCl 2 (熔融)== Mg +Cl 2↑电解○-○-与酸反应:MgO +2H +=Mg 2++H 2O用途○-制耐火材料受热易分解:Mg(OH)2=MgO +2H 2O△归纳上述众多反应,符合此图哪类物质间的转化,做好课前方程式默写或提问准备。


△ 点燃铝 及 其 化 合 物(知识点)一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA 族镁原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3(4)与沸水微弱反应:2Al+6H 2O ========= 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H 2↑2Al+3H 2SO 4 ====== A l 2(SO 4)3+ 3H 2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:(2)Al(OH)3+NaOH ======== NaAlO 2+2H 2O+4H 2O得6×e —失2×3 e—化合价降低,被还原,得6e —(1)化合价升高,被氧化,失6e —三、铝的重要化合物1、氧化铝(Al2O3)(1)物理性质:白色固体、熔点高(2054℃)、不溶于水,不与水化合。


【导语】今天给⼤家分享铝的重要化合物的知识点,结合思维导图,⼀⽬了然,快速get知识点~学习起来毫不费⼒~准备会考的同学也可以⽤来复习哦~~ 【学习⽬标】 1、掌握铝的氧化物(Al2O3)、氢氧化物(Al(OH)3),及其重要盐(KAl(SO4)2)的性质; 2、正确认识氧化铝(Al2O3)和氢氧化铝(Al(OH)3)的*,会书写有关反应的化学⽅程式; 3、了解Al(OH)3的制备,会书写有关反应的化学⽅程式; 4、掌握Al3+、 Al(OH)3 、AlO2-的转化(铝三⾓),并能够⽤化学⽅程式或离⼦⽅程式表⽰。
【知识络】 【学习内容】 ⼀、氧化铝(Al2O3) 1、物理性质:⽩⾊固体,熔点(2054℃),沸点2980℃,难溶于⽔。
2、化学性质:氧化铝难溶于⽔,却能溶于酸或强碱溶液中。
*氧化物(既能与强酸反应⼜能与强碱反应⽣成盐和⽔的氧化物) Al2O3既能与酸反应,⼜能与碱反应,Al2O3是*氧化物。
(⾦属氧化物不⼀定是碱性氧化物!) 3、⽤途 ① Al2O3是⼯业冶炼铝的原料 ②常作为耐⽕材料,例如,有氧化铝坩埚。
③宝⽯的主要成分是氧化铝,各种不同颜⾊的原因是在宝⽯中含有⼀些⾦属氧化物的表现。
如红宝⽯因含有少量的铬元素⽽显红⾊,蓝宝⽯因含有少量的铁和钛元素⽽显蓝⾊。
【例题】 1.下列物质中既能跟稀H2SO4反应, ⼜能跟氢氧化钠溶液反应的是①NaHCO3②Al2O3③Al(OH)3④Al() A.③④ B.②③④ C.①③④ D.全部 2、对氧化铝的分类中正确的是() A.酸性氧化物B.碱性氧化物 C.*氧化物 D.不成盐氧化物(像CO⼀样) 3.下列说法正确的是 ( ) A.Al2O3难溶于⽔,不跟⽔反应,所以它不是Al(OH)3对应的氧化物 B.因为Al2O3是⾦属氧化物,所以它是碱性氧化物 C.Al2O3能跟所有的酸碱溶液反应 D.Al2O3能跟强的酸碱溶液反应 【答案】D 【解析】Al2O3虽然难溶于⽔,但是2Al(OH)3 Al2O3+3H2O,Al2O3和Al(OH)3中Al的化合价相同,所以Al2O3是Al(OH)3对应的氧化物。
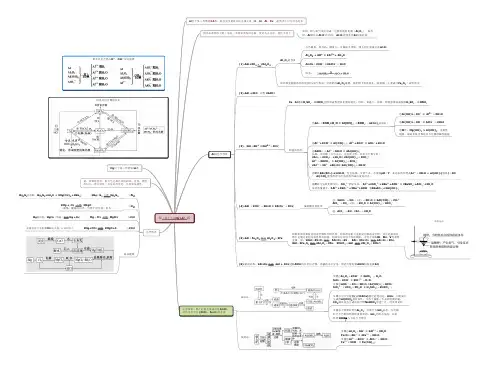
“铝及化合物”的知识框架图与教学思路肖营子高级中学佟春新一、宏观把握第三章知识线索图:第三章讲述了关于金属元素的相关知识,主要有Na、Al、Fe、Cu四种元素。
本章涉及的知识点主要涉及六点。
(一)钠单质及其化合物1、钠的单质:钠与氧气的反应:常温和加热两种情况;钠与水反应:现象、反应、说明的问题;钠和氯气、硫的反应。
2、钠的化合物:氧化钠和过氧化钠的性质比较;碳酸钠和碳酸氢钠的性质比较。
(二)铝单质及其化合物1、铝单质:铝和氧气反应;铝和酸反应;铝和碱反应。
2、铝的化合物:氧化铝和氢氧化铝的两性(三)铁单质及其化合物1、铁单质:铁和水的反应2、铁的化合物:几种铁的氧化物的比较;几种铁盐的比较(四)焰色反应(五)金属材料:常见金属材料的性质和应用(六)有关物质的量的运算二、微观探究铝及化合物”的知识框架图1、铝单质:铝和氧气反应;铝和酸反应;铝和碱反应。
2、铝的化合物:氧化铝和氢氧化铝的两性三、具体讲述“金属铝及化合物”1. 性质:(1)物理性质(2)化学性质:(完成下列方程式)与非金属的反应(O2、Cl2);与酸的反应;与碱的反应;与盐溶液的反应(与FeCl2溶液);与三氧化二铝的反应2. 铝的化合物:铝三角写出上述相关方程式:铝的化合物相关图像【典型例题1】相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是A.Al B.Al(OH)3C.Al Cl3D.Al2O3【典型例题2】除去镁粉中的少量铝粉,可选用()A.硫酸B.氨水C.盐酸D.氢氧化钠溶液【典型例题3】如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:(1)所得氢氧化钠溶液的物质的量浓度是_____ ___.(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入足量的金属铝,完全反应后,产生的气体在标准状况下的体积是________.三、课后练习1.下列氧化物中,既能溶于强酸,又能溶于强碱的是(D)A.Fe2O3B.Ag2O C.CuO D.Al2O32.下列关于Al(OH)3的性质叙述错误的是( D )A.Al(OH)3是两性氢氧化物B.Al(OH)3是难溶于水的白色胶状物质C.Al(OH)3能凝聚水中的悬浮物,也能吸附色素D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸3.把一定量的Ba(OH)2溶液滴入明矾[KAl(SO4)2•12H2O]溶液中,使SO2-4全部转化成BaSO4沉淀,此时铝元素的主要存在形式是(C)A.Al3+B.Al(OH)3C.AlO-2 D.Al3+和Al(OH)34.阅读材料,回答下列问题.材料:近年来,科技人员研究得到一种新型材料——泡沫铝.它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场.(1)下列关于泡沫铝的说法错误的是________.A.泡沫铝即是铝单质泡沫B.泡沫铝是一种合金C.泡沫铝是一种优质的建筑材料和轻质材料D.泡沫铝可用于飞机制造(2)铝制成铝箔作食品包装,是利用它的哪一性质________.A.金属光泽B.延展性C.导电性D.导热性(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:与盐酸反应的离子方程式:______________________________________________ 与氢氧化钠溶液反应的离子方程式:_____________________________________ 教学思路:在上一节课对金属铝的性质,以及前面对钠、镁、铁的氧化物、氢氧化物知识的了解后,学生就能推出氧化铝、氢氧化铝与酸的反应。
必修一专题三第一单元铝及化合物的知识框架图,及本单元教学思路铝及其化合物知识框架图:
铝及其化合物知识框架图:
1.铝的原子结构、物理和化学性质。
2.两性氧化物的概念及氧化铝的物理、化学性质。
3.两性氢氧化物的概念及氢氧化铝的物理、化学性质。
4.明矾的净水作用。
本单元内容的教学思路:
在上一章,同学们已经学习了物质的归类,前面又学习了钠及其化合物的性质,再结合初中对物质性质的认识,学生对Al2O3等金属氧化物的性质有所了解,在进行教学设计时,充分利用探究实验的功效,采用实验、观察、交流与类推等方式,促使学生在课堂学习中掌握好本课时的内容。
本内容的重点是铝的化学性质、Al2O3和Al(OH)3的化学性质,要通过实验探究,让学生认识氢氧化铝的性质以及制备方法,并逐步掌握研究物质性质的方法,通过实验探究培养学生的观察能力,训练学生用对比的方法认识事物和全面地分析事物的逻辑思维能力,完善他们的创新思维能力。
通过探究实验体验科学探究的艰辛与喜悦,感受化学世界的奇妙与和谐,提高学生对“化学是一门以实验为基础的科学”的认识。