植物生理学实验八
- 格式:ppt
- 大小:273.00 KB
- 文档页数:10

植物生理学实验指导目录植物材料的采集、处理与保存..................................... 实验一拟南芥种植和形态观察................................... 实验二植物细胞的活体染色和死活的鉴定......................... 实验三植物原生质体的分离和融合............................... 实验四植物叶面积测定原理、方法和步骤......................... 实验五植物细胞渗透势的测定(质壁分离法)..................... 实验六植物组织水势的测定(小液流法)......................... 实验七植物根系活力的测定(TTC法)............................ 实验八根系总吸收面积和活跃吸收面积的测定..................... 实验九离体叶绿体的制备以及完整度的测定....................... 实验十叶绿体色素的提取、分离和理化性质....................... 实验十一植物叶片光合速率的测定(改良半叶法)................. 实验十二氧电极法测定植物组织的光合与呼吸速率................. 实验十三小篮子法(广口瓶法)测定植物的呼吸速率. (37)实验十四谷物淀粉含量的测定(旋光法)......................... 实验十五类似生长素对种子萌发的影响........................... 实验十六赤霉素对α-淀粉酶的诱导形成........ 错误!未指定书签。
实验十七植物种子生活力快速测定............................... 实验十八植物光周期现象的观察................................. 实验十九植物抗逆性的测定(电导仪法)....... 错误!未指定书签。

植物生理学实验实验报告植物生理学实验实验报告摘要:本实验旨在探究植物的生理反应和适应机制。
通过观察植物在不同环境条件下的生长和生理指标的变化,我们可以更好地理解植物的生理过程和适应策略。
本实验采用了盆栽植物的生长观察和测量方法,结合实验室中的设备和技术手段,得出了一系列有关植物生理学的结论。
1. 引言植物生理学是研究植物生长、发育和适应环境的科学,它涉及植物的生理过程、代谢调节、信号传导等方面。
通过实验研究,我们可以揭示植物在不同环境条件下的生理反应和适应机制,为植物的生产和保护提供理论依据。
2. 材料与方法本实验选取了常见的盆栽植物作为实验对象,包括绿萝、仙人掌和吊兰。
为了模拟不同环境条件,我们设置了三组实验组:阳光组、阴影组和干旱组。
每组实验设置五个重复,以保证实验结果的可靠性。
3. 结果与讨论3.1 生长观察在阳光组中,绿萝的叶片呈现出深绿色,茂密且向阳生长;仙人掌的刺变得更加粗壮,颜色也更加鲜艳;吊兰的叶片展开较大,叶色浅绿。
而在阴影组中,绿萝的叶片变得较为苍白,茂密度下降;仙人掌的刺变得细长,颜色较为暗淡;吊兰的叶片展开较小,叶色深绿。
在干旱组中,绿萝的叶片开始出现萎蔫现象;仙人掌的刺变得干瘪,颜色变得暗淡;吊兰的叶片开始卷曲,叶色变黄。
3.2 生理指标测量我们通过测量叶片的光合速率、蒸腾速率和叶绿素含量等指标,来进一步了解植物在不同环境条件下的生理变化。
在阳光组中,绿萝的光合速率较高,蒸腾速率也较高;仙人掌的光合速率较低,蒸腾速率也较低;吊兰的光合速率和蒸腾速率处于中等水平。
而在阴影组中,绿萝的光合速率和蒸腾速率下降明显;仙人掌的光合速率和蒸腾速率几乎停止;吊兰的光合速率和蒸腾速率也有所下降。
在干旱组中,绿萝的光合速率和蒸腾速率急剧下降;仙人掌的光合速率和蒸腾速率几乎停止;吊兰的光合速率和蒸腾速率也有所下降。
叶绿素含量的测量结果与光合速率和蒸腾速率的变化趋势一致。
4. 结论通过本实验的观察和测量,我们可以得出以下结论:1) 植物在阳光充足的环境下生长更加茂盛,叶片颜色更加鲜艳。

《植物生理学实验》实验教学大纲课程名称:植物生理学课程类别:专业主干课适用专业:生物技术考核方式:考查实验学时、学分:16 学时0.5学分所属实验室:植物生理学实验室一、实验教学目的植物生理学是一门实践性与综合性很强的科学,对农业生产、作物栽培、花卉园艺栽培等实践性工作有重要的指导意义。
《植物生理学实验》是《植物生理学》的配套课程,要求学生学完本课程后能够对课堂教学内容即:课堂讲授的基本理论、基础知识有深刻的理解,而且要使学生掌握植物生理学的基本实验方法和技能,并在科学态度、实验技能技巧、独立工作能力、理论联系实际能力等方面获得基本的训练。
为未来的教育教学、科研和生产实践打下坚实的基础。
通过本课程的学习,使学生具备以下素质和能力:1. 通过植物生理学实验课的学习,使学生具备基本的实验操作能力。
2. 使学生能够应用植物生理学实验中的基本技术:无土栽培技术、组织培养技术等,发展现代农业、现代园林、设施农业、现代植物工厂等的创新意识和创新能力。
3. 掌握植物生理学实验中的一些基础性实验,获得相关的教育教学能力,进一步的科研工作能力。
4. 通过实验中开展的设计性试验等培养学生的实验设计能力、综合应用能力。
二、实验教学要求通过本实验课程的教学,要使学生学会植物生理学的基本实验方法、技术和设计思路,掌握植物生理学基本原理的验证方法和定量测定植物体内发生的生理生化变化,并初步具有完成综合性、设计性实验的能力。
三、对学生的指导和要求1.要求学生对每个实验的原理、方法有深刻的认识和理解2.要求学生在实验前预习实验内容,实验过程中从玻璃仪器的洗涤、药品的配制、称量及仪器的操作都要严格规范,实验后认真分析实验结果。
四、实验考核方式考查:平时,期末五、实验教学内容实验项目(一):植物组织渗透势的测定(1) 项目类别:必做■选做□(2) 项目性质:基础性■验证性■设计性□综合性□(3) 项目主要目的要求:一、质壁分离法:掌握用质壁分离法测定植物组织渗透势的原理,学会观察质壁分离现象并进行细胞渗透势的计算。
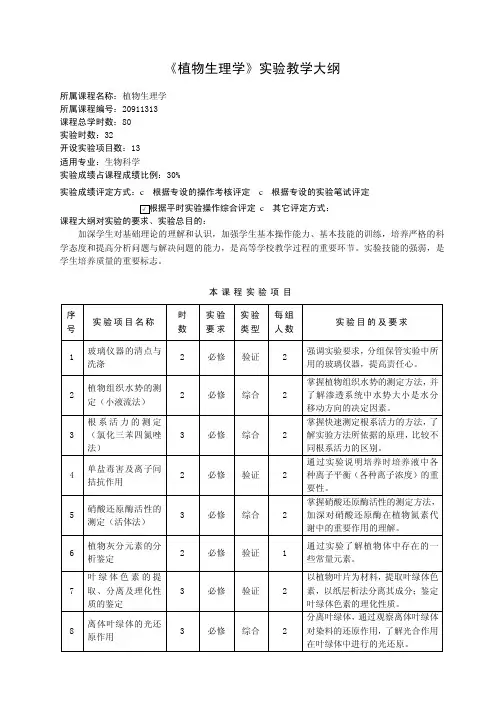
《植物生理学》实验教学大纲所属课程名称:植物生理学所属课程编号:20911313课程总学时数:80实验时数:32开设实验项目数:13适用专业:生物科学实验成绩占课程成绩比例:30%实验成绩评定方式:c根据专设的操作考核评定c根据专设的实验笔试评定√根据平时实验操作综合评定c其它评定方式:课程大纲对实验的要求、实验总目的:加深学生对基础理论的理解和认识,加强学生基本操作能力、基本技能的训练,培养严格的科学态度和提高分析问题与解决问题的能力,是高等学校教学过程的重要环节。
实验技能的强弱,是学生培养质量的重要标志。
本课程实验项目序号实验项目名称时数实验要求实验类型每组人数实验目的及要求1 玻璃仪器的清点与洗涤2 必修验证 2强调实验要求,分组保管实验中所用的玻璃仪器,提高责任心。
2 植物组织水势的测定(小液流法)2 必修综合 2掌握植物组织水势的测定方法,并了解渗透系统中水势大小是水分移动方向的决定因素。
3 根系活力的测定(氯化三苯四氮唑法)3 必修综合 2掌握快速测定根系活力的方法,了解实验方法所依据的原理,比较不同根系活力的区别。
4 单盐毒害及离子间拮抗作用2 必修验证 2通过实验说明培养时培养液中各种离子平衡(各种离子浓度)的重要性。
5 硝酸还原酶活性的测定(活体法)3 必修综合 2掌握硝酸还原酶活性的测定方法,加深对硝酸还原酶在植物氮素代谢中的重要作用的理解。
6 植物灰分元素的分析鉴定2 必修验证 1通过实验了解植物体中存在的一些常量元素。
7 叶绿体色素的提取、分离及理化性质的鉴定3 必修验证 2以植物叶片为材料,提取叶绿体色素,以纸层析法分离其成分;鉴定叶绿体色素的理化性质。
8 离体叶绿体的光还原作用3 必修综合 2分离叶绿体,通过观察离体叶绿体对染料的还原作用,了解光合作用在叶绿体中进行的光还原。
序号实验项目名称时数实验要求实验类型每组人数实验目的及要求9 植物呼吸强度的测定(呼吸比重瓶法)2 必修综合 2熟悉呼吸强度的测定原理及方法,并能分析实验误差的原因。


一.实验内容实验1 MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯) 0.25%硫代巴妥酸 (纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-250 95%乙醇 85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met) NBT EDTA-Na2 核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0) 30% H2O2实验五:Apx(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12) (乙=胺四乙酸=钠)EDTA—Na2 PBS (pH7.0) 30%H2O实验6: ASA(维生素C)含量测定偏磷酸 95%乙醇磷酸 4% 2,2-二联吡啶 FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽, 媚力肽GSH GSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2O DTNB(二硫代硝基苯甲酸) PBS (PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸 85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1. 酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1% (m/v) 聚乙烯吡哆烷酮PVP),0.1mmol/L EDTANa2或EDTA),也可为(内含2% (m/v)PVP),0.2mmol/L EDTA Na2或EDTA)(先配制后用缓冲液定容)2. ASA . GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml. 50mmol/L磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA . GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na 2 : 0.1mmol/L (37.2mg EDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:① Na2HPO4·12H2O ② NaH2PO4·2H2O取① 71.64g,蒸馏水定容至1L,取② 31.21g定容至1L,放置4℃冰箱备用PH=7.8 取① 91.5ml+② 8.5ml=100ml (浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml (0.2mol/L*0.1=0.05mol/L*V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100 ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸 (纯) 称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入 4ml 0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定 OD532,OD600,OD450值↓按公式求 MDA浓度=6.45×(OD532-OD600)-0.56OD450 (μmol/L)可溶性糖浓度=11.71×OD450 (mmol/L)最后计算 MDA含量(μmol/g FW)= [4×(MDA浓度x)×10-3/0.1]同时,可测得可溶性糖含量(m mol/g FW)= 4×(可溶性糖浓度χ)×10-3/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。


一.实验内容实验1 MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯) 0.25%硫代巴妥酸 (纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-250 95%乙醇 85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met) NBT EDTA-Na2 核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0) 30% H2O2实验五:Apx(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12) (乙=胺四乙酸=钠)EDTA—Na2 PBS (pH7.0) 30%H2O实验6: ASA(维生素C)含量测定偏磷酸 95%乙醇磷酸 4% 2,2-二联吡啶 FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽, 媚力肽GSH GSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2O DTNB(二硫代硝基苯甲酸) PBS (PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸 85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1. 酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1% (m/v) 聚乙烯吡哆烷酮PVP),0.1mmol/L EDTANa2或EDTA),也可为(内含2% (m/v)PVP),0.2mmol/L EDTA Na2或EDTA)(先配制后用缓冲液定容)2. ASA . GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml. 50mmol/L磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA . GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na 2 : 0.1mmol/L (37.2mg EDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:① Na2HPO4·12H2O ② NaH2PO4·2H2O取① 71.64g,蒸馏水定容至1L,取② 31.21g定容至1L,放置4℃冰箱备用PH=7.8 取① 91.5ml+② 8.5ml=100ml (浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml (0.2mol/L*0.1=0.05mol/L*V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100 ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸 (纯) 称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入 4ml 0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定 OD532,OD600,OD450值↓按公式求 MDA浓度=6.45×(OD532-OD600)-0.56OD450 (μmol/L)可溶性糖浓度=11.71×OD450 (mmol/L)最后计算 MDA含量(μmol/g FW)= [4×(MDA浓度x)×10-3/0.1]同时,可测得可溶性糖含量(m mol/g FW)= 4×(可溶性糖浓度χ)×10-3/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。
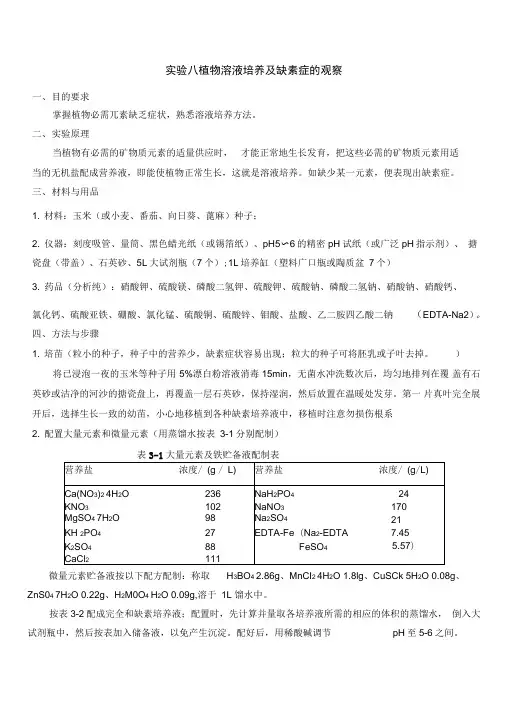
实验八植物溶液培养及缺素症的观察一、目的要求掌握植物必需兀素缺乏症状,熟悉溶液培养方法。
二、实验原理当植物有必需的矿物质元素的适量供应时,才能正常地生长发育,把这些必需的矿物质元素用适当的无机盐配成营养液,即能使植物正常生长,这就是溶液培养。
如缺少某一元素,便表现出缺素症。
三、材料与用品1. 材料:玉米(或小麦、番茄、向日葵、蓖麻)种子;2. 仪器:刻度吸管、量筒、黑色蜡光纸(或锡箔纸)、pH5〜6的精密pH试纸(或广泛pH指示剂)、搪瓷盘(带盖)、石英砂、5L大试剂瓶(7个);1L培养缸(塑料广口瓶或陶质盆7个)3. 药品(分析纯):硝酸钾、硫酸镁、磷酸二氢钾、硫酸钾、硫酸钠、磷酸二氢钠、硝酸钠、硝酸钙、氯化钙、硫酸亚铁、硼酸、氯化锰、硫酸铜、硫酸锌、钼酸、盐酸、乙二胺四乙酸二钠(EDTA-Na2)。
四、方法与步骤1. 培苗(粒小的种子,种子中的营养少,缺素症状容易出现;粒大的种子可将胚乳或子叶去掉。
)将已浸泡一夜的玉米等种子用5%漂白粉溶液消毒15min,无菌水冲洗数次后,均匀地排列在覆盖有石英砂或洁净的河沙的搪瓷盘上,再覆盖一层石英砂,保持湿润,然后放置在温暖处发芽。
第一片真叶完全展开后,选择生长一致的幼苗,小心地移植到各种缺素培养液中,移植时注意勿损伤根系2. 配置大量元素和微量元素(用蒸馏水按表3-1分别配制)微量元素贮备液按以下配方配制:称取H3BO4 2.86g、MnCI2 4H2O 1.8lg、CuSCk 5H2O 0.08g、ZnS04 7H2O 0.22g、H2M0O4 H2O 0.09g,溶于1L 馏水中。
按表3-2配成完全和缺素培养液;配置时,先计算并量取各培养液所需的相应的体积的蒸馏水,倒入大试剂瓶中,然后按表加入储备液,以免产生沉淀。
配好后,用稀酸碱调节pH至5-6之间。
表3-2完全培养液和各种缺素培养液配制表(每5L培养液中各种贮备液的用量/ ml)储备液完全缺N缺P缺K缺Ca缺Mg缺FeCa(NO3)225——2525——2525KNO325——25——252525MgSO42525252525——25KH2PO42525————252525K2SO4——255————————CaCI2——25——————————NaH2PO4——————25——————NaNO3——————2525————Na2SO4——————————25——EDTA-Fe252525252525——微里元糸55555553. 幼苗移栽与管理取7个1L的培养缸(塑料广口瓶或陶质盆),分别装入配制的完全培养液及各种缺素培养液900mL (放3株?),贴上标签,写明日期。

《—植物生理学—》实验指导书王娜编写适用专业:生物技术江苏科技大学生物与环境工程学院2009年11月前言本实验指导主要为了配合理论教学而编写的。
进行植物生命活动中一些最基本的过程(水分吸收、矿物质代谢、光合作用、生长调节物质、植物生长以及逆境生理等)的定性、定量测定和某些物质的分离提取,学习植物生理学中最基本的实验技术和方法;要求学生掌握植物生理学实验的基本原理和方法,掌握生理实验中一些常规仪器和设备的原理和操作方法,提高学生的动手能力,加强学生对理论教学内容的理解,并为以后的科研活动和撰写科研论文打下基础。
同时,按照“素质教育”要求,以培养面向21世纪具有一定创新能力的人才为目标。
在必修的验证性实验:植物组织水势的测定,硝酸还原酶活性的测定,吲哚乙酸氧化酶活性的测定,种子发芽率的快速测定的基础上,尽量结合当前生产和科研工作的需要,增加了研究性实验和综合性实验内容。
综合性实验如叶片色素的提取分离、色素性质及含量测定;研究性实验如高温胁迫下小麦幼苗体内渗透调节物质含量测定。
通过设计性和综合性实验注重学生动手能力、思辩能力和创造能力的培养,符合培养既有扎实基础知识又有创新思维能力的教改方向,有利于增强学生独立工作、解决问题的能力。
目录实验一植物组织水势的测定 (1)实验二硝酸还原酶活性的测定 (3)实验三叶片色素的提取分离、色素性质及含量的测定 (6)实验四吲哚乙酸氧化酶活性的测定 (10)实验五种子发芽率的快速测定 (12)实验六高温胁迫下小麦幼苗体内渗透调节物质含量测定 (15)实验一植物组织水势的测定(长度法和小液流法)实验学时:2实验类型:验证实验要求:必修一、实验目的1、了解水势的概念及其对植物吸收外界水分的作用。
2、熟练掌握长度法和小液流法测定植物组织水势的原理和方法。
二、实验内容配制一系列梯度的蔗糖溶液,通过放入其中的土豆条的吸水和失水,使土豆条长度和外界溶液发生浓度的变化,进而判断出等渗溶液,计算出水势。

植物生理学实验引言植物生理学实验是研究植物生长和发育过程中的生理过程的一种科学方法。
通过对植物进行不同条件下的实验观察和分析,可以了解植物对外界环境的适应能力、生长调控机制等重要信息。
本文将介绍几个常见的植物生理学实验,包括光合作用实验、呼吸作用实验和植物生长调控实验。
实验一:光合作用实验实验目的研究光合作用在植物生理过程中的影响。
实验材料和仪器•适用于实验的植物样本•光照箱•光合作用测定仪器(如光合速率测定仪)实验步骤1.准备植物样本,并将其放置于光照箱中。
2.分别设置不同光照强度(如低光、中光、高光)的条件,并记录光照强度。
3.使用光合速率测定仪器,测定每个条件下的光合速率。
4.分析结果并得出结论。
实验结果和讨论根据实验结果,可以得出光照强度对光合作用速率的影响。
光照强度越高,光合作用速率越快,因为光合作用需要光能作为能量来源。
这个实验表明了光合作用对植物生长和发育的重要性,同时也可以用于评估植物对不同光照条件下的适应能力。
实验二:呼吸作用实验实验目的研究植物呼吸作用的过程和机制。
实验材料和仪器•成活的植物样本•呼吸速率测定仪器实验步骤1.准备植物样本并放置于呼吸速率测定仪器中。
2.记录植物在不同条件下的呼吸速率,如不同温度、不同光照等。
3.分析结果并得出结论。
实验结果和讨论通过呼吸速率的测定,可以了解到不同条件下植物呼吸的强度和速率。
温度对植物呼吸速率的影响比较显著,一般情况下,随着温度的升高,植物呼吸速率也会提高。
这个实验可以帮助我们理解植物的能量代谢过程,为植物生长和发育的调控机制提供重要信息。
实验三:植物生长调控实验实验目的研究不同条件对植物生长和发育的调控作用。
实验材料和仪器•可控环境设备(如生长箱)•不同生长因子的处理液(如植物激素)实验步骤1.准备植物样本,并将其种植在生长箱中。
2.设置不同生长条件,如温度、湿度、光照等,并记录相关参数。
3.分别加入不同处理液,如植物激素,观察植物生长和发育的变化。
实验1 植物组织渗透势的测定(质壁分离法)原理当植物组织细胞内的汁液与其周围的某种溶液处于渗透平衡状态,植物细胞内的压力势为零时,细胞汁液的渗透势就等于该溶液的渗透势。
该溶液的浓度称为等渗浓度。
当用一系列梯度浓度溶液观察细胞质壁分离现象时,细胞的等渗浓度将介于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离的浓度之间的深液浓度。
代入公式即可计算出春渗透势。
仪器药品显微镜载玻片及盖玻片镊子刀片配成0.5—0.1mol/L梯度浓度的蔗糖溶液各50ml。
称34.23g蔗糖用蒸馏水配成100ml,其浓度为1m0le/L(母液)。
再配制成下列各种浓度:0.50mol/L:吸母液25ml+水25ml0.45mol/L:吸母液22.5ml+水27.5ml0.40mol/L:吸母液20.0ml+水30.0ml0.35mol/L:吸母液17.5ml+水32.5ml0.30mol/L:吸母液15.0ml+水35.0ml0.25mol/L:吸母液12.5ml+水37.5ml0.20mol/L:吸母液10.0ml+水40.0ml0.15mol/L:吸母液7.5ml+水42.5ml0.10mol/L:吸母液5.0ml+水45.0ml操作步骤将带有色素的植物组织(叶片),一般选用有色素的洋葱鳞片的外表皮、紫鸭跖草、苔藓、红甘蓝或黑藻、丝状藻等水生植物,也可用蚕豆、玉米、小麦等作物叶的表皮。
撕取下表皮,迅速分别投入各种浓度的蔗糖溶液中,使其完全浸入,5—10分钟后,从0.5mol/L开始依次取出表皮薄片放在滴有同样溶液的载玻片上,盖上盖玻片,于低倍显微镜下观察,如果所有细胞都产生质壁分离的现象,则取低浓度溶液中的制片作同样观察,并记录质壁分离的相对程度。
实验中必须确定一个引起半数以上细胞原生质刚刚从细胞壁的角隅上分离的浓度,和不引起质壁分离的最高浓度。
在找到上述浓度极限时,用新的溶液和新鲜的叶片重复进行几次,直至有把握确定为止。
植物生理学实验指导内蒙古大学生命科学学院植物生理实验室目录实验一植物组织水势的测定(小液流法)实验二植物组织渗透势的测定(质壁分离法)实验三小孔的扩散(示范)实验四植物灰分常量元素分析实验五植物的溶液培养与矿质元素缺乏症实验六叶绿体色素的提取与分离实验七光合色素的的性质实验八叶绿素a和b含量的测定(分光光度法)实验九环境因素对光合作用的影响实验十改良半叶法测大田光合作用强度实验十一植物呼吸强度的测定(小篮子法)实验十二种子生命力的快速测定(TTC法)实验十三种子生命力的快速测定(红墨水法)实验十四脯氨酸含量的测定实验十五*氮蓝四唑(NBT)法测定超氧物歧化酶(SOD)活力实验十六植物组织中丙二醛含量的测定实验十七*过氧化物酶活性的测定实验十八*植物抗逆性的测定(电导仪法)实验一植物组织水势的测定(小液流法)【实验目的】了解小液流法测定植物组织水势的原理,掌握其测定方法。
【实验原理】水势(ψw)表示水的化学势,像电流由高电位处流向低电位处一样,水从水势高处流向水势低处(代表水的能量水平)。
植物组织的水分状况可用水势表示。
植物体组织之间、细胞之间以及植物体与环境间的水分移动方向都由水势差决定。
当植物细胞或组织放在已知水势的一系列溶液中时,如果植物的水势(ψw)小于某一溶液的渗透势(ψπ),则组织吸水而使溶液浓度变大;反之,则植物细胞失水而使溶液浓度变小;若植物组织的水势与溶液的渗透势相等,则二者水分保持动态平衡,外部溶液浓度不变,此溶液的渗透势即等于所测植物组织的水势。
根据溶液的浓度不同其比重亦不同的原理确定与植物组织等水势的溶液浓度。
然后按公式计算其水势。
【实验用品】1.仪器:剪刀镊子解剖刀打孔器试管移液管毛细吸管(尖端弯成900)2.试剂:1mol/L蔗糖溶液;次甲基蓝粉末,3.材料:胡萝卜块根(或小麦幼苗、燕麦幼苗、菠菜叶片)【实验方法】1. 取8支试管并编号,按编号顺序放在试管架上,用1mol/L蔗糖溶液配制0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8mol/L蔗糖溶液各10mL,各管都加上橡胶或软木塞子。
植物生理学实验讲义吴恩岐内蒙古师范大学生命科学与技术学院2007.4实验1 植物组织水势的测定(小液流法)一、目的学会用小液流法测定植物组织的水势二、材料用具及仪器药品花生叶片、试管、移液管(10ml, 0.1ml)、吸球、镊子、小方块、钻孔器、牙签、玻棒、蔗糖、次甲基蓝三、原理当把植物组织或细胞放在溶液中时,两者便会发生水分交换。
如果植物组织(或细胞)的水势低于溶液的水势,组织(或细胞)则吸水,使外溶液浓度增大,比重也增大;若植物组织(或细胞)的水势高于溶液的水势时,组织(或细胞)则失水,使溶液的浓度变小,比重也变小;如果植物组织(或细胞)的水势与溶液的水势相等时,外溶液的浓度不变,其比重也不变,若把浸过组织的溶液慢慢滴回同一浓度而未浸过组织或细胞的溶液中。
比重小的液流便往上浮,比重大的则往下沉。
如果小液流停止不动,则说明溶液的浓度未有发生改变。
此溶液的渗透势(水势)即等于所测组织(或细胞)的水势。
根据溶液的浓度,可以用公式(ψs=-CiRT), 计算出溶液的渗透势(ψw so1=ψs so1)ψs表示渗透势。
R表示气体常数:0.0083 MPa·l/mol·K。
T表示绝对温度,即273+实验时(℃)i表示解离系数。
四、方法步骤1.将1mol/L蔗糖溶液的母液分别配成0.1、0.2、0.3、 0 4、0.5、0.6mol/L的蔗糖溶液各10ml,分别注入6支大试管中,摇匀。
2.从上述的大试管中各取2ml溶液,分别放到另6支小试管中,各试管塞上软木塞。
3.用钻孔器钻取叶圆片(花生叶、菠菜均可),依次分别在小试管的蔗糖溶液中各放入叶圆片40片(钻孔器的直径为6mm),叶圆片要全部浸在溶液中,塞上塞子,每隔5分钟摇动一次。
4.30分钟后,用牙签取次甲基蓝结晶少许,分别投入小试管中,摇匀。
5.用0.1ml的移液管从小试管中吸取溶液约0.1ml,然后将之插之相对应浓度的大试管中的中部,慢慢放出蓝色液,并观察记录小液流的流向,从中找出小液流停止不动的该溶液的浓度(每一浓度配备0.1ml移液管一支)。