大学无机化学热力学定律全解共49页文档
- 格式:ppt
- 大小:4.89 MB
- 文档页数:25

大专无机化学知识点总结无机化学是化学学科的一个重要分支,对于大专阶段的学习来说,掌握好无机化学的知识点至关重要。
以下是对大专无机化学中一些重要知识点的总结。
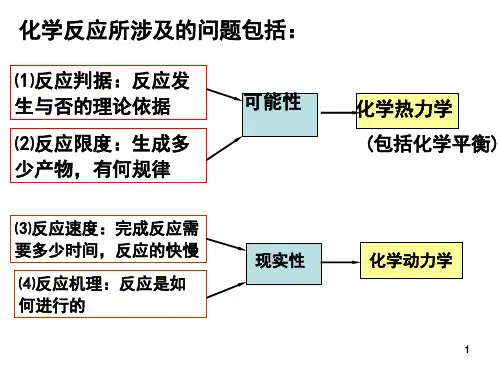
一、化学热力学基础1、热力学第一定律能量守恒定律在热力学中的体现,即能量可以在不同形式之间转化,但总量保持不变。
对于一个封闭系统,热力学能的变化等于吸收的热与所做的功之和。
2、焓变在恒压条件下,反应的热效应等于焓变(ΔH)。
焓变可以通过反应物和生成物的标准生成焓计算得出。
3、熵变用来描述系统混乱度的热力学函数。
熵值越大,系统的混乱度越高。
对于一个自发的过程,总熵变通常是增加的。
4、自由能变自由能变(ΔG)是判断一个反应能否自发进行的重要依据。
当ΔG < 0 时,反应自发进行;当ΔG = 0 时,反应达到平衡;当ΔG > 0 时,反应不能自发进行。
二、化学反应速率1、反应速率的表示通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示反应速率。
2、浓度对反应速率的影响反应速率与反应物浓度的幂次方成正比,这一关系可以用质量作用定律来描述。
3、温度对反应速率的影响温度升高,反应速率加快。
这是因为温度升高,分子的运动速率加快,有效碰撞的几率增加。
4、催化剂对反应速率的影响催化剂能够改变反应的途径,降低反应的活化能,从而加快反应速率。
三、化学平衡1、化学平衡的特征正逆反应速率相等,各物质的浓度不再发生变化。
2、平衡常数对于一个特定的化学反应,在一定温度下,其平衡常数是一个定值。
平衡常数的大小可以反映反应进行的程度。
3、影响化学平衡的因素浓度、温度、压力等因素的改变会导致化学平衡的移动。
遵循勒夏特列原理,即如果改变影响平衡的一个条件,平衡就会向着能够减弱这种改变的方向移动。
四、酸碱平衡1、酸碱质子理论能给出质子的物质是酸,能接受质子的物质是碱。
酸和碱之间存在着相互依存的关系,称为共轭酸碱对。
2、酸碱的强度用酸或碱的解离常数来衡量其强度。
解离常数越大,酸或碱的强度越强。