物理化学教学指导-热力学第二定律
- 格式:doc
- 大小:404.00 KB
- 文档页数:18

《热力学第二定律》讲义一、热力学第二定律的引入在我们生活的这个世界中,热现象无处不在。
从烧开水时的水汽蒸腾,到冬天取暖时的热量传递,热的变化和流动贯穿于我们的日常生活。
而热力学第二定律,则是用来描述热现象中能量转换和传递的重要规律。
想象一下,一个热的物体和一个冷的物体相互接触,热量会自发地从热的物体流向冷的物体,直到它们的温度相等。
但是,你有没有想过,为什么热量不会自发地从冷的物体流向热的物体呢?这就是热力学第二定律所要探讨的核心问题之一。
二、热力学第二定律的表述热力学第二定律有多种表述方式,其中最常见的有克劳修斯表述和开尔文表述。
克劳修斯表述:热量不能自发地从低温物体传递到高温物体而不引起其他变化。
开尔文表述:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
为了更好地理解这两种表述,我们来举几个例子。
假如在一个封闭的房间里,有一台没有外接电源的冰箱。
如果热量能够自发地从冰箱内部的低温区传递到外部的高温环境,那么冰箱内部就会越来越冷,而房间却不会因为接收了这些热量而有任何其他变化。
但在现实中,这是不可能发生的。
再比如,有一个热机,它从高温热源吸收了一定的热量,并将其中一部分转化为有用功。
如果能够从单一热源吸收热量并完全转化为有用功,而不向低温热源排放任何热量,那么这样的热机就是“永动机”,但根据热力学第二定律,这种情况是不可能实现的。
三、热力学第二定律的实质热力学第二定律的实质是揭示了自然界中一切与热现象有关的实际过程都是不可逆的。
什么是不可逆过程呢?比如说,一滴墨水滴入一杯清水中,墨水会逐渐扩散,最终使整杯水都变得有颜色。
但是,我们不可能让这杯已经混合均匀的水自动地恢复到墨水和清水分离的状态。
再比如,一块光滑的冰块在常温下会逐渐融化成水,而这些水不会自动地再重新凝结成原来形状规则的冰块。
这些过程一旦发生,就无法自发地逆向进行,这就是不可逆过程。
而热力学第二定律正是说明了这类不可逆过程的方向性。


1 基本要求[TOP]1.1 理解热力学第二定律的建立过程,存在一个熵状态函数及理解引入亥姆霍兹能和吉布斯能的原因;1.2 掌握状态函数特性及在某变化中状态函数变量与特定过程函数关系;1.3 掌握克劳修斯不等式基础上得出的对某变化可逆性判断或不可逆程度的度量;1.4 理解如何从可逆性判据演变成特定条件下的平衡判据,并用以确定过程的方向和限度;1.5 掌握理想气体在变化中状态函数及过程函数的计算;1.6 掌握在相变化中(可逆、不可逆)状态函数及过程函数的计算;1.7 理解热力学第三定律及规定熵的意义;1.8 掌握在化学变化中标准状态函数的计算和意义;1.9 掌握吉布斯-亥姆霍兹公式;1.10 理解多组分体系偏摩尔量的意义,掌握化学势的意义及应用;1.11 了解非平衡态热力学。
2 重点难点[TOP]2.1 重点掌握热力学第二定律,学会判断变化过程的可逆性与不可逆性,以及在此基础上掌握特定条件下的平衡判据。
掌握变化过程中状态函数与过程函数的计算。
理解多组分体系偏摩尔量的意义,化学势的意义和应用。
2.2 难点应用热力学第二定律判断过程的可逆与不可逆性;熵变的计算;熵函数的物理意义;各种变化过程吉布斯能等状态函数的计算;自发变化方向和限度的判据;热力学函数之间的关系;区别偏摩尔量和化学势。
3 讲授学时[TOP]建议10~12学时4 内容提要 [TOP] 第一节 第二节 第三节 第四节 第五节 第六节 第七节第八节 第九节 第十节 第十一节 第十二节 第十三节 第十四节4.1 第一节自发过程的特征4.1.1 自发过程具有方向的单一性和限度 4.1.2 自发过程的不可逆性 4.1.3 自发过程具有作功的能力 4.2 第二节 热力学第二定律 [TOP] 4.2.1 克劳修斯表述“热量由低温物体传给高温物体而不引起其它变化是不可能的”。
4.2.2 开尔文表述“从单一热源取出热使之完全变为功,而不发生其他变化是不可能的”。




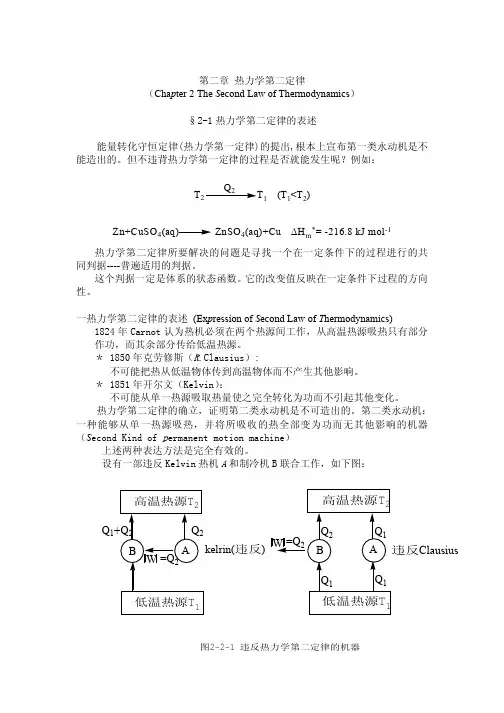

热力学第二定律具体内容:热力学第二定律是热力学定律之一,是指热永远都只能由热处转到冷处.热力学第二定律是描述热量的传递方向的分子有规则运动的机械能可以完全转化为分子无规则运动的热能;热能却不能完全转化为机械能.此定律的一种常用的表达方式是,每一个自发的物理或化学过程总是向著熵(entropy)增高的方向发展.熵是一种不能转化为功的热能.熵的改变量等于热量的改变量除以绝对温度.高、低温度各自集中时,熵值很低;温度均匀扩散时,熵值增高.物体有秩序时,熵值低;物体无序时,熵值便增高.现在整个宇宙正在由有序趋于无序,由有规则趋于无规则,宇宙间熵的总量在增加.克劳修斯表述不可能把热量从低温物体传到高温物体而不引起其他变化.开尔文表述不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响.开尔文表述还可以表述成:第二类永动机不可能造成.若要简捷热能不能完全转化为机械能,只能从高温物体传到低温物体。

热力学第二定律1.热力学第二定律:通过热功转换的限制来研究过程进行的方向和限度。
2.热力学第二定律文字表述:第二类永动机是不可能造成的。
(从单一热源吸热使之完全变为功而不留下任何影响。
)3.热力学第二定律的本质: 一切自发过程,总的结果都是向混乱度增加的方向进行(a. 热与功转换的不可逆性; b.气体混合过程的不可逆性; c.热传导过程的不可逆性)4.热力学第二定律的数学表达式:Clausius 不等式5.卡诺循环→热机效率(即:热转化为功的限度有多大?)→卡诺定理(所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。
)→从卡诺循环得到结论:热效应与温度商值的加和等于零。
→任意可逆循环热温商的加和等于零→熵的引出→熵的变化值可用可逆过程的热温商值来衡量→Clausius 不等式:d QS Tδ≥→熵增加原理(熵增加原理)→把与体系密切相关的环境也包括在一起,用来判断过程的自发性(∆S iso =∆S (体系)+∆S (环境)≥0):“>” 号为自发过程;“=” 号为可逆过程) 6.等温过程的熵变:(1)理想气体等温变化:∆S =nRln(V 2/V 1)=nRln(P 1/P 2);(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程): ∆S(相变)=∆H (相变)/T(相变);(3)理想气体(或理想溶液)的等温混合过程:∆S =-R ∑n B lnx B 7. 变温过程的熵变:(1)等容变温:⎰=∆21d m ,T TV TTnC S(2)等压变温:(3):8.标准压力下,求反应温度T 时的熵变值:9.用熵作为判据时,体系必须是孤立体系,也就是说必须同时考虑体系和环境的熵变,这很不方便→有必要引入新的热力学函数,利用体系自身状态函数的变化,来判断自发变化的方向和限度。
因此引入新的函数:亥姆霍兹函数A=U-TS 与吉布斯函数G=H-TS 。
10.等温、可逆过程中,体系对外所作的最大功等于体系亥姆霍兹函数的减少值;自发变化总是朝着亥姆霍兹函数减少的方向进行。

第三章 热力学第二定律§3.1 热力学第二定律1.自发过程自发过程:在自然条件下,能够发生的过程,称为自发过程。
自发过程的逆过程称为非自发过程。
所谓自然条件,是指不需要人为加入功的过程。
例如:(1) 热量从高温物体传入低温物体; (2)气体向真空膨胀;(3)锌片与硫酸铜的置换反应等,。
说明:自发过程是热力学中的不可逆过程,这是自发过程长的共同特征。
自发过程的逆过程都不能自动进行,自发过程的逆向必须消耗功。
2.热、功转换任何热机从高温1T 热源吸热1Q ,一部分转化为功W ,另一部分2Q 传给低温2T 热源。
将热机所作的功与所吸的热之比值称为热机效率,或称为热机转换系数,用η表示。
恒小于1。
即1W Q η-=若热机不向低温热源散热,20Q =,此时热机效率可达到100%,将所吸收的热全部变为功,实践证明这样的机器永远造不成。
人们将这种从单一热源吸热全部用来对外作功的机器,称为第二永动机。
2.热力学第二定律克劳修斯(Clausius )的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。
”开尔文(Kelvin )的说法:“不可能从单一热源取出热使之完全变为功,而不发生其他的变化。
”克劳修斯和开尔文的说法都是指某一件事情是“不可能”的,即指出某种自发过程的逆过程是不能自动进行的。
克劳修斯的说法是指明热传导的不可逆性,开尔文的说法是指明功转变为热的过程的不可逆性,这两种说法实际上是等效的。
热力学第二定律和热力第一定律一样,是建立在无数事实的基础上,是人类经验的总结。
它不能从其它更普遍的定律推导出来。
§3.2 卡诺循环与卡诺定理1.卡诺循环(Carnot cycle )卡诺循环:由恒温可逆膨胀、绝热可逆膨胀、恒温可逆压缩、绝热可逆压缩四个可逆步骤组成的循环过程。
以理想气体为工作物质,从高温T 1热源吸收Q 1的热量,一部分通过理想热机用来对外做功W ,另一部分的热量Q 2放给低温T 2热源。
物理学中的热力学第二定律知识点热力学第二定律是热力学的基本定律之一,它描述了热量的传递方式以及自然界中不可逆过程的方向性。
本文将介绍热力学第二定律的基本概念、表述方式以及其应用领域。
一、热力学第二定律的基本概念热力学第二定律是关于热力学过程不可逆性的一个重要定律。
它主要包含以下几个基本概念:1. 热机热机是将热能转化为机械能的装置,例如汽车发动机和蒸汽机等。
热机的工作过程既有可逆过程,也有不可逆过程。
2. 热源和冷源热源是指能够提供热量的物体或系统,通常温度较高;而冷源是指能够吸收热量的物体或系统,通常温度较低。
3. 热量的传递热量的传递可以通过传导、对流和辐射等方式实现。
无论哪种方式,热量总是从高温物体流向低温物体。
二、热力学第二定律的表述方式热力学第二定律可以通过多种形式进行表述,其中常见的包括以下几种方式:1. 克劳修斯表述克劳修斯表述(Clausius statement)认为,不可能自发地把热量从低温物体传递给高温物体,而不引起其他效应。
2. 开尔文表述开尔文表述(Kelvin statement)认为,不可能从单一热源吸热,完全转化为功而无余热放出。
3. 普朗克表述普朗克表述(Planck statement)将热力学第二定律表述为熵的不减原理,即任何孤立系统的熵都不会减少。
三、热力学第二定律的应用领域热力学第二定律在许多领域都有重要应用,以下列举几个常见的应用领域:1. 热机效率热力学第二定律对热机效率的理论上限进行了限制。
热机效率是指工作输出与热量输入之比,根据卡诺热机的理论,最高效率可达到1-T2/T1,其中T1和T2分别为热机的高温热源和低温热源的温度。
2. 熵增定律根据热力学第二定律,孤立系统内的熵总是增加的。
这一原理被广泛应用于化学反应、生物学和工程领域等。
3. 热泵和制冷系统热力学第二定律为热泵和制冷系统的工作原理提供了理论基础。
热泵是将热量从低温区域传递到高温区域的装置,而制冷系统则是将热量从低温区域排出以降低温度。
热二定律总结一、热力学第二定律克劳修斯说法:热不能自动从低温物体传给高温物体而不产生其他变化开尔文说法:不可能从单一热源吸热使之全部对外做功而不产生其他变化典型例题:判断:1、某体系从单一热源吸收100 kJ热量,对外做功100 kJ,该过程不符合热力学第二定律。
(X)2、某循环过程,体系从环境吸收100 kJ热量,对外做功100 kJ,该过程不符合热力学第二定律。
(X)3、某过程体系从环境吸收100 kJ热量,对外做功100 kJ,同时,系统复原,该过程不符合热力学第二定律。
(X)二、热机和卡诺循环任意热机效率:η = -W/Q1 = (Q1+Q2)/Q1卡诺循环:1、等温可逆膨胀;2、绝热可逆膨胀(等熵膨胀);3、等温可逆压缩;4、绝热可逆压缩(等熵压缩)可逆热机(卡诺热机)效率:η = 1-T2/T1对可逆热机,有Q1/T1 + Q2/T2 = 0卡诺定理:在两个不同温度的热源之间工作的所有热机,以可逆热机效率最大。
推论:所有卡诺热机的效率都相等。
典型例题:1、理想气体卡诺循环的图为下列四种情况中的哪一种?2、 判断:真实气体做为热机工质,经卡诺循环后,其热机效率低于以理想气体做为工质的可逆热机的效率。
三、 熵与克劳修斯不等式熵的定义:注意:熵是可逆热温商的积分,熵和热没有直接关系!克劳修斯不等式:(>,不可逆,=,可逆)如果是绝热过程: ΔS ≥0 (>,不可逆,=,可逆)(熵增原理)如果把系统及其相连的环境看成一个整体,则:ΔS iso =ΔS sys +ΔS amb ≥ 0(>,不可逆,=,可逆)(熵判据:判断过程是否自发)注意此公式的应用条件:绝热系统,或把系统和与之相连环境看成一个大的孤立系统。
不可只计算环境熵变,并以此判断过程自发与否。
典型例题:1、 判断:冰在0℃,101.325 kPa 下转变为液态水,其熵变>0,所以该过程为自发过程。
2、 判断:相变过程的熵变可由 计算。
第三章 热力学第二定律主要公式及使用条件1. 热机效率1211211/)(/)(/T T T Q Q Q Q W -=+=-=η式中1Q 和2Q 分别为工质在循环过程中从高温热源T 1吸收的热量和向低温热源T 2放出的热。
W 为在循环过程中热机中的工质对环境所作的功。
此式适用于在任意两个不同温度的热源之间一切可逆循环过程。
2. 卡诺定理的重要结论2211//T Q T Q +⎩⎨⎧=<可逆循环不可逆循环,,00任意可逆循环的热温商之和为零,不可逆循环的热温商之和必小于零。
3. 熵的定义4. 克劳修斯不等式d S {//Q T Q T =>δ, δ, 可逆不可逆5. 熵判据a mb s y s i s o S S S ∆+∆=∆{0, 0, >=不可逆可逆 式中iso, sys 和amb 分别代表隔离系统、系统和环境。
在隔离系统中,不可逆过程即自发过程。
可逆,即系统内部及系统与环境之间皆处于平衡态。
在隔离系统中,一切自动进行的过程,都是向熵增大的方向进行,这称之为熵增原理。
此式只适用于隔离系统。
6. 环境的熵变rd δ/S Q T =ambys amb amb amb //S T Q T Q s -==∆7. 熵变计算的主要公式222r 111δd d d d Q U p V H V p S T T T+-∆===⎰⎰⎰ 对于封闭系统,一切0=W δ的可逆过程的S ∆计算式,皆可由上式导出(1),m 2121ln(/)ln(/)V S nC T T nR V V ∆=+,m 2112ln(/)ln(/)p S nC T T nR p p ∆=+,m 21,m 21ln(/)ln(/)V p S nC p p nC V V ∆=+上式只适用于封闭系统、理想气体、,m V C 为常数,只有pVT 变化的一切过程(2) T 2112l n (/)l n (/)S n R V V n R p p ∆== 此式使用于n 一定、理想气体、恒温过程或始末态温度相等的过程。
物理化学教学指导-热力学第二定律物理化学第二章热力学第二定律首页基本要求重点难点讲授学时内容提要1 基本要求[TOP]1.1 理解热力学第二定律的建立过程,存在一个熵状态函数及理解引入亥姆霍兹能和吉布斯能的原因;1.2 掌握状态函数特性及在某变化中状态函数变量与特定过程函数关系;1.3 掌握克劳修斯不等式基础上得出的对某变化可逆性判断或不可逆程度的度量;1.4 理解如何从可逆性判据演变成特定条件下的平衡判据,并用以确定过程的方向和限度;1.5 掌握理想气体在变化中状态函数及过程函数的计算;1.6 掌握在相变化中(可逆、不可逆)状态函数及过程函数的计算;1.7 理解热力学第三定律及规定熵的意义;1.8 掌握在化学变化中标准状态函数的计算和意义;1.9 掌握吉布斯-亥姆霍兹公式;1.10 理解多组分体系偏摩尔量的意义,掌握化学势的意义及应用;1.11 了解非平衡态热力学。
2 重点难点[TOP]2.1 重点掌握热力学第二定律,学会判断变化过程的可逆性与不可逆性,以及在此基础上掌握特定条件下的平衡判据。
掌握变化过程中状态函数与过程函数的计算。
理解多组分体系偏摩尔量的意义,化学势的意义和应用。
2.2 难点应用热力学第二定律判断过程的可逆与不可逆性;熵变的计算;熵函数的物理意义;各种变化过程吉布斯能等状态函数的计算;自发变化方向和限度的判据;热力学函数之间的关系;区别偏摩尔量和化学势。
3 讲授学时[TOP]建议10~12学时4 内容提要[TOP]第一节第二节第三节第四节第五节第六节第七节第八节第九节第十节第十一节第十二节第十三节第十四节4.1 第一节自发过程的特征4.1.1 自发过程具有方向的单一性和限度4.1.2 自发过程的不可逆性4.1.3 自发过程具有作功的能力4.2 第二节热力学第二定律[TOP]4.2.1 克劳修斯表述“热量由低温物体传给高温物体而不引起其它变化是不可能的”。
4.2.2 开尔文表述“从单一热源取出热使之完全变为功,而不发生其他变化是不可能的”。
4.3 第三节卡诺循环[TOP]4.3.1 卡诺循环1824年,法国工程师卡诺(S.Carnot)研究热转变为功的规律,设计了由四步可逆过程构成的一个循环过程,人们称为卡诺循环。
(1)等温(T2)可逆膨胀,由p1V1到p2V2 (A→B)(2)绝热可逆膨胀,由p2V2到p3V3 (B→C)(3)等温(T1)可逆压缩,由p3V3到p4V4 (C→D)(4)绝热可逆压缩,由p4V4到p1V1 (D→A)以上四步构成一可逆循环,系统经一循环回复原态,∆U = 0,卡诺循环所作的总功应等于系统的总热,即-W = Q 1 + Q 2 。
系统作的总功312124ln ln V V W RT RT V V =+4.3.2 热机效率(efficiency of heat engine )用η表示。
1221T W Q T η-==-或121Q Q η=+ (Q 1<0) 结论:(1)可逆热机的效率与两热源的温度有关,两热源的温差越大,热机的效率越大;(2热机必须工作于不同温度两热源之间,把热量从高温热源传到低温热源而作功;(3)当T 1 → 0,可使热机效率η →100%,但这是不能实现的,因热力学第三定律指出绝对零度不可能达到,因此热机效率总是小于1。
4.4 第四节 卡诺定理 [TOP]在同一高温热源和同一低温热源之间工作的任意热机,卡诺机的效率最大,否则将违反热力学第二定律。
卡诺热机的效率只与两热源的温度有关,而与工作物质无关,否则也将违反热力学第二定律。
4.5 第五节 熵 [TOP]4.5.1 熵的导出1854年克劳修斯称该状态函数为熵(entropy),用符号S 表示,则rB A B A Q S S S T δ∆=-=⎰对微小变化, rQ dS T δ=。
意义是:系统由状态A 到状态B ,∆S 有唯一的值,等于从A 到B 可逆过程的热温商之和。
4.5.2 热力学第二定律数学表达式——克劳修斯不等式d S -δQT ≥ 04.5.3 熵增原理对于绝热可逆过程,系统的熵值不变,∆S = 0;对绝热不可逆过程,系统的熵值增加,∆S >0,在绝热过程中系统的熵值永不减少,这就是熵增加原理(principle of entropy increasing )。
孤立系统中自发过程的方向总是朝着熵值增大的方向进行,直到在该条件下系统熵值达到最大为止,即孤立系统中过程的限度就是其熵值达到最大。
这是熵增原理在孤立系统的推广,孤立系统中熵值永不减少。
通常将与系统密切相关的环境包括在一起,构成一个孤立系统,利用∆S 孤立= ∆S 系统+∆S 环境 ≥ 0判断系统自发过程的方向和限度。
4.6 第六节 熵变的计算 [TOP]4.6.1(1) 系统熵变的计算:熵是系统的状态函数,当系统由状态A 变化至状态B ,不论过程是否可逆,其熵变可用下式求出:r B A Q S T δ∆=⎰s ys t em 。
(2) 环境的熵变为∆S 环境=-QT 实际环4.6.2 等温过程中熵变的计算(1) 理想气体:2112max r ln ln d 21p p nR V V nR T Vp T W T Q S V V ===-==∆⎰; (2) 相变化过程:T H T Q T Q S p ∆===∆r(3) 理想气体混合过程: ∆S mix =-n A R ln x A - n K R ln x K = -R nx B B B ln ∑4.6.3 变温过程中熵变的计算(1) 等容变化:∆S = TT C T T V d 21⎰ (2) 等压变化:∆S = T TC T T p d 21⎰(3) 1摩尔理想气体,从状态A (p 1V 1T 1)改变到状态B (p 2V 2T 2) 的熵变:2121d ln T V T V T S nR C V T ∆=+⎰ 或 2112ln d T p T C p S nR T p T ∆=+⎰4.7 第七节 熵函数的物理意义 [TOP]熵是系统混乱程度的度量熵与概率: S = k ln Ω4.8 第八节 热力学第三定律及规定熵 [TOP]4.8.1 热力学第三定律在绝对零度,任何纯物质完整晶体的熵等于零,即lim T S →=00,所谓完整晶体即晶体中的原子、分子只有一种排列方式.4.8.2 规定熵依热力学第三定律而求得的任何物质在T K 下的熵值S B (T ),称为该物质在此状态下的规定熵(conventional entropy)。
⎰⎰⎰===T p T p T T T C T T C S S 000ln d d d标准摩尔熵:1摩尔物质处于温度T 时在标准状态下(p O =100kPa )的规定熵又称该物质在温度T 时的标准摩尔熵(standard molar entropy ),用O,m BS 表示: O O O OO 310,(),(),()O010f b f b T T T p m s f mp m l p m g v m m T T f b C H C C H T S dT dT dT dT T T T T T T α∆∆=+++++⎰⎰⎰⎰ 4.8.3 化学反应过程的熵变∆r Om S = ∑O B ,Bm S ν 4.9 第九节 吉布斯能、亥姆霍兹能 [TOP]4.9.1 热力学第一定律、第二定律联合表达式:T 环d S - d U ≥- δW4.9.2 亥姆霍兹能:F ≡ U - TS ,在等温条件下,- (d F)T ≥ -δW ,式中,可逆过程用等号,不可逆过程用大于号。
其意义是,封闭系统在等温条件下系统亥姆霍兹能减少,等于可逆过程系统所作的最大功。
若δW = 0,0,,='W V T dF ≤ 0,表示封闭系统在等温,等容和非体积功为零的条件下,只有使系统亥姆霍兹能减小的过程才会自动发生,且一直进行到该条件下所允许的最小值,此时系统达到平衡状态。
这一规则,称为最小亥姆霍兹能原理(principle of minimization of Helmholtz energy)。
4.9.3 吉布斯能:G ≡ H - TS在等温等压条件下- (dG)T, P ≥-δW ´,表明,封闭系统在等温等压条件下,系统吉布斯能的减小,等于可逆过程所作非体积功( 'W max),若发生不可逆过程,系统吉布斯能的减少大于系统所作的非体积功。
由于实际的化学变化和相变化,非体积功常为零,则在等温等压非体积功为零的条件下,式(2-37)可写成(),,dG T P W '=0 ≤ 0,表示封闭系统在等温等压和非体积功为零的条件下,只有使系统吉布斯能减小的过程才会自动发生,且一直进行到在该条件下吉布斯能最小为止,此时系统达到平衡状态。
这一规则称为最小吉布斯能原理(principle of minimization of Gibbs energy)。
4.9.4 自发变化方向和限度的判据判据名称适用系统 过程性质 自发过程的方向 数学表达式熵 孤立系统 任何过程 熵增加 dS U,V ≥ 0亥姆霍兹能封闭系统 等温等容和非体积功为零 亥姆霍兹能减小 dF T,V,W ’=0≤ 0 吉布斯能封闭系统 等温等压和非体积功为零 吉布斯能减小 dG T,p,W ’=0 ≤ 04.10 第十节 ∆G 的计算 [TOP]4.10.1 理想气体等温变化中的∆G21ln p G nRT p ∆=多种理想气体的等温等压混合过程:∆mix H = 0,∆mix S = -R nx B B B ln ∑,∆G = RT ∑ n B ln x B4.10.2 相变过程的∆G(1) 等温等压条件下的可逆相变过程:∆G = 0(2) 等温等压条件下的不可逆相变过程:必须设计一可逆过程来计算。
4.10.3 化学变化的∆r G O :对于化学反应的∆r G O ,可用热力学数据分别求出该化学反应的∆r H O 及∆r S O ,然后依据∆r G O = ∆r H O -T ∆r S O 公式,求算而得。
4.11 第十一节 热力学函数间的关系 [TOP] 4.11.1 热力学基本关系式d U = T d S - p d V d H = T d S + V d p d F = -S d T -p d V d G = -S d T + V d p这四个式子称为热力学基本公式,其适用的条件为:定组成只作体积功的封闭系统。
4.11.2 麦克斯韦关系式S S ()() ()() ()() ()()S V S p T V T pT p T V p VV S p S V T p T ∂∂∂∂∂∂∂∂∂∂∂∂∂∂∂∂=-===- 麦克斯韦关系式的意义在于它将不能或不易直接测量的物理量换成易于测量的物理量。