高中化学——常见水解反应总结
- 格式:docx
- 大小:35.90 KB
- 文档页数:1

高中阶段能水解的有机物一、引言有机物是由碳和氢构成的化合物,广泛存在于自然界中。
在高中化学学习中,我们了解到有机物可以被水解,即通过水的作用分解成更简单的有机物或无机物。
本文将介绍高中阶段能水解的一些常见有机物及其水解反应。
二、脂肪类1. 甘油三酯甘油三酯是一种常见的脂肪类有机物,它由一个甘油分子与三个脂肪酸分子结合而成。
当甘油三酯与水反应时,水分子与甘油三酯中的酯键发生水解反应,生成甘油和三个脂肪酸分子。
2. 磷脂类磷脂类是一类含磷的脂类有机物,常见的有磷脂酰胆碱、磷脂酰乙醇胺等。
磷脂类与水反应时,磷脂酯键发生水解反应,生成磷酸、醇或胆碱等物质。
三、糖类1. 单糖葡萄糖、果糖等单糖是高中化学中常见的有机物。
它们可以通过水的作用分解成更小的分子。
例如,葡萄糖与水反应时,葡萄糖分子中的糖苷键发生水解反应,生成葡萄糖醛酮和葡萄糖。
2. 多糖淀粉、纤维素等多糖也可以被水分解。
当淀粉与水反应时,淀粉分子中的糖苷键发生水解反应,生成葡萄糖单体。
四、蛋白质蛋白质是生物体中重要的有机物之一,由氨基酸分子通过肽键连接而成。
蛋白质可以被水分解为氨基酸。
水解反应发生在肽键上,使蛋白质分子断裂,生成氨基酸。
五、酶酶是生物体内催化反应的生物催化剂,也是一种特殊的蛋白质。
酶可以催化有机物的水解反应,使其分解成更小的有机物或无机物。
例如,淀粉酶可以催化淀粉的水解反应,将淀粉分解成葡萄糖单体。
六、植物中的有机物水解植物体内存在着大量的有机物,这些有机物在植物的生长和代谢过程中起着重要的作用。
在植物的生长过程中,一些有机物可以被水解,以提供植物所需的养分。
例如,植物体内的葡萄糖可以通过水解反应分解成葡萄糖醛酮和葡萄糖,以供植物进行能量代谢。
七、总结高中阶段能水解的有机物包括脂肪类、糖类、蛋白质等。
它们在与水反应时,发生水解反应,分解成更简单的有机物或无机物。
了解这些有机物的水解反应对我们理解生物体代谢过程和化学反应机理具有重要意义。

高考化学水解知识点大全高考化学水解知识点1.概述:水解是高中化学较常见、也是较重要的一类化学反应,说到底就是和水发生的复分解或取代反应。
均为吸热反应,升高温度,水解程度增大。
溶液越稀,水解程度越大。
2.实质:被水解是物质,在水分子作用下断键后,其阳性基团结合水分子中的阴性基团OH,阴性基团结合水分子中的阳性基团H,可表示为:3.分类:⑴卤代烃(卤素原子)的水解:氢氧化钠水溶液(NaOH作催化剂)生成醇。
⑵酯的水解:酯化反应的逆反应,生成醇和酸;酸做催化剂可逆,碱作催化剂不可逆,(油脂碱性条件下的水解为皂化反应)。
⑶蛋白质的水解:生成氨基酸,酸或碱均可作催化剂,且均不可逆。
⑷多糖的水解:蔗糖水解得一分子葡萄糖一分子果糖,麦芽糖水解得两分子葡萄糖,淀粉、纤维素水解的最终产物都是葡萄糖。
纤维素水解用浓硫酸作催化剂,其他三个水解用稀硫酸作催化剂。
⑸一些特殊金属化合物水解:①碳化物:CaC2+2H2O=Ca(OH)2+C2H2↑,Al4C3+12H2O=4Al(OH)3+3CH4↑,②氮化物:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,③硫化物:Al2S3+6H2O= 2Al(OH)3+3H2S↑,④非金属卤化物:PCl5+4H2O=5HCl+H3PO4,ICl+H2O=HCl+HIO,⑤氢化物:NaH+H2O=NaOH+H2↑⑹盐类的水解:中和反应的逆反应,生成酸和碱。
除少数强烈双水解外,通常都十分微弱。
处理该部分问题需要牢记:有弱才水解,无弱不水解;谁弱谁水解,越弱越水解;谁强呈谁性,同强呈中性。
4.延伸⑴醇解,⑵氨解,⑶酯交换等盐类的水解第一片:概述1.概念:在水溶液中,盐电离出来的离子结合水电离的H+或OH_生成弱电解质的过程。
2.条件:⑴盐应是可溶性的,⑵能电离出弱酸根离子或弱碱的阳离子3.实质:生成弱电解质,破坏了水的电离平衡,促进了水的电离。
4.规律:有弱才水解,无弱不水解;谁弱谁水解,都弱都水解;越弱越水解,越稀越水解,越热越水解。

水解反应水解反应是化学中一种常见的反应类型,指的是分子或离子与水发生化学反应,产生新的物质。
水解反应在生活中和工业中都具有重要的意义,不仅能够产生有用的产物,还能够帮助我们理解化学反应的原理。
水解反应的概述水解反应是指物质与水作用,使其分解成更简单的物质。
水解反应可以发生在离子、分子、化合物等不同的化学物质上。
通常情况下,水解反应是通过在分子或离子中添加水分子来实现的。
这些水解反应可以是酸碱中和反应、酯水解反应、碳酸酯水解反应等。
水解反应可以分为完全水解和不完全水解两种情况。
完全水解指的是反应物与水反应产生的产物完全溶解在水中形成离子。
而不完全水解则是指只有一部分反应物与水反应产生离子,另一部分仍然以分子形式存在。
水解反应的类型酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的过程。
在这种反应中,酸质子和碱的氢氧根离子结合形成水,同时产生一个化学反应的产物 - 盐。
例如,硫酸与氢氧化钠反应的水解反应可以表示为:H2SO4 + 2NaOH → Na2SO4 + 2H2O酯水解反应酯水解反应是指酯与水反应,将酯分解成醇和羧酸的过程。
这种反应是通过水进攻酯的羰基碳而发生的。
例如,酯乙酸乙酯与水反应的水解反应可以表示为:CH3COOC2H5 + H2O → CH3COOH + C2H5OH碳酸酯水解反应碳酸酯水解反应是碳酸酯与水反应,产生相应的醇和碳酸盐。
碳酸酯在水中分解成酸和醇的过程。
例如,二甲基碳酸酯与水发生的水解反应可以表示为:CH3OCO2CH3 + H2O → CH3CO2H + CH3OH水解反应的意义水解反应在生活中和工业上具有重要的应用价值。
在生活中,水解反应发生在我们日常饮食中的食物消化过程中。
例如,淀粉在体内经过水解反应形成葡萄糖,为我们提供能量。
在工业上,水解反应广泛应用于合成和分解化学物质。
例如,酯水解反应可以用于生产肥皂和香精。
水解反应还可以用于环境保护领域,例如处理废水中的有机物。

水解是一种化学反应,涉及到某些官能团在水的存在下发生分解。
以下是高中化学中常见能发生水解的一些官能团:
1. 酯水解:酯在水中可以水解成相应的醇和酸。
- 例如:RCOOR' + H2O→RCOOH + R'OH
2. 醚水解:醚分子在水中可以发生醚水解反应。
- 例如:ROR' + H2O→ROH + R'OH
3. 酰胺水解:酰胺在水中可以水解成相应的酸和胺。
- 例如:RCONH2 + H2O→RCOOH + NH3
4. 酰氯水解:酰氯在水中可以水解成相应的酸和盐酸。
- 例如:RCOCl + H2O→RCOOH + HCl
5. 亚胺水解:亚胺在水中可以水解成相应的醛和胺。
- 例如:R2NCHOH + H2O→RCHO + R2NH2
这些反应是有机化学中常见的水解反应,其中含有酯、醚、酰胺、酰氯和亚胺等官能团的有机物在水中分解成不同的产物。
在高中化学学科中,这些反应通常属于有机化学的范畴。

高中生物水解和彻底水解总结一、水解的概念水解是指通过加入水分子,将化合物分解成更简单的物质的化学反应过程。
在生物学中,水解是一种常见的分解反应,能够将复杂的有机物分解为简单的有机物、离子或原子。
二、水解的种类1. 酸性水解:酸性水解是指在酸性条件下进行的水解反应。
酸性条件下,酸能够提供H+离子,使水解反应发生。
例如,蛋白质在胃酸的作用下发生酸性水解,被分解成氨基酸。
2. 碱性水解:碱性水解是指在碱性条件下进行的水解反应。
碱性条件下,碱能够提供OH-离子,使水解反应发生。
例如,油脂在碱性溶液中发生碱性水解,生成甘油和脂肪酸。
3. 酶促水解:酶促水解是指在酶的催化下进行的水解反应。
酶是生物体内催化反应的生物催化剂,能够降低反应的活化能,加速水解反应的进行。
例如,淀粉在口腔和胰液中的淀粉酶的作用下发生酶促水解,生成葡萄糖。
三、水解的意义水解在生物学中具有重要的意义:1. 营养吸收:通过水解,生物体能够将复杂的有机物分解成可溶性的小分子物质,便于吸收和利用。
例如,食物中的蛋白质在胃酸和胃蛋白酶的作用下发生水解,生成氨基酸,被小肠吸收利用。
2. 废物排出:水解也参与了废物的分解和排出。
例如,肝脏通过水解将无法利用的氨基酸转化成尿素,经过肾脏排出体外。
3. 能量供应:一些有机物的水解反应能够释放出能量,在细胞代谢中起到能量供应的作用。
例如,葡萄糖的水解反应能够释放出能量,提供给细胞进行生命活动。
水解是一种常见的生物化学反应,通过加入水分子将复杂的有机物分解成更简单的物质。
根据不同的条件和催化剂,水解可以分为酸性水解、碱性水解和酶促水解。
水解在生物学中具有重要的意义,包括营养吸收、废物排出和能量供应等方面。
了解水解的原理和意义对于我们理解生物体的代谢过程具有重要的意义。
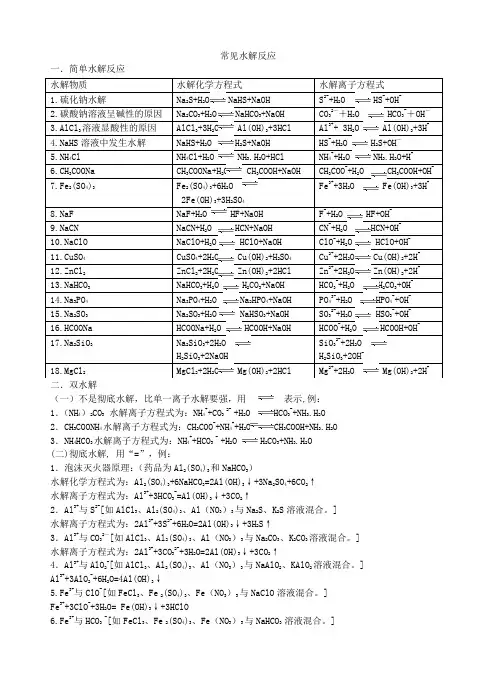
常见水解反应一.简单水解反应 二.双水解(一)不是彻底水解,比单一离子水解要强,用 表示,例:1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2- +H 2O HCO 3-+NH 3.H 2O 2.CH 3COONH 4水解离子方程式为:CH 3COO -+NH 4++H 2O CH 3COOH+NH 3.H 2O3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+NH 3.H 2O(二)彻底水解, 用“=”,例: 1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3)水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al(OH)3↓+3Na 2SO 4+6CO 2↑水解离子方程式为:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。
]水解离子方程式为:2Al 3++3S 2-+6H 2O=2Al(OH)3↓+3H 2S ↑3.Al 3+与CO 32-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2CO 3、K 2CO 3溶液混合。
]水解离子方程式为:2Al 3++3CO 32-+3H 2O=2Al(OH)3↓+3CO 2↑4.Al 3+与AlO 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与NaAlO 2、KAlO 2溶液混合。
] Al 3++3AlO 2-+6H 2O=4Al(OH)3↓ 5.Fe 3+与ClO -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaClO 溶液混合。
] Fe 3++3ClO -+3H 2O= Fe(OH)3↓+3HClO 6.Fe 3+与HCO 3 -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaHCO 3 溶液混合。

高三化学电离与水解知识点电离与水解是高中化学中重要的知识点,涉及到溶液的离子化程度、酸碱中和反应等概念。
本文将围绕电离与水解的定义、化学平衡中的应用以及相关实例进行详细阐述。
一、电离与水解的定义电离是指化学物质在溶液中或熔融状态下,通过释放离子而转变为离子的过程。
以强酸HCl为例,当它溶解在水中时,会释放出H+离子和Cl-离子:HCl(气体)→ H+(溶液)+ Cl-(溶液)水解是指化学物质在水溶液中与水发生反应,产生离子和水的过程。
以强碱NaOH为例,当它溶解在水中时,会发生水解反应:NaOH(固体)+ H2O(液体)→ Na+(溶液)+ OH-(溶液)二、化学平衡中的电离与水解在酸碱中和反应中,离子的电离与水解是化学平衡过程中重要的组成部分。
根据勒夏特列原理,对于弱电解质溶液,它的电离与水解可以相互制约,形成动态平衡。
以弱酸HAc(醋酸)的电离与水解为例,该过程可以表达为如下平衡反应:HAc(溶液)⇄ H+(溶液)+ Ac-(溶液)在水中,HAc分子发生电离,部分转化为离子H+和Ac-,同时也会出现Ac-与水分子的水解反应:Ac-(溶液)+ H2O(溶液)⇄ HAc(溶液)+ OH-(溶液)这两个反应相互制约,不断进行,直到达到化学平衡。
三、电离与水解的相关实例1. 酸碱指示剂的应用酸碱指示剂是根据溶液的酸碱性质发生颜色变化的物质。
这种颜色变化与指示剂分子的电离与水解有关。
如甲基橙指示剂,在酸性溶液中会接受H+离子而发生电离,呈现红色;在碱性溶液中,指示剂分子与OH-离子发生水解,呈现黄色。
通过观察指示剂的颜色变化,可以判断溶液的酸碱性质。
2. 酸碱中和反应酸碱中和反应是指酸溶液与碱溶液按化学计量比发生完全反应的过程。
在这个过程中,酸与碱溶液中的离子发生重新组合,形成中和盐和水。
例如,盐酸和氢氧化钠反应生成氯化钠和水的化学方程式为:HCl(溶液)+ NaOH(溶液)→ NaCl(溶液)+ H2O(溶液)该反应中,HCl中的H+离子与NaOH中的OH-离子结合,生成中和盐NaCl和水。
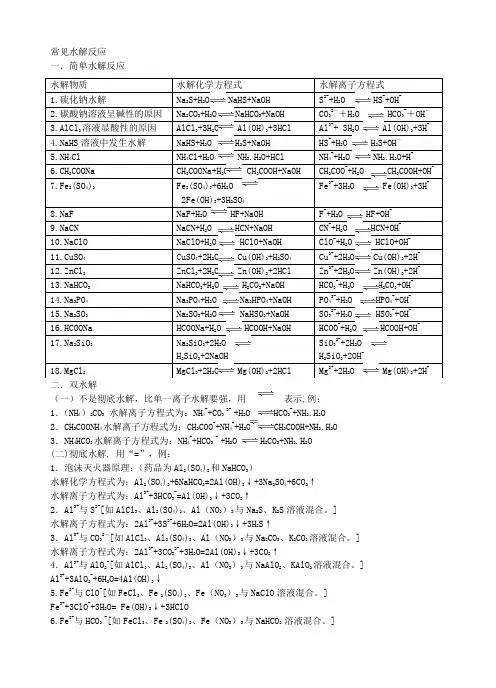
常见水解反应一.简单水解反应二.双水解(一)不是彻底水解,比单一离子水解要强,用 表示,例:1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2- +H 2O HCO 3-+NH 3.H 2O 2.CH 3COONH 4水解离子方程式为:CH 3COO -+NH 4++H 2O CH 3COOH+NH 3.H 2O3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+NH 3.H 2O(二)彻底水解, 用“=”,例: 1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3)水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al(OH)3↓+3Na 2SO 4+6CO 2↑水解离子方程式为:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。
]水解离子方程式为:2Al 3++3S 2-+6H 2O=2Al(OH)3↓+3H 2S ↑3.Al 3+与CO 32-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2CO 3、K 2CO 3溶液混合。
]水解离子方程式为:2Al 3++3CO 32-+3H 2O=2Al(OH)3↓+3CO 2↑4.Al 3+与AlO 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与NaAlO 2、KAlO 2溶液混合。
] Al 3++3AlO 2-+6H 2O=4Al(OH)3↓ 5.Fe 3+与ClO -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaClO 溶液混合。
] Fe 3++3ClO -+3H 2O= Fe(OH)3↓+3HClO 6.Fe 3+与HCO 3 -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaHCO 3 溶液混合。

化学水解知识点总结
水解反应的机理一般分为酸催化和碱催化两种方式。
在酸催化下,水解反应的过程中水分子首先失去一个质子变成了一个羟基离子。
这个羟基
离子会攻击化合物的一个原子核,从而打开其分子结构并将之分为两部分。
举个例子,如
果我们以酯类化合物和水进行水解反应,就可以得到相应的醇和羧酸。
若考虑碱催化的水解反应,一方面硫酸铵等金属离子所引起的酸碱中立化过程,另一方面
羟氢根离子的活性作用,使得单子化物分子发生活化。
在这种情况下,水分子的一个质子
和羟基离子中的一个质子结合成水,使得其活性增加,从而导致水解反应。
水解反应可以发生在各种不同的化合物之间,尤其是在有机化合物领域有着广泛的应用。
例如,在生物体内,消化酶通过水解的方式将蛋白质、碳水化合物和脂肪等分解为小分子
物质,以供生物体发挥功能。
此外,在工业上,水解反应也常常用于制备各种化合物,例
如在制糖、纺织品、医药等领域都有着广泛的应用。
在化学反应工程领域,水解反应的研究也起着非常重要的作用。
如何控制水解反应的速率,同时保持反应系统的稳定性,是一个非常重要的问题,涉及到反应条件的优化、催化剂的
选择和反应温度的控制等方面。
此外,水解反应也常常用于环境保护领域,例如通过水解反应将一些有毒化合物转化为无
毒的产物,或者将一些难降解的有机物转化为易降解的产品,以减少对环境的污染和破坏。
总的来说,水解反应在化学领域中具有非常广泛的应用,既体现了基础化学的研究价值,
也具有非常重要的应用价值。
水解反应的研究不仅可以帮助我们理解化合物的结构和性质,还可以为生产制备更加绿色化合物提供理论基础和技术支持。

典型类型:高中有机化学发生水解反应1、卤化物的水解;通常用氢氧化钠水溶液作水解剂,反应通式如下:R—X+H2O-─→R—OH+HXAr—X+2H2O─→Ar—OH+HX+H2O 式中R、Ar、X分别表示烷基、芳基、卤素。
2、脂链上的卤素一般比较活泼,可在较温和的条件下水解,如从氯苄制苯甲醇;芳环上的卤素被邻位或对位硝基活化时,水解较易进行,如从对硝基氯苯制对硝基酚钠。
3、酯的水解;油脂在酸或碱催化条件下可以水解.①酸性条件下的水解;在酸性条件下水解为甘油(丙三醇)高级脂酸.C17H35COO-CH2CH2-OHC17H35COO-CH+3H2O====CH-OH+3C 17H35COOHC17H35COO-CH2CH2-OH②碱性条件下的水解;在碱性条件下水解为甘油高级脂肪酸盐.C17H35COO-CH2CH2OHC17H35COO-CH+3NaOH====CH2OH+3C 17H35COONaC17H35COO-CH2CH2OH两种水解都会产生甘油.4、油脂在碱性条件下的水解反应称为皂化反应.工业上就是利用油脂的皂化反应制取肥皂.低碳烯烃与浓硫酸作用所得烷基硫酸酯,经加酸水解可得低碳醇。
5、淀粉/纤维素水解(C6H10O5)n(淀粉/纤维素)+nH2O→nC6H12O6(葡萄糖)GAGGAGAGGAFFFFAFAF6、蔗糖水解C12H22O11(蔗糖)+H2O→C6H12O6(果糖)+C6H12O6(葡萄糖)7、麦芽糖水解C12H22O11(麦芽糖)+H2O→2C6H12O6(葡萄糖)8、芳磺酸盐的水解通常不易进行,须先经碱熔,即以熔融的氢氧化钠在高温下与芳磺酸钠作用生成酚钠,后者可通过加酸水解生成酚。
如萘-2-磺酸钠在300~340℃常压碱熔后水解而得2-萘酚。
某些芳磺酸盐还需用氢氧化钠和氢氧化钾的混合碱作为碱熔的反应剂。
芳磺酸盐较活泼时可用氢氧化钠水溶液在较低温度下进行碱熔。
9、胺的水解脂胺和芳胺一般不易水解。
高中化学常见水解反应方程式汇总水与另一化合物反应,该化合物分解为两部分,水中氢原子加到其中的一部分,而羟基加到另一部分,因而得到两种或两种以上新的化合物的反应过程。
那么高中化学水解反应的化学方程式又有哪些呢?下面是高中化学常见水解反应方程式汇总,供参考。
高中化学常见水解反应方程式汇总点击查看:高中化学方程式汇总高中化学水解反应方程式如下Al2S3+6H2O==Al(OH)3↓+H2S↑(隔绝空气,密封保存)Mg3N2+6H2O==Mg(OH)2↓+NH3↑(隔绝空气,密封保存)Na3P+3H2O==3NaOH+PH3↑(隔绝空气,密封保存)Zn3P2+6H2O==Zn(OH)2↓+PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==Ca(OH)3↓+C2H2↑(隔绝空气,密封保存)NaHCO3+H2O H2CO3+NaOH(NaHSO4不水解,NaHSO3电离大于水解) Na2HPO4+H2O NaH2PO4+NaOH HPO42-+H2O H2PO4-+OH–NaH2PO4+H2O H3PO4+NaOH H2PO4-+H2O H3PO4+OH–CH3COONa+H2O CH3COOH+NaOH CH3COO-+H2O CH3COOH+OH–C6H5ONa+H2O C6H5OH+NaOH C6H5O-+H2O C6H5OH+OH–C17H35COO-CH+3H2O====CH-OH+3C17H35COOHC17H35COO-CH+3NaOH====CH2OH+3C17H35COONaCH3COOC2H5+NaoH=CH3COONa+c2H5oH(条件加热水)可逆CaC2+2H2O→Ca(OH)2+C2H2↑C2H4+H20→CH3CH2OH(条件为催化剂)C2H2+H2O→C2H4O(条件为催化剂,加热加压)CH2=CH2+H20→CH3CH2OH(条件为催化剂)c2H5Br+NaoH→C2H5OH+NABr(条件是加热水)以上是小编整理的高中化学常见水解反应方程式汇总,更多更详细的高中化学方程式请关注。
高中化学方程式之水解反应的公式总结1、单水解---可逆水解NH4Cl+H2O NH3H2O+HCl NH4++H2O H++NH3H2OFeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+AlCl3+3H2O Al(OH)3+3HCl Al3++3H2O Al(OH)3+3H+CuSO4+2H2O Cu(OH)2+H2SO4 (金属活动顺序表中Mg2+以后的阳离子均水解)NaHCO3+H2O H2CO3+NaOH (NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O NaHCO3+NaOH CO32-+H2O HCO3-+OH–NaHCO3+H2O H2CO3+NaOH(第一步远远大于第二步,二步不能叠加)Na2SO3+H2O NaHSO3+NaOH SO32-+H2O HSO3-+OH–NaHSO3+H2O H2SO3+NaOH(第一步远远大于第二步,二步不能叠加)HSO3-+H2O H2SO3+OH-Na2S+H2O NaHS+NaOH S2-+H2O HS-+OH–NaHS+H2O H2S+NaOH(第一步远远大于第二步,二步不能叠加) HS-+H2O H2S+OH-Na3PO4+H2O Na2HPO4+NaOH PO43-+H2O HPO42-+OH–Na2HPO4+H2O NaH2PO4+NaOH HPO42-+H2O H2PO4-+OH–NaH2PO4+H2O H3PO4+NaOH H2PO4-+H2O H3PO4+OH–CH3COONa+H2O CH3COOH+NaOH CH3COO-+H2O CH3COOH+OH– C6H5ONa+H2O C6H5OH+NaOH C6H5O-+H2O C6H5OH+OH–2、双水解CH3COONH4+H2O CH3COOH+NH3H2ONH4F+H2O HF+NH3H2OAl2S3+6H2O==Al(OH)3↓+H2S↑ (隔绝空气,密封保存)Mg3N2+6H2O==Mg(OH)2↓+NH3↑(隔绝空气,密封保存)Na3P+3H2O==3NaOH+PH3↑(隔绝空气,密封保存)Zn3P2+6H2O==Zn(OH)2↓+PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==Ca(OH)3↓+C2H2↑(隔绝空气,密封保存)C2H5ONa+H2O==C2H5OH+NaOH。
高中化学——常见水解反应总结常见水解反应一.简单水解反应水解物质 水解化学方程式 水解离子方程式1.硫化钠水解Na 2S+H 2O NaHS+NaOH S 2-+H 2O HS -+OH - 2.碳酸钠溶液呈碱性的原因Na 2CO 3+H 2O NaHCO 3+NaOH CO 32-+H 2O HCO 3-+OH -3.AlCl 3溶液显酸性的原因AlCl 3+3H 2O Al(OH)3+3HCl Al 3++ 3H 2OAl(OH)3+3H +4.NaHS 溶液中发生水解 NaHS+H 2O H 2S+NaOH HS -+H 2O H 2S+OH -5.NH 4Cl NH 4Cl+H 2O NH 3.H 2O+HCl NH 4++H 2O NH 3.H 2O+H +6.CH 3COONa CH 3COONa+H 2O CH 3COOH+NaOH CH 3COO -+H 2O CH 3COOH+OH -7.Fe 2(SO 4)3Fe 2(SO 4)3+6H 2O Fe 3++3H 2O二.双水解(一)不是彻底水解,比单一离子水解要强,用 表示,例: 1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2- +H 2O HCO 3-+NH 3.H 2O 2.CH 3COONH 4水解离子方程式为:CH 3COO -+NH 4++H 2O CH 3COOH+NH 3.H 2O 3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+NH 3.H 2O (二)彻底水解, 用“=”,例:1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3)水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al(OH)3↓+3Na 2SO 4+6CO 2↑ 水解离子方程式为:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。
高中化学水解反应的官能团
水解反应是指将一种物质分解成两个或更多物质的化学反应。
在有机化学中,水解反应往往涉及到官能团的裂解。
官能团是有机分子中具有特定性质和化学反应的基团。
下面是高中化学中常见的水解反应的官能团。
1. 酯的水解反应:酯是一类含有羧酸基和醇基官能团的有机化合物,其水解反应通常在碱性条件下进行,产生相应的醇和羧酸。
例如,乙酸乙酯在碱性条件下水解成乙酸和乙醇:
CH3COOC2H5 + NaOH → CH3COOH + C2H5OH
2. 酰胺的水解反应:酰胺是一类含有酰基和氨基官能团的有机化合物,其水解反应通常在酸性条件下进行,产生相应的羧酸和氨。
例如,醋酰胺在酸性条件下水解成醋酸和氨:
CH3CONH2 + H2O → CH3COOH + NH3
3. 酰氯的水解反应:酰氯是一类含有酰基和氯基官能团的有机化合物,其水解反应通常在水或醇中进行,产生相应的羧酸和氯化氢。
例如,乙酰氯在水中水解成乙酸和氯化氢:
CH3COCl + H2O → CH3COOH + HCl
4. 酰亚胺的水解反应:酰亚胺是一类含有酰基和亚胺基官能团的有机化合物,其水解反应通常在酸性或碱性条件下进行,产生相应的羧酸和亚胺或醛或酮。
例如,丁酰亚胺在酸性条件下水解成丁酸和丁醛:
CH3CH2CH2CO-NH-CH3 + H2O → CH3CH2CH2COOH + CH3CHO
以上是高中化学中常见的水解反应的官能团。
在学习有机化学时,了解不同官能团的性质和反应是非常重要的。
高中化学水解知识点总结
高中化学水解知识点总结
一、水解概念
水解,又称水溶性分解或水分解,是指溶解在水溶剂中的一些化合物,经水攻击,分解成小分子物质的一种反应,简称水解。
二、水解反应分类
1、水解反应分为三类:
(1)电解:指在水溶液中加入对离子有作用力的电子极,使离子发生水解的反应。
(2)碱解:指在水溶液中加入强碱,使其发生水解的反应。
(3)酸解:指在水溶液中加入酸,使其发生水解的反应。
2、根据水解反应的分子结构,可以将水解反应分为物理水解和化学水解两类。
(1)物理水解:指由外力作用,使物质分子受到力的作用,而分子分裂解体的反应,即一种物理反应。
(2)化学水解:指水解反应的物质分子受到外力作用而分裂解体时发生的反应,即一种化学反应。
三、水解反应的特点
1、水解反应是一种物质分解的反应,是一种分子分解为小分子物质的反应。
2、水解反应的最终产物是小分子物质,通常是非电解质形式的物质。
3、水解反应的速率与水分子的活性有关,水解反应受到温度、pH、浓度、加入的盐类的影响。
4、水解反应可以分为物理水解和化学水解两类。
四、水解反应的应用
1、用于制备活性剂:水解反应可用于制备某些活性剂,如尿素、盐酸等。
2、用于医药制剂:水分解可用于制备药物,如尿素、铵、苯酐等。
3、用于食品工业:水解可以用于制备饮料、熟食类食物,还可以用于制备乳制品、调味品等。
4、用于化学反应:水解可以用于制备有机物质和无机物质,如硫酸铵等。
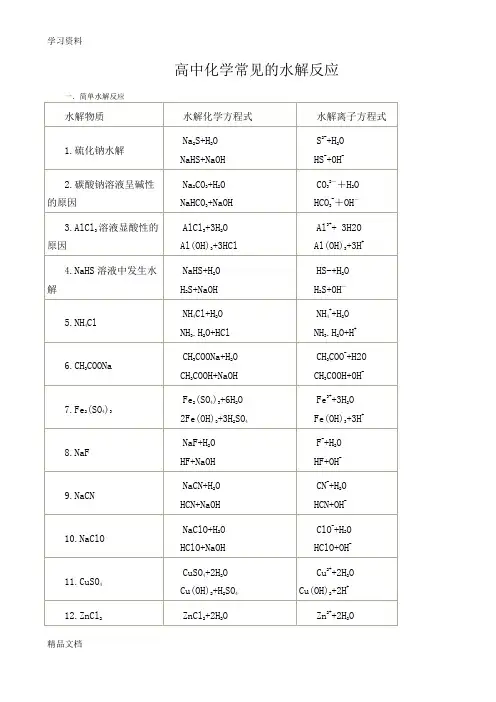
常见水解反应
一.简单水解反应
水解物质
水解化学方程式
水解离子方程式
1. 硫化钠水解
Na 2 S+H 2O NaHS+NaOH
2-
+H 2O
HS -
-
S +OH
2. 碳酸钠溶液呈碱性的原因
Na CO+HO
NaHCO
+NaOH
2- +H O HCO - -
3 CO
3 + OH
2
3
2
3
2
3.AlCl 3
溶液显酸性的原因
AlCl 3+3H 2O Al(OH) 3+3HCl
Al 3++ 3H 2O Al(OH)
3
+3H +
4.NaHS 溶液中发生水解 NaHS+H 2O H
2
S+NaOH
-
H
-
HS+H 2O
2
S+OH
5.NH 4Cl
NH 4Cl+H 2O NH
3
.H 2O+HCl
+
NH 3.H
+
NH 4 +H 2O 2O+H
3
3 2 CH 3
3
-
2
CH 3
- 6.CH COONa
CHCOONa+H
COOH+NaOH CHCOO+H O
COOH+OH
2
4 3 2
4 3
2
3+
2
Fe(OH)
3
+
7.Fe (SO )
Fe (SO ) +6H O
Fe +3H O
+3H
2Fe(OH) 3+3H 2SO
4
8.NaF
NaF+H 2O
HF+NaOH F - +H 2O HF+OH -
9.NaCN
2 HCN+NaOH
- 2
HCN+OH -
NaCN+HO
CN+H O
10.NaClO
2
HClO+NaOH
-
2
HClO+OH
-
NaClO+HO
ClO +HO
11.CuSO 4
CuSO 4+2H 2O Cu(OH) 2+H 2SO 4 Cu 2++2H 2O Cu(OH) 2+2H + 12.ZnCl 2
ZnCl 2+2H 2O Zn(OH) 2+2HCl
Zn 2++2H 2O Zn(OH) 2+2H + 13.NaHCO
NaHCO+H O H
2CO+NaOH
- H -
HCO+HO 2 CO+OH
3
3 2
3
3
2
3
14.Na PO
Na PO+HO
Na
HPO+NaOH
3-
+HO
HPO
-
-
2PO
4 +OH
3 4
3 4 2
4
4 2
15.Na SO
Na SO+HO
NaHSO +NaOH
2-
HSO
- -
SO +HO
3 +OH
2
3
2
3
2
3
3
2
16.HCOONa HCOONa+H 2 HCOOH+NaOH
-
-
HCOO+H 2O HCOOH+OH 17.Na 2SiO 3
Na 2 SiO 3+2H 2O
SiO 3 2- +2H 2O
H 2SiO 3+2NaOH
-
H 2SiO 3+2OH
18.MgCl 2
MgCl 2+2H 2O Mg(OH) 2+2HCl
2+
Mg(OH)
+
Mg +2H 2O 2
+2H
二.双水解
(一)不是彻底水解,比单一离子水解要强,用
表示 , 例:
1.( NH ) CO 水解离子方程式为:
+ 2- +H O HCO
- +NH.H O
NH +CO 3
4 2 3 4
3
2
3
2
2. CH 3COONH 4水解离子方程式为:
-
+
CH
3COOH+NH 3. 2O
CH 3COO+NH 4 +H 2O 3. NHHCO 水解离子方程式为:
+ - +HO H CO+NH.H O NH +HCO
4
3
4 3 2 2 3 3 2
( 二) 彻底水解 , 用“ =”,例:
1.泡沫灭火器原理: (药品为 Al 2(SO 4) 3 和 NaHCO 3)
水解化学方程式为: Al 2(SO 4) 3+6NaHCO 3=2Al(OH) 3↓ +3Na 2SO 4+6CO 2↑
水解离子方程式为: Al 3+
-
3
2
+3HCO=Al(OH)
↓
+3CO ↑
2. Al 3+与 S 2- [ 如 AlCl 3、 Al 2(SO 4) 3、Al ( NO 3) 3 与 Na 2S 、 K 2S 溶液混合。
] 水解离子方程式为: 2Al 3++3S 2- +6H 2O=2Al(OH)3↓ +3H 2S ↑
3+ 2- [ 如 AlCl 、 Al (SO ) 、 Al ( NO ) 与 NaCO 、 K CO 溶液混合。
] 3. Al 与 CO
3 3 3 2
4 3 3 2 3 2 3
水解离子方程式为:
3+
2-
2
3
2
2Al +3CO
+3H O=2Al(OH)
↓ +3CO ↑
4. Al 3+与 AlO 2 - [ 如 AlCl 3、 Al 2(SO 4) 3、 Al ( NO 3) 3与 NaAlO 2、KAlO 2 溶液混合。
] Al 3++3AlO 2 - +6H 2O=4Al(OH)3↓
3+
- [
3
2
4
3
3
3
与 NaClO 溶液混合。
]
5.Fe 与 ClO
如 FeCl
、 Fe
(SO )
、 Fe ( NO )
Fe 3++3ClO - +3H 2O= Fe(OH)3↓ +3HClO
6.Fe 3+与 HCO 3 - [ 如 FeCl 3、 Fe 2 (SO 4) 3、 Fe ( NO 3) 3 与 NaHCO 3溶液混合。
]
3+
-
3
2
Fe +3HCO =Fe(OH) ↓+3CO ↑。