氧化还原反应专题复习1苏教版
- 格式:pptx
- 大小:20.38 MB
- 文档页数:13
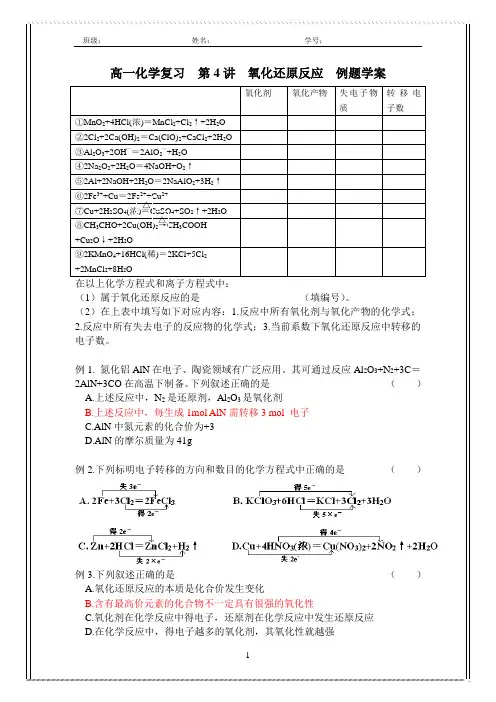
高一化学复习 第4讲 氧化还原反应 例题学案氧化剂 氧化产物 失电子物质 转移电子数 ①MnO 2+4HCl(浓)=MnCl 2+Cl 2↑+2H 2O ②2Cl 2+2Ca(OH)2=Ca(ClO)2+CaCl 2+2H 2O ③Al 2O 3+2OH —=2AlO 2—+H 2O ④2Na 2O 2+2H 2O =4NaOH+O 2↑ ⑤2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ ⑥2Fe 3++Cu =2Fe 2++Cu 2+⑦Cu+2H 2SO 4(浓)=CuSO 4+SO 2↑+2H 2O⑧CH 3CHO+2Cu(OH)2→CH 3COOH +Cu 2O ↓+2H 2O⑨2KMnO 4+16HCl(稀)=2KCl+5Cl 2 +2MnCl 2+8H 2O在以上化学方程式和离子方程式中:(1)属于氧化还原反应的是____________________(填编号)。
(2)在上表中填写如下对应内容:1.反应中所有氧化剂与氧化产物的化学式;2.反应中所有失去电子的反应物的化学式;3.当前系数下氧化还原反应中转移的电子数。
例1. 氮化铝AlN 在电子、陶瓷领域有广泛应用。
其可通过反应Al 2O 3+N 2+3C =2AlN+3CO 在高温下制备。
下列叙述正确的是 ( )A.上述反应中,N 2是还原剂,Al 2O 3是氧化剂B.上述反应中,每生成1mol AlN 需转移3 mol 电子C.AlN 中氮元素的化合价为+3D.AlN 的摩尔质量为41g例2.下列标明电子转移的方向和数目的化学方程式中正确的是 ( )例3.下列叙述正确的是 ( )A.氧化还原反应的本质是化合价发生变化B.含有最高价元素的化合物不一定具有很强的氧化性C.氧化剂在化学反应中得电子,还原剂在化学反应中发生还原反应D.在化学反应中,得电子越多的氧化剂,其氧化性就越强△ △例4.(1)已知下列反应:①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3;③I2+SO2+2H2O=H2SO4+2HI。

专题1 化学家眼中的物质世界一、物质的分类(可按组成、状态、性能等来分类)P3 二、物质的转化(反应)类型四种基本反应类型:化合反应,分解反应,置换反应,复分解反应 ☆三、氧化还原反应1.氧化还原反应:有电子转移的反应2. 氧化还原反应 实质:电子发生转移 判断依据:元素化合价发生变化 氧化还原反应中概念及其相互关系如下:失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性) 得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性) 氧化还原反应中电子转移的表示方法 双线桥法表示电子转移的方向和数目注意:a.“e -”表示电子。
b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。
c .失去电子的反应物是还原剂,得到电子的反应物是氧化剂d .被氧化得到的产物是氧化产物,被还原得到的产物是还原产物氧化性、还原性强弱的判断 ☆四、物质的量1、 物质的量是一个物理量,符号为 n ,单位为摩尔(mol)2、 1 mol 粒子的数目是0.012 kg 12C 中所含的碳原子数目,约为6.02×1023个。
3、 1 mol 粒子的数目又叫阿伏加德罗常数,符号为N A ,单位mol -1。
4、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
5.、数学表达式 : AN Nn 摩尔质量1、定义:1mol 任何物质的质量,称为该物质的摩尔质量。
符号:M 表示,常用单位为g/mol2、数学表达式:n = m/M3、数值:当物质的质量以g 为单位时,其在数值上等于该物质的相对原子质量或相对分子质量. 五、物质的聚集状态1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积单位物质的量的气体所占的体积。






高三化学第一轮复习:氧化还原反应苏教版【本讲教育信息】一. 教学内容:氧化还原反应二. 教学目标理解氧化和还原,氧化性和还原性,氧化剂和还原剂,氧化产物和还原产物等概念;能判断氧化还原反应中电子转移的方向和数目;能配平反应方程式。
三. 教学重点、难点氧化还原反应方程式的分析、配平和氧化性、还原性强弱的比较氧化还原反应的应用四. 教学过程:1. 氧化还原反应的有关概念及其关系2. 氧化还原反应实质的表示方法(1)双线桥法(常用于分析氧化还原反应)注意箭头的指向不代表电子转移的方向!(2)单线桥法(常用于表示电子转移的实际情况)注意箭头的指向!3. 氧化还原反应的一般规律⑴守恒律:对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
⑵价态律:元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。
即:“高价氧化低价还,中间价态两头转”⑶强弱律:强制弱:强氧化剂+强还原剂=弱还原剂+弱氧化剂。
主要应用:①比较物质间氧化性或还原性的强弱;②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。
⑷转化律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间的氧化反应,化合价的变化遵循“只靠拢,不交叉”(即价态归中);同种元素相邻价态间不发生氧化还原反应。
歧化律-—处于中间价态的元素同时升降归中律-—同种元素不同价态反应时,化合价向中间靠拢,且一般符合邻位转化和互不换位规律,同种元素相邻价态不发生氧化还原反应⑸优先律:一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。
一种还原剂与多种氧化剂时,氧化性最强的优先发生反应。
即“先强后弱”原则。
⑹难易律:越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失电子。
4. 氧化性、还原性强弱的比较:氧化性、还原性的强弱取决于得、失电子的能力,与得失电子的多少无关。


