海水中的化学复习共23页
- 格式:ppt
- 大小:1.92 MB
- 文档页数:23


九年级化学全册第三单元海水中的化学知识点复习鲁教版九年级化学全册第三单元海水中的化学知识点复习鲁教版一、单元概述本单元复习主题是“海水中的化学”,主要涉及海水资源的开发和利用。
海水是人类重要的自然资源之一,其中蕴含着丰富的化学元素和矿物质,如氯、钠、镁、钾、硫等。
了解海水中的化学知识点对于我们掌握海洋化学资源的开发和利用具有重要意义。
二、知识点回顾1、海水组成及特点海水主要由水分子、溶解物质和悬浮颗粒组成。
海水的特点包括高盐度、高氯含量以及温度、盐度、pH值等方面的变化。
2、海水中的化学物质海水中含有大量盐类,如氯化钠、氯化钾、氯化镁等。
此外,海水中还含有多种微量元素,如溴、碘、铀等。
3、海水淡化海水淡化是指将海水转化为淡水的工艺过程。
主要方法包括蒸馏法、反渗透法、电渗析法等。
4、海水化学资源的利用海水中的化学资源被广泛应用于工业生产和生活领域,如制盐、制碱、制溴等。
三、知识点提升1、海洋化学资源开发的新进展随着科技的发展,海洋化学资源的开发利用也在不断进步。
例如,海水淡化技术不断优化,提高了生产效率和产品质量。
同时,海洋资源的综合利用也在逐步实现,如利用海藻制备生物燃料和化工原料等。
2、海洋环境污染与保护随着海洋化学资源的开发利用,海洋环境污染问题也日益严重。
为了保护海洋环境,我们需要采取有效措施,如加强污染源控制、实施海洋环境监测和治理等。
四、知识点应用1、计算海水中某种元素的含量。
2、比较不同海域海水的盐度、温度和pH值差异。
3、分析海水淡化技术的发展趋势及其对环境的影响。
4、设计一种从海水中提取某一种化学资源的实验方案。
五、单元总结本单元复习了海水中的化学知识点,包括海水的组成及特点、海水中常见的化学物质、海水淡化技术和海洋化学资源的利用等。
通过回顾和提升知识点,我们可以更好地理解和应用海洋化学资源,为未来的海洋开发与保护做出贡献。
我们需要注意海洋环境污染问题,加强环境保护意识,推动海洋资源的可持续利用。


第六单元 海水中的化学(复习) 第一节海洋化学资源1、 海洋资源类型:、、、2、 海水中含量最多的阳离子 最多的阴离子 最多的盐.3、 海水提镁的过程为:反应的方程式为:①②③ ______________________________3、 天然气的主要成分是,化学式是,燃烧的化学方程式是4、 天然气水合物是由 ___________ 和水在 _______________ 条件下形成的冰状固体,因极易燃烧,又称。
5、 海底蕴藏着一种含多金属的矿物质 --------- 多金属结核,也称。
6、 如何区别海水和淡水。
7、 淡化海水最常用的方法是。
【在线测试】:海水的综合利用可以制备金属镁,其流程如图所示(A 、B 、C 表示主要成分)请回答下列问题: ⑴书写化学式A B C⑵写出题中相应的化学方程式: ①②③ ④⑤⑶整个过程中没有涉及的反应类型是(分解反应、化合反应、置 换反应、复分解反应)第二节海水晒盐1、 在一定,在一定量的 _________________ 里,不能再继续溶解某种物质的溶液,就是该溶质的。
2、 从海水中提取食盐的方法主要为,盐田通常分为 和 两部分。
3、 海水晒盐的过程为:先将海水引入,经日晒蒸发水分至一定程度,再导入,继续日晒,海水成为食盐的,再晒就会逐渐析出食盐,这时得到的晶体就是,剩余的液体为(也称)。
4、 结晶:固体物质从它的 溶液以 形式析出的过程;结晶分为 结晶和 结晶。
石灰乳5、粗盐中的杂质、(、、)提纯步骤为:①②③_____________________________ 三步,都用到的玻璃仪器是;除去NaCl中的NazSCU ,加入,除去NaCl中的MgCl?,加入,除去NaCl中的CaCh,加入。
6、固体溶解度是指:在 ___ 下,某固体物质在______ g溶剂(通常为水)中,达到状态时所溶解的质量;把握四个要素:、、、。
7、根据溶解性把物质分为、、、8、根据曲线回答:(1)a中混有少量b时用什么方法提纯a(2)b中混有少量a时用什么方法提纯btl温度广C【在线测试】:1、粗盐中往往含有难溶与水的泥沙,某同学利用下列实验流程图对粗盐进行提纯看图并回答问题:操作A 操作B 操作C粗盐固体------ ►浑浊液体--------- 澄清液体------ ►食盐固体(1)__________________________________________________ 操作A的名称叫做,该操作一般在进行。


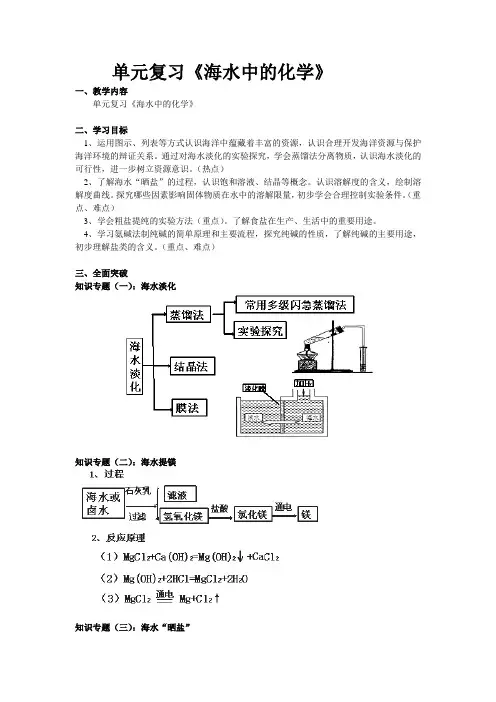
单元复习《海水中的化学》一、教学内容单元复习《海水中的化学》二、学习目标1、运用图示、列表等方式认识海洋中蕴藏着丰富的资源,认识合理开发海洋资源与保护海洋环境的辩证关系。
通过对海水淡化的实验探究,学会蒸馏法分离物质,认识海水淡化的可行性,进一步树立资源意识。
(热点)2、了解海水“晒盐”的过程,认识饱和溶液、结晶等概念。
认识溶解度的含义,绘制溶解度曲线。
探究哪些因素影响固体物质在水中的溶解限量,初步学会合理控制实验条件。
(重点、难点)3、学会粗盐提纯的实验方法(重点)。
了解食盐在生产、生活中的重要用途。
4、学习氨碱法制纯碱的简单原理和主要流程,探究纯碱的性质,了解纯碱的主要用途,初步理解盐类的含义。
(重点、难点)三、全面突破知识专题(一):海水淡化知识专题(二):海水提镁知识专题(三):海水“晒盐”1、原理:2、粗盐的提纯:知识专题(四):饱和溶液与不饱和溶液、结晶、溶解度1、饱和溶液与不饱和溶液相互转化2、结晶:在一定条件下,固体物质从它的饱和溶液中以晶体形式析出的过程。
(1)晶体:具有天然规则几何外形的固体。
3、溶解度知识专题(五):氨碱法制纯碱原理:在食盐水中通入氨气变成饱和的氨盐水,然后在氨盐水中通入足量的CO2生成NaHCO 3,由于NaHCO 3在该状态下溶解度很小,呈晶体析出,同时NaHCO 3不稳定,受热后生成纯碱、水和二氧化碳。
相关反应的化学方程式:NaCl+NH 3+ CO 2+H 2O=NaHCO 3+NH 4Cl 2NaHCO 3∆Na 2CO 3+H 2O+CO 2↑知识专题(六):纯碱的性质、盐的性质 1、纯碱的性质(1)物理性质:白色固体,易溶于水。
(2)化学性质:①与指示剂的作用②与酸反应:Na 2CO 3 +2HCl=2 NaCl+ H 2O+CO 2↑③与氢氧化钙反应:Na 2CO 3 +Ca (OH )2= CaCO 3↓+ 2NaOH2、盐的性质(1)盐的溶解性:口诀:钾钠硝铵盐溶快,硫酸盐中除钡钙,盐酸盐不溶氯化银,碳酸盐中大都沉。




第八单元海水中的化学第一课时◆基础知识:1.(1)海洋资源包括:,,,;海水中元素含量最多的是(填名称,下同),含量最多的金属离子是,含量最多的非金属离子是。
(2)从海水中提取金属镁通常将加入海水或卤水中,沉淀出,与反应生成氯化镁,电解熔融的氯化镁就制得镁,有关的化学方程式为:;;(3)海水淡化常用的方法有、、,目前多采用。
2.海水晒盐(1)物质分离的方法有:,提纯粗盐的步骤有、、。
(2)在一定条件下,固体物质从它的中以析出的过程叫结晶。
获得晶体常用的方法是:①法;适用于,如等;②法;适用于,如等。
(3)固体物质的溶解度是指在,某固体物质在里达到时所溶解的质量。
3.海水制碱(1)工业上用、、、为原料,采用法生产纯碱,先通氨气后通二氧化碳的目的是。
碳酸氢钠先结晶析出的原因是,发生反应的化学方程式为;(2)碳酸氢钠俗名,又称,通常为色晶体,溶于水;纯碱的水溶液呈性,用化学方程式表示纯碱的化学性质:;;。
(3)复分解反应的实质是酸、碱、盐所电离出的离子相互结合,生成、或的过程。
1第二课时◆基础知识一.饱和溶液、不饱和溶液:1.饱和溶液指的是2.不饱和溶液指的是一定要指明在一定温度下、一定量的溶剂里的原因:3.饱和溶液和不饱和溶液的区别和联系:4:浓溶液、稀溶液与饱和溶液、不饱和溶液的关系浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
同一种溶质的溶液,在一定温度下,饱和溶液比不饱和溶液要浓。
二.固体的溶解度1.概念:2.温度对溶解度的影响:(1)大多数物质随着温度的升高溶解度增大。
如KNO3、NH4Cl等。
(2)食盐的溶解度曲线自左而右与横坐标几乎平行,表示温度对溶解度影响不大。
(3)氢氧化钙随着温度的升高溶解度减小。
3.表示固体物质溶解度的概念时,必须注意四点:(1)指出一定;(2)指出溶剂质量克;(3)溶液必须处于状态;(4)溶质的质量单位是。
三.结晶1.结晶(1)定义:溶质以一定几何形状的晶体从溶液中析出的过程叫做结晶。