配位化合物大全
- 格式:doc
- 大小:37.00 KB
- 文档页数:3


无机化合物的配位数无机化合物是指由无机元素组成的化合物,其中包含无机配位化合物。
在无机化学中,配位数是指一个中心金属离子周围配位体的数量,也可以理解为金属离子与配位体形成稳定配合物的能力。
1. 二配位化合物二配位化合物是指中心金属离子周围有两个配位体。
这种配位数在某些金属元素如银、铜、铂等中较为常见。
例如,二氯化银(AgCl2)就是一个二配位的无机化合物。
在这种化合物中,银离子与两个氯离子配位形成一个稳定的结构。
2. 四配位化合物四配位化合物是指中心金属离子周围有四个配位体。
这种配位数在八面体结构的金属化合物中较为常见,如八面体形的铜(II)离子配合物、锌(II)离子配合物等。
例如,四氯化钛(TiCl4)就是一个四配位的无机化合物。
在这种化合物中,钛离子与四个氯离子配位形成一个稳定的结构。
3. 六配位化合物六配位化合物是指中心金属离子周围有六个配位体。
这种配位数在八面体结构的金属化合物中也很常见,如八面体形的铁(II)离子配合物、镍(II)离子配合物等。
例如,六氯化铁(FeCl6)就是一个六配位的无机化合物。
在这种化合物中,铁离子与六个氯离子配位形成一个稳定的结构。
4. 八配位化合物八配位化合物是指中心金属离子周围有八个配位体。
这种配位数在某些过渡金属元素如钴、铬、镍等中较为常见。
例如,八氯化钴(CoCl8)就是一个八配位的无机化合物。
在这种化合物中,钴离子与八个氯离子配位形成一个稳定的结构。
配位数对于无机化合物的性质和结构具有重要影响。
不同的配位数会导致不同的空间排布和化学行为。
通过调节配位数,可以控制无机化合物的热稳定性、溶解度、配位键强度等性质,从而拓展其在催化、材料科学等领域的应用。
总结:无机化合物的配位数是指中心金属离子周围配位体的数量。
常见的配位数包括二配位、四配位、六配位和八配位。
不同的配位数会导致不同的化学行为和物理性质。
通过了解和研究无机化合物的配位数,可以更好地理解其结构和性质,并为合成和应用提供指导。



化学中的配位化合物知识点配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学中具有重要的地位,广泛应用于催化剂、药物、化妆品、材料等领域。
本文将介绍配位化合物的定义、配体、配位数、结构和性质等方面的知识点。
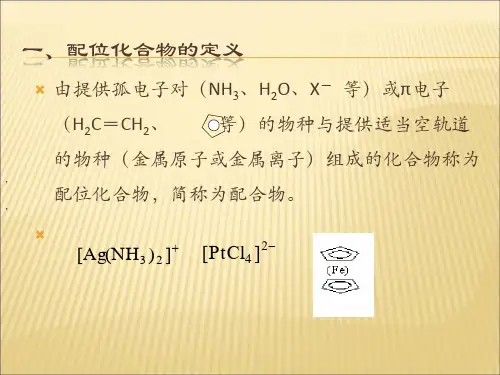
一、定义配位化合物是由一个或多个配体与一个中心金属离子或原子通过配位键相连而形成的化合物。
配位键是指配体上的一个或多个原子通过共用电子对与中心金属离子或原子形成的化学键。
二、配体配体是指能够通过配位键与中心金属离子或原子形成化学键的化合物或离子。
配体可以是简单的阴离子、分子或配合物,常见的配体有水分子(H2O)、氨分子(NH3)、氯化物离子(Cl-)等。
三、配位数配位数是指中心金属离子或原子周围配体的个数。
配位数决定了配合物的结构和性质。
一般情况下,配位数为2或4的配合物呈平面结构,配位数为6的配合物呈八面体结构。
四、结构配位化合物的结构多样,常见的几何构型有线性、正方形、八面体等。
配合物的结构与配位数、中心金属离子的价态、配体的性质等因素有关。
五、配合物的性质配合物具有许多特殊的性质,包括颜色、磁性、溶解度等。
其中,颜色是由于配合物的电子结构所引起的。
许多过渡金属离子在配位化合物中呈现出丰富多彩的颜色。
六、常见的配位化合物1. 水合物:即配位化合物中的水分子,常见于许多金属离子的溶液中,如CuSO4·5H2O(硫酸铜五水合物);2. 氨合物:即配位化合物中的氨分子,常见于许多过渡金属离子的配合物中,如[Co(NH3)6]Cl3(六氨合三氯钴);3. 配位聚合物:由多个配位单元组成的大分子化合物,如蓝色胆矾[Cu(NH3)4][Fe(CN)6](铜铁氰合物);4. 配位聚合物:由两个或多个中心金属离子和对应的配体组成的化合物,如[Fe2(CN)6]4-(四氰合二铁)。
综上所述,配位化合物是化学中的重要概念,对于理解化学反应、催化剂、材料科学等领域具有重要意义。

高考化学常见配位化合物化学是一门研究物质组成、性质和变化的科学,而配位化学则是化学中一个重要的分支。
配位化学是研究含有金属离子或金属原子与配位基(通常是带负电的原子团或分子)相互作用形成稳定化合物的学科。
在高考化学中,配位化合物也是一个重要的考点。
本文将介绍高考化学中常见的配位化合物。
1. [Fe(CN)6]4-:这是高考中常见的一个配位化合物。
它的结构为八面体形,铁离子(Fe2+)与六个氰根离子(CN-)配位形成。
该化合物稳定性很高,可以用作铁的标准溶液,也用于分析化学和生物化学实验中。
2. [Cu(NH3)4]2+:这是另一个高考中常见的配位化合物。
它的结构为正方形平面形,铜离子(Cu2+)与四个氨分子配位形成。
该化合物常用于铜盐的检测和分离,同时也可用来制备其他铜配合物。
3. [Ag(NH3)2]+:这个化合物是银阳离子与两个氨分子配位形成,它在高考化学实验中常用来检测和分析卤素离子(如氯离子、溴离子等)。
4. [Co(NH3)6]3+:这是一个典型的八面体配合物,其中钴离子(Co3+)与六个氨分子配位形成。
该化合物常用于有机合成中的氧化反应,同时也是高考中的重要考点。
5. [Ni(CO)4]:这是一个重要的四面体配合物,在其中镍离子(Ni2+)与四个一氧化碳配位形成。
该化合物是重要的工业催化剂,常用于有机合成反应中。
6. [PtCl2(NH3)2]:这是一个常见的方阵配合物,在其中铂离子(Pt2+)与两个氯离子(Cl-)和两个氨分子配位形成。
该化合物具有良好的溶解性,广泛用于医学和生物化学领域。
这些配位化合物是高考化学中常见的,理解它们的性质和应用对于高考化学的学习和应试非常重要。
除了上述提到的化合物,还有许多其他的配位化合物在高考中也有可能出现。
在学习高考化学时,要注重对配位化合物的分子结构、性质和配位基的影响等方面的理解。
此外,还需要掌握相关的实验操作和分析方法,以便在实际操作中可以正确使用配位化合物。

配位化学分类配位化学是无机化学的一个重要分支,研究的是金属离子或中心原子与周围配体之间的相互作用和配位化合物的性质。
根据配位物中配体的种类和数量,配位化学可以分为多种类型。
一、单一配体配位化合物单一配体配位化合物是指配位物中只含有一种配体的化合物。
根据配体的性质,可以将单一配体配位化合物分为阴离子配位化合物、中性配位化合物和阳离子配位化合物。
1. 阴离子配位化合物阴离子配位化合物是指配位物中的配体为阴离子的化合物。
常见的阴离子配体有氰离子(CN-)、氨基(NH2-)、氯离子(Cl-)等。
阴离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
2. 中性配位化合物中性配位化合物是指配位物中的配体为中性分子的化合物。
常见的中性配体有水(H2O)、一氧化碳(CO)、氨(NH3)等。
中性配体可以通过与金属离子之间的协同作用来形成配位键。
3. 阳离子配位化合物阳离子配位化合物是指配位物中的金属离子为阳离子的化合物。
常见的阳离子配体有氯离子(Cl-)、溴离子(Br-)、碘离子(I-)等。
阳离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
二、多配体配位化合物多配体配位化合物是指配位物中含有多种配体的化合物。
根据配体的数量和结构,多配体配位化合物可以进一步分为双核配位化合物、多核配位化合物和大环配位化合物。
1. 双核配位化合物双核配位化合物是指配位物中含有两个金属离子的化合物。
双核配位化合物可以通过两个金属离子之间的配位键连接起来,形成一个稳定的配位体系。
2. 多核配位化合物多核配位化合物是指配位物中含有多个金属离子的化合物。
多核配位化合物可以通过多个金属离子之间的配位键连接起来,形成一个复杂的配位体系。
3. 大环配位化合物大环配位化合物是指配位物中含有大环结构的化合物。
大环配位化合物可以通过大环结构中的配体与金属离子之间的配位键形成。
三、配位聚合物配位聚合物是指配位物中含有多个相同或不同金属离子的化合物。
配位化合物配位化合物(coordination compound)定义简称配合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
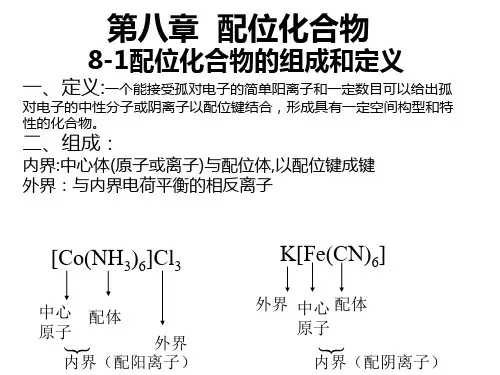
组成配合物由中心原子、配位体和外界组成,例如硫酸四氨合铜(Ⅱ)分子式为〔C u(NH3)4〕SO4,其中Cu2+是中心原子,NH3是配位体,SO4 2-是外界。
中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如四羰基镍〔Ni(CO)4〕中的Ni。
周期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。
配位体可以是中性分子,如〔Cu(NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。
与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+的配位数是6 。
中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体。
它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。
带电荷的配位本体称为配离子。
命名方法①命名配离子时,配位体的名称放在前,中心原子名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④配位数用中文数字在配位体名称之前。
⑤如果配合物中有多种配位体,则它们的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。
不同配位体的名称之间还要用中圆点分开。
根据以上规则,〔Cu(NH3)4〕SO4称硫酸四氨合铜(Ⅱ),〔Pt(NH3)2Cl2〕称二氯·二氨合铂(Ⅱ),K〔PtCl3(C2H4)〕称三氯·(乙烯)合铂(Ⅱ)酸钾。
第8章配位化合物【8-1】命名下列配合物(1) K2[Ni(CN)4] (2)(NH4)2[FeCl5(H2O)](2)[Ir(ONO)(NH3)5]Cl2 (3)Na2[Cr(CO)5]解:(1)四氰合镍(II)酸钾(2)五氯一水合铁(III)酸铵(3)二氯化亚硝酸根五氨合铱(III)(4)五羰基合铬(—II)酸钠【8-2】写出下列配合物(配离子)的化学式:(1) 硫酸四氨合铜(II)(2)四硫氰二氨合铬(III)酸铵(3) 二羟基四水合铝(III)离子(4)二苯合铬解:(1) [Cu(NH3)4]SO4(2) NH4[Cr(SCN)4(NH3)2](3) [Al(OH)2(H2O)4]+(4) Cr(C6H6)2【8-3】AgNO3能从Pt(NH3)6Cl4溶液中将所有的氯沉淀为AgCl,但在Pt(NH3)3Cl4中仅能沉淀出1/4的氯,试根据这些事实写出这两种配合物的结构式。
解:前者为[Pt(NH3)6]Cl4,后者为[PtCl3 (NH3)3]Cl【8-4】画出下列配合物可能有的几异构体:(1) [PtClBr(NH3)py](平面正方形) (2) [Pt(NH3)4(NO2)Cl]Cl2(3) [Pt(NH3)2(OH)Cl3](4) [Pt(NH3)2(OH)2Cl2]解:(1)有3种几何异构体,即在氯离子的对位可以分别是Br—, NH3或py.(2)六配位应为正八面体构型,有2种几何异构体,即氯离子是在硝基的对位还是在邻位.(3)六配位应为正八面体构型,有4种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是氯离子时,在赤道平面上又可以有另一个氨的对位是羟基或是氯离子。
(4)六配位应为正八面体构型,有5种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是羟基或是氯离子时,又可以各有2种异构体,即在赤道平面上的另一个氨的对位是羟基或是氯离子。
【8—5】CN —与(1) Ag +; (2) Ni 2+; (3) Fe 3+; (4) Zn 2+形成配离子,试根据价键理论讨论其杂化类型、几何构型和磁性.答:根据配体的分光化学序,氰根形成强场,并参考附录十二: [Ag(CN )2]-,sp 杂化,直线型,反磁性 [Ni (CN)4]2—, dsp 2杂化,平面正方型,反磁性 [Fe (CN )6]3-, d 2sp 3杂化,八面体,顺磁性 [Zn(CN)4]2—, sp 3杂化,四面体,反磁性【8-6】试用价键理论说明下列配离子的键型(内轨型或外轨型)、几何构型和磁性大小。
配位化合物
配位化合物(coordination compound)
定义
简称配合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
组成
配合物由中心原子、配位体和外界组成,例如硫酸四氨合铜(Ⅱ)分子式为〔C u(NH3)4〕SO4,其中Cu2+是中心原子,NH3是配位体,SO4 2-是外界。
中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如四羰基镍〔Ni(CO)4〕中的Ni。
周期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。
配位体可以是中性分子,如〔Cu(NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。
与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+
的配位数是6 。
中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体。
它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。
带电荷的配位本体称为配离子。
命名方法
①命名配离子时,配位体的名称放在前,中心原子名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④配位数用中文数字在配位体名称之前。
⑤如果配合物中有多种配位体,则它们的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。
不同配位体的名称之间还要用中圆点分开。
根据以上规则,〔Cu(NH3)4〕SO4称硫酸四氨合铜(Ⅱ),〔Pt(NH3)
2Cl2〕称二氯·二氨合铂(Ⅱ),K〔PtCl3(C2H4)〕称三氯·(乙烯)合铂(Ⅱ)酸钾。
实际上,配合物还常用俗名,如K4〔Fe(CN)6〕称黄血盐,K3〔Fe(CN)6〕称赤血盐,Fe4〔Fe(CN)6〕3称普鲁士蓝。
价键
在配合物中,中心原子与配位体之间共享两个电子,组成的化学键称为配位键,这两个电子不是由两个原子各提供一个,而是来自配位体原子本身,例如〔Cu(NH 3)4〕SO4中,Cu2+与NH3共享两个电子组成配位键,这两个电子都是由N原子提供的。
形成配位键的条件是中心原子必须具有空轨道,而过渡金属原子最符合这一条件。
分类
按配位体分类,可有:
①水合配合物。
为金属离子与水分子形成的配合物,几乎所有金属离子在水溶液中都可形成水合配合物,如〔Cu(H2O)4〕2+、〔Cr(H2O)6〕3+。
②卤合配合物。
金属离子与卤素(氟、氯、溴、碘)离子形成的配合物,绝大多数金属都可生成卤合配合物,如K2〔PtCl4〕、Na3〔AlF6〕。
③氨合配合物。
金属离子与氨分子形成的配合物,如〔Cu(NH3)4〕SO4。
④氰合配合物。
金属离子与氰离子形成的配合物,如K4〔Fe(CN)6〕。
⑤金属羰基合物。
金属与羰基(CO)形成的配合物。
如〔Ni(CO)4〕。
按中心原子分类,可有:
①单核配合物。
只有一个中心原子,如K2〔CoCl4〕。
②多核配合物。
中心原子数大于1,如〔(H3N)4Co(OH)(NH2)Co(H2 NCH2CH2NH2)2〕Cl4。
按成键类型分类,可有:
①经典配合物。
金属与有机基团之间形成σ配位键,如〔Al2(CH3)6〕。
②簇状配合物。
至少含有两个金属作为中心原子,其中还含有金属-金属键,如〔W6(Cl12)Cl6〕。
③含不饱和配位体的配合物。
金属与配位体之间形成π-σ键或π-π*反馈键,如K〔PtCl2(C2-H4)〕。
④夹心配合物。
中心原子为金属,配位体为有机基团,金属原子被夹在两个平行的碳环体系之间,例如二茂铁〔Fe(C5H5)2〕。
⑤穴状配合物。
配位体属于巨环多齿的有机化合物,如具有双环结构的N(CH2 CH2OCH2CH2OCH2CH2)3N,它们与碱金属和碱土金属形成穴状配合物。
按学科类型分类,可有:
①无机配合物。
中心原子和配位体都是无机物。
②有机金属化合物。
金属与有机物配位体之间形成的配合物。
③生物无机化合物。
生物配位体与金属形成的配合物,如金属酶、叶绿素、维生素B12。
稳定性
通常,配位化合物的稳定性主要指热稳定性和配合物在溶液中是否容易电离出其组分(中心原子和配位体)。
配位本体在溶液中可以微弱地离解出极少量的中心原子(离子)和配位体,例如〔Cu(NH3)4〕2+可以离解出少量的Cu2+和NH3:配位本体在溶液中的离解平衡与弱电解质的电离平衡很相似,也有其离解平衡常数,称为配合物的稳定常数K:
K越大,配合物越稳定,即在水溶液中离解程度小。
配合物在溶液中的稳定性与中心原子的半径、电荷及其在周期表中的位置有关。
过渡金属的核电荷高,半径小,有空的d轨道和自由的d电子,它们容易接受配位体的电子对,又容易将d电子反馈给配位体。
因此,它们都能形成稳定的配合物。
碱金属和碱土金属恰好与过渡金属相反,它们的极化性低,具有惰性气体结构,形成配合物的能力较差,它们的配合物的稳定性也差。