硅与无机非金属材料
- 格式:doc
- 大小:1.40 MB
- 文档页数:8


第2课时 硅酸盐与无机非金属材料1.水玻璃是Na 2SiO 3的水溶液,有黏性,常用作矿物胶。
2.传统无机非金属材料是指玻璃、水泥和陶瓷。
3.新型无机非金属材料包括高温结构陶瓷、生物陶瓷、压电陶瓷等。
4.玻璃的成分为:Na 2SiO 3、CaSiO 3、SiO 2;水泥的成分为:3CaO·SiO 2、2CaO·SiO 2、3CaO·Al 2O 3。
5.两个化学方程式:CaCO 3+SiO 2=====高温CaSiO 3+CO 2↑,Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑。
对应学生用书P861.我们已学过的材料有哪些?提示:金属材料、硅酸盐材料、有机高分子材料、复合材料。
2.玻璃属于什么材料? 提示:硅酸盐材料。
3.塑料属于什么材料? 提示:有机高分子材料。
[新知探究]探究1 玻璃(1)主要原料:纯碱、石灰石、石英。
(2)主要反应:⎩⎪⎨⎪⎧Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑CaCO 3+SiO 2=====高温CaSiO 3+CO 2↑ (3)产品成分:Na 2SiO 3、CaSiO 3、SiO 2。
探究2 水泥(1)主要原料:黏土、石灰石。
(2)产品成分:硅酸三钙、硅酸二钙、铝酸三钙。
探究3 陶瓷 原料:黏土。
[必记结论](1)硅酸盐除Na 2SiO 3、K 2SiO 3易溶于水,其他都难溶于水。
(2)Na 2SiO 3水溶液俗称水玻璃,有黏性,常用作矿物胶。
(3)玻璃、水泥、陶瓷均为硅酸盐材料,不溶于水。
(4)水泥有水硬性,石膏的主要作用是调节水泥的硬化速度。
(5)玻璃属于混合物,没有固定熔点。
(6)钢化玻璃的成分与普通玻璃的成分相同。
[成功体验]1.(好题共享·选自人教版教材P 80·T 1)有下列物品或设备:①陶瓷餐具 ②砖瓦 ③水泥路桥 ④门窗玻璃 ⑤水晶镜片 ⑥石英钟表 ⑦玛瑙手镯 ⑧硅太阳能电池 ⑨石英光导纤维 ⑩计算机芯片。

《无机非金属材料的主角——硅》的教学与反思1. 引言1.1 硅的重要性硅是一种极其重要的无机非金属材料,广泛应用于各个领域。
其重要性主要表现在以下几个方面:硅是一种重要的半导体材料。
在电子行业中,硅被广泛用于制造各种电子器件,如集成电路、太阳能电池等。
由于硅具有良好的半导体性能和稳定的化学性质,使得它成为电子行业中不可或缺的材料之一。
硅在建筑材料领域也有重要应用。
硅酸盐材料在建筑领域中被广泛应用,如水泥、陶瓷等。
硅材料的高强度、耐火性和耐腐蚀性,使其成为建筑材料中的主要组成部分之一。
硅在化工领域也有广泛的应用。
硅氧烷、硅醇等有机硅化合物在化工生产中被广泛应用于润滑剂、橡胶填料、涂料等领域,发挥着重要的作用。
1.2 无机非金属材料的介绍无机非金属材料是一类极为重要的材料,它们在现代工业生产和科学研究中发挥着重要的作用。
无机非金属材料具有多样的物理性质和化学性质,涵盖了广泛的领域,如电子、光学、磁性、隔热、耐高温等。
这类材料通常具有较高的熔点和硬度,同时具有独特的特性,例如光学透明性、电绝缘性、化学稳定性等。
无机非金属材料可以分为多种类型,如硅、氧化物、氮化物、碳化物等,每种材料都有其独特的应用和制备方法。
硅作为无机非金属材料中的一种主要材料,在现代工业中扮演着重要的角色,广泛应用于半导体工业、太阳能电池、光电子器件等领域。
硅具有良好的导电性、光学性能和机械强度,是一种非常重要的无机非金属材料。
在工业生产和科学研究中,研究和应用无机非金属材料具有重要的意义,可以推动材料科学和工程技术的发展。
2. 正文2.1 硅的物理性质硅是一种常见的无机非金属材料,具有许多重要的物理性质。
硅是一种灰色的晶体固体,通常呈现出类似于钻石的结构。
硅的密度很低,只有2.33克/立方厘米,使得它成为一种较为轻盈的材料。
硅的熔点很高,达到了1414摄氏度,使得硅在高温环境下依然能够保持稳定的性质。
硅还具有良好的电特性,是一种半导体材料。


第14讲碳、硅及无机非金属材料[高考评价要求]1.结合真实情境中的应用实例或通过实验探究,了解碳、硅及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。
2.结合实例认识碳、硅及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
考点一碳及其重要化合物1.碳单质:存在形式有金刚石、石墨、足球烯等,它们互为同素异形体。
①碳单质的结构不同导致物理性质不同,但化学性质相似。
②同素异形体之间的转化是化学变化,且属于非氧化还原反应。
2.碳的氧化物(CO、CO2)的比较CO CO2物理性质无色、无味的气体,密度比空气略小,难溶于水无色、无味的气体,密度比空气大,可溶于水(溶解度小)毒性有毒(易结合血红蛋白)无毒(温室效应)化学性质还原性可燃性,还原氧化铁—氧化性—①与炽热的木炭反应②Mg在CO2中燃烧与水反应—CO2+H2O H2CO3与碱反应(石灰水)—Ca(OH)2+CO2===CaCO3↓+H2O(检验CO2)续表CO CO2相互转化CO2C,△①O2;②CuOCO用途燃料、冶炼金属等灭火、制汽水、植物肥料、化工原料等3.碳酸(H2CO3):弱酸、不稳定。
碳酸只能存在于水中,在水中与CO2共存,因此常把CO2+H2O当碳酸用。
1.碳是构成地球生命的一种重要非金属元素,碳单质很早就被人类认识和利用,碳的一系列化合物——有机化合物,更是生命的根本。
下列有关说法中正确的是()A.含碳的化合物数量众多、分布极广B.向空气中大量排放二氧化碳气体会形成酸雨,破坏建筑物C.碳单质有多种不同的存在形式,如金刚石、12C、14C、C60等D.煤、石油属于不可再生能源,天然气、乙醇属于可再生能源答案:A2.(双选)(2022·潍坊高三模拟)科技的进步为二氧化碳资源化利用提供了广阔的前景。
下列说法错误的是()A.CO 2是自然界碳循环中的重要物质B.CO 2加氢转化为乙烯,CO 2被氧化C.CO 2电催化时,在阳极转化为燃料D.CO 2与环氧丙烷可合成可降解塑料解析:选BC 。

知识点一.硅1.硅的化学性质。
在常温下,硅的化学性质不活泼,不与O 2、Cl 2、H 2SO 4、HNO 3等反应,但可与氟气、氢氟酸和强碱反应。
①硅和氟气反应:Si+2F 2==SiF 4。
②硅和氢氟酸反应:Si+4HF==SiF 4↑+2H 2↑。
③硅和氢氧化钠溶液反应:Si+2NaOH+H 2O==Na 2SiO 3+2H 2↑。
④硅在氧气中加热:Si+O 2SiO 2。
2. 硅的工业制法。
SiO 2+2C Si(粗硅)+2CO ↑(注意产物)提纯:Si+2Cl 2SiCl 4 ;SiCl 4+2H 2Si+4HCl ↑3.晶体硅的用途。
用来制造半导体器件,制成太阳能电池、芯片和耐酸设备等。
知识点二. 二氧化硅1.物理性质:硬度大、熔点高,难溶于水。
2.化学性质:①酸性氧化物的通性:SiO 2是酸性氧化物,是H 2SiO 3的酸酐,但不溶于水:△无机非金属材料的主角-硅SiO2+CaO CaSiO3SiO2+2NaOH=Na2SiO3+H2O (Na2SiO3是强的粘合剂)②弱氧化性:SiO2+2C Si+2CO↑③特性:SiO2+4HF=SiF4↑+2H2O要点解释:(A)由于玻璃的成分中含有SiO2,故实验室盛放碱液的试剂瓶用橡皮塞而不用玻璃塞。
(B)未进行磨砂处理的玻璃,在常温下是不易被强碱腐蚀的,故盛放碱液可以用玻璃瓶(不能用玻璃塞)。
(C)因为氢氟酸腐蚀玻璃,与玻璃中的SiO2反应,所以氢氟酸既不能用玻璃塞、也不能用玻璃瓶保存,而应保存在塑料瓶或铅皿中。
3.用途:①SiO2是制造光导纤维的主要原料。
②石英制作石英玻璃、石英电子表、石英钟等。
③水晶常用来制造电子工业的重要部件、光学仪器、工艺品等。
④石英砂常用作制玻璃和建筑材料。
4.SiO2与CO2化学性质的比较CO2+H2O H2CO3SiO2+CaO CaSiO3SiO2+2C Si+2CO↑知识点三.硅酸(H4SiO4、H2SiO3)△1.不稳定性:H2SiO3SiO2 +H2O2.极弱酸性:不能使酸碱指示剂变色:H2SiO3+2NaOH=Na2SiO3+2H2O制备:Na2SiO3+CO2+H2O=H4SiO4↓(白色胶状)+Na2CO3或Na2SiO3+2HCl==H2SiO3↓+2NaCl,H4SiO4=H2SiO3+H2O(不稳定、易分解)知识点四. 硅酸盐1.常用的硅酸盐是Na2SiO3,俗称“泡花碱”,易溶于水,其水溶液称为水玻璃,是一种矿物胶,密封保存。

第四章非金属及其化合物第一节无机非金属材料的主角——硅第二课时学习目标:1.掌握硅酸盐的性质、用途。
2.了解陶瓷、玻璃、水泥等几类硅酸盐产品。
3.了解新型陶瓷和几种具有特殊功能的含硅物质。
重点难点:硅酸盐知识梳理三.硅酸盐1.概念:由组成的化合物的总称。
2.性质:硅酸盐是一类结构复杂的固态物质,大多数水,化学性质很。
3.最常见的硅酸盐――Na2SiO3(1)性质:溶于水,水溶液俗称,呈性。
(2)用途:是和的原料。
4.硅酸盐组成的表示通常用二氧化硅和金属氧化物的组成形式表示其组成例如:硅酸钠:Na2SiO3:;石棉:;黏土的主要成分:;长石KAlSi3O8:。
5.三种常见的硅酸盐产品6.特殊功能的含硅物质(1)金刚砂(SiC)具有类似的结构,硬度,可以用作砂纸、砂轮磨料。
(2)硅钢(含硅4%)具有很高的,主要用作变压器铁芯。
(3)硅橡胶:既耐又耐,可用于制造火箭,导弹的零件。
(4)人工制造的分子筛(具有均匀微孔结构的铝硅酸盐),主要用作和。
7.新型陶瓷:主要有、、、几类。
四.硅单质单质硅有和两类。
(1)硅的物理性质晶体硅是有光泽的色固体,熔点、硬度、有性,是良好的。
(2)硅的化学性质①硅单质与强碱溶液反应:Si +2NaOH +H2O = Na2SiO3 + 2H2↑②硅单质与氢氟酸(HF)反应:Si +4HF =SiF4↑+2H2 ↑(3)硅的用途①材料,如硅芯片等。
②新型能源,如等。
知能检测1.下列物质中属于纯净物的是()A.Na2CO3·10H2OB.水泥C.纯净的盐酸D.普通玻璃2.下列物质有固定熔点的是A.玻璃B.水泥C.水玻璃D.Na2O·SiO23.在实验室熔化NaOH固体,不能选用的坩锅是A .铁坩锅B .瓷坩锅C .铝坩锅D .石墨坩锅4.在玻璃工业、水泥工业中都用到的原料是 ( )A .纯碱B .石英C .石灰石D .粘土5.下列物质稳定性由强到弱的是( ) ①CaSiO 3,②H 2CO 3,③CaCO 3,④Ca(HCO 3)2A .①②③④B .②④③①C .①③④②D .①④③②6.高岭土的组成表示为Al 2Si 2Ox(OH)y ,其中x 、y 的数值分别为( )A .7,2B .6,3C .5,4D .3,67.能将CaCO 3 、SiO 2、Na 2SiO 3三种白色粉末鉴别开来的试剂是( )A .苛性钠溶液B .水C .氢氟酸D .稀盐酸8.下列物质的浓溶液,能用磨口玻璃试剂瓶盛放的是( )A .浓H 2SO 4B .水玻璃C .苛性钾D .氢氟酸9.将22.5g 石英与60g 石灰石在高温下反应,产生的气体在标况下的体积为( )A .5.6LB .11.2LC .13.44LD .6.72L10.下列几种物质不能长期暴露在空气中的是( )A .水晶B .水玻璃C .醋酸D .石英11.把26克含有SiO 2的CaCO 3固体在高温下加热到质量不再改变,冷却后称量为17.2克。

《硅无机非金属材料》知识清单一、硅元素的存在及性质硅在自然界中的存在形式非常丰富,主要以二氧化硅和硅酸盐的形式存在于地壳中。
硅是一种亲氧元素,这使得它在自然界中很少以单质形式存在。
硅的原子结构决定了它的化学性质。
硅原子的最外层有 4 个电子,既不容易失去电子,也不容易得到电子,所以硅在化学反应中通常表现出一定的惰性。
但在特定条件下,硅也能与一些物质发生反应。
硅具有半导体的性质,这一特性使得它在电子工业中有着极其重要的应用。
二、二氧化硅1、物理性质二氧化硅是一种坚硬、难熔的固体,具有较高的熔点和沸点。
它不溶于水,无色透明。
2、化学性质二氧化硅的化学性质相对稳定,但在一定条件下也能与一些物质发生反应。
(1)与氢氟酸反应:SiO₂+ 4HF = SiF₄↑ + 2H₂O,这是二氧化硅的一个特性反应,常用于雕刻玻璃。
(2)与碱性氧化物反应:SiO₂+ CaO =高温= CaSiO₃(3)与强碱溶液反应:SiO₂+ 2NaOH = Na₂SiO₃+ H₂O3、用途二氧化硅用途广泛,常用于制造光导纤维、石英玻璃、石英坩埚等。
光导纤维利用了二氧化硅对光的全反射原理,使得信息能够快速、高效地传输。
三、硅酸1、性质硅酸是一种很弱的酸,溶解度很小。
制备硅酸通常是通过可溶性硅酸盐与酸反应得到。
2、用途硅酸可以用于制备硅胶,硅胶具有吸水性,常用作干燥剂。
四、硅酸盐1、常见的硅酸盐如硅酸钠(Na₂SiO₃),其水溶液俗称水玻璃,具有粘性,可作防火剂和黏合剂。
2、传统的硅酸盐材料(1)陶瓷:是以黏土为原料,经过高温烧制而成。
陶瓷具有硬度高、耐腐蚀等优点,广泛应用于日常生活和工业生产中。
(2)玻璃:主要成分是硅酸钠、硅酸钙和二氧化硅。
玻璃具有透明、美观等特点,有多种类型,如普通玻璃、钢化玻璃等。
(3)水泥:主要成分是硅酸三钙、硅酸二钙和铝酸三钙。
水泥是建筑行业中不可或缺的材料。
五、新型无机非金属材料1、高温结构陶瓷如碳化硅、氮化硅等,具有耐高温、耐磨损、耐腐蚀等优点,可用于制造发动机部件、刀具等。


精心整理
高一化学必修二章节知识点解析:无机非金属材料—硅
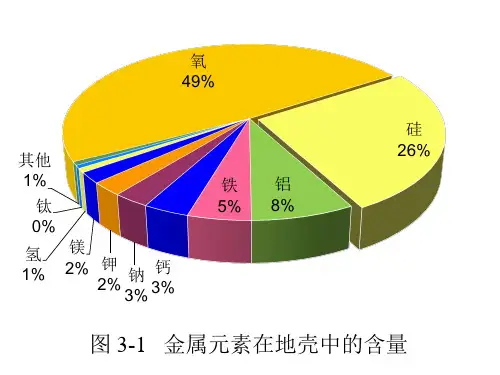
一、硅元素:无机非金属材料中的主角,在地壳中含量26.3%,次于氧。
是一种亲氧元素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。
位于第3周期,第ⅣA , 碱(NaOH)反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应 SiO2+4HF==SiF4↑+2H2O
SiO2+CaO===(高温)CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
三、硅酸(H2SiO3)
酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应
)最典
陶瓷、水泥
金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。
是良好的半导体,应用:半导体晶体管及芯片、光电池、
六、氯元素:位于第三周期第ⅦA族,原子结构:容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
【同步练习题】
1、宣传科学知识,介绍高新科技,揭露伪科学,是科学工作者的义务,下列说法属于伪科学的是
可防止
D.用干
4、将过量的二氧化碳通入下列溶液中,最终会出现浑浊的是
A.氯化钙溶液
B.澄清的石灰水
C.水玻璃
D.硝酸钡溶液
5、熔融烧碱应选用的器皿是
A.铁制坩埚
B.普通玻璃坩埚
C.石英坩埚
D.陶瓷坩埚。
优化集训11 硅与无机非金属材料一、选择题1.太阳能电池已为人们所熟悉,制造太阳能电池板的核心材料是( )A.二氧化硅B.硅C.钛合金D.铝合金2.生产普通硅酸盐水泥、普通玻璃共同的主要原料是( )A.黏土B.纯碱C.石灰石D.石英3.水晶的主要成分是SiO2,SiO2属于( )A.混合物B.非金属单质C.氧化物D.有机化合物4.高岭土是制造瓷器的主要原料,组成为Al2Si2O x(OH)y,x、y的值可能为( )A.7 6B.6 5C.5 4D.4 35.下列有关硅及硅酸盐材料的说法正确的是( )A.硅酸钠溶液可以保存在带磨口玻璃塞的试剂瓶中B.高纯度的硅单质广泛用于制作光导纤维C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料D.反应Si+2NaOH+H2O Na2SiO3+2H2↑中的还原剂是Si6.下列物质不能通过化合反应制得的是( )A.SiO2B.NaHCO3C.H2SiO3D.SiCl47.下列有关普通玻璃的说法不正确的是( )A.制普通玻璃的主要原料是纯碱、石灰石和石英B.玻璃在加热熔化时有固定的熔点C.普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口粘在一起8.《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2O6)。
下列关于硅酸铜钡的说法不正确的是( )A.是一种硅酸盐B.性质稳定,不易脱色C.易溶于强酸和强碱D.可用氧化物形式表示为BaO·CuO·2SiO29.陶瓷是传统硅酸盐产品,根据陶瓷的生产原理,可以得出硅酸盐工业的一般特点是( )①以含硅物质作为原料 ②主要产物是硅酸盐 ③反应条件是高温 ④反应原理是复杂的物理变化和化学变化A.只有①③B.只有②③C.①②③④D.只有②④10.在野外,用硅、熟石灰、烧碱的混合物制取氢气:Si+Ca(OH)2+2NaOHNa2SiO3+CaO+2H2↑。
高三化学复习硅及其化合物无机非金属材料教案【高考考点】1.硅和二氧化硅2.无机非金属材料3.硅的用途【知识要点】一.硅1.晶体硅的结构2.硅的存在和物理性质⑴存在:只以态存在,主要以和,在地壳中含量居第位。
⑵物理性质:晶体硅是一种色具有光泽,硬而脆的固体,熔沸点较高,能导电,是良好的材料。
3.化学性质:⑴与单质(O2、F2)反应⑵与酸(HF)反应⑶与强碱(如NaOH)溶液反应4.用途制造、、、5.工业制法二.二氧化硅1.晶体结构2.物理性质3.化学性质4.用途制造,,,,等。
三.硅酸硅的常见含氧酸有原硅酸、硅酸。
原硅酸是一种色溶于水的胶状物,易失水变为白色粉末状的硅酸(溶于水),硅酸在一定条件下继续失水可转变成。
硅酸是一种酸,酸性比碳酸还要。
实验室制取硅酸常用Na2SiO3(aq)与稀HCl (aq)或向Na2SiO3(aq)中通入CO2(g)(首先生成原硅酸)。
写出上述有关反应的化学方程式。
、四.硅酸盐硅酸钠 Na2SiO3(Na2O·SiO2)高岭石 Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)常见可溶性硅酸盐是硅酸钠,其水溶液俗名,是一种无色粘稠液体,是一种矿物胶,用作黏合剂,还可用作。
五.无机非金属材料1.传统无机非金属材料——硅酸盐材料硅酸盐工业是以为原料,经制成的。
如制造、、等产品的工业。
水泥、玻璃和陶瓷生产的有关比较2.新型无机非金属材料⑴新型无机非金属材料的特性主要有:①。
②具有特性③具有特性④具有⑵重要的新型无机非金属材料——高温结构陶瓷和光导纤维①高温结构陶瓷——、、②光导纤维【高考试题】1.下列物质的晶体中,不存在分子的是A.二氧化硅 B.二硫化碳 C.二氧化硫 D.二氧化碳2.下列物质属于原子晶体的化合物是A.金刚石 B.晶体硅 C.二氧化硅 D.干冰3.光纤是一种很好的通讯材料,制造光导纤维的主要原料是A.CaCO3 B.CaO C.SiO2 D.Na2CO34.固体熔化时必须破坏非极性共价键的是A.冰 B.晶体硅 C.溴 D.二氧化硅5.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。