消去反应取代反应
- 格式:ppt
- 大小:2.48 MB
- 文档页数:15


有机化学中的取代反应和消除反应有机化学是研究碳元素及其化合物的化学性质和变化规律的学科。
在有机化学中,取代反应和消除反应是两种常见的反应类型。
它们在有机合成和药物研发等领域中有着重要的应用。
本文将对取代反应和消除反应进行介绍和讨论。
一、取代反应1.1 取代反应的概念取代反应是指一个原子、离子或官能团被另一个原子、离子或官能团所取代的化学反应。
在有机化学中,常见的取代反应包括亲核取代反应和电子亲攻取代反应。
1.2 亲核取代反应亲核取代反应是指亲核试剂与有机分子中电子不足的部位发生反应,亲核试剂中的亲核试剂取代了有机分子中的某功能团或原子。
典型的亲核取代反应包括酯水解、醇醚化反应和酰基取代反应等。
1.3 电子亲攻取代反应电子亲攻取代反应是指亲电试剂与有机分子中的一个亲电中心发生反应,亲电试剂取代了有机分子中的某个官能团或原子。
典型的电子亲攻取代反应包括芳香取代反应和炔烃加成反应等。
二、消除反应2.1 消除反应的概念消除反应是指有机分子中两个官能团之间的化学键发生断裂,生成一个双键或三键的化学反应。
消除反应可以是单分子反应,也可以是双分子反应。
2.2 β-消除反应β-消除反应是指在有机分子中,发生在邻位(β位)碳上的消除反应。
典型的β-消除反应包括醇酸消除反应和芳香羧酸消除反应等。
2.3 δ-消除反应δ-消除反应是指在有机分子中,发生在δ位碳上的消除反应。
典型的δ-消除反应包括酮醇消除反应和烯烃酮消除反应等。
三、应用和进展3.1 应用领域取代反应和消除反应在有机合成中有广泛的应用。
它们可以用于构建复杂分子的骨架,引入特定官能团,改变分子的立体结构等。
这些反应在药物研发、材料科学和农药合成等领域中扮演着重要的角色。
3.2 进展和研究方向随着有机化学的发展,新的取代反应和消除反应不断被发现和探索。
研究人员不断提出新的催化剂、反应条件和底物设计,以改善反应效率、选择性和绿色性。
此外,有机合成中的计算化学方法和机器学习算法也得到了广泛的应用,为反应的理解和优化提供了新的思路和工具。

五卤代烃1.水解反应(取代反应)NaOHCH 3CH 2Br + H 2----------- CH 3CH 2OH + HBrCH 3CH 2Br + NaOH H Q , CH3CH 2OH + NaBr2.消去反应醇,△CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O六醇1.乙醇与钠反应2CH 3CH 2OH + 2Na — 2CH 3CH 2ONa + H 2T2.乙醇催化氧化2CH 3CH 2OH + O 2—Cu > 2CH 3CHO + 2H 2O△CH.CH.OH + CuO CH^CHO +Cu + H2O或" --催化氧化规律?3.乙醇脱水(分子间、分子内)消去反应CH 3CH 2OH [ ,H2O + CH 2=CH2 T2CH 3CH 2OH 浓H2S6 〉H2O + CH 3CH 2O CH 2CH 3 取代反应140°C乙醚.CH^- CH厂 CH - CH】浓雲巴-CH = CH-阻申0OH消去反应4酯化反应(取代反应)浓H必0二RCOOH+HOR' RCOOR'+H 2O浓出50二CH 3COOH + H 18OC 2H 5 CH 3CO 18OC 2H 5 + H 2O 1.苯酚与氢氧化钠溶液反应—OH + NaOH—ONa + H 2O2. 苯酚钠溶液中通入二氧化碳一 O - + CO 2 + H 2o — = OH + HCO 3此法用于分离提纯苯酚3,苯酚与钠反应4. 苯酚的定性检验定量测定方法:6显色反应:遇铁离子呈紫色 -ONa + CO 2 + H 2° * I — OH + NaHCO 3 ■NaOH .2(5+2N 印 ----- 2kJJ+H £fOHOH |Br - 丿、 r * I ■ O D 「 1+ 3Br 2 1(溴水) 5缩聚反应:0H-rJ + 3HBr n 0 +nHCHO。

大学有机化学复习总结取代反应与消除反应大学有机化学复习总结:取代反应与消除反应在大学有机化学学习过程中,取代反应与消除反应是两个重要的反应类型。
本文将对这两种反应进行综合总结,包括各种反应的机制、条件以及相关应用。
通过对这些内容的梳理,将有助于提高对有机化学的理解和应用能力。
一、取代反应1. 概述取代反应是有机化学中最常见的反应类型之一。
这种反应中,一个原子或一个官能团被另一个原子或官能团所取代。
取代反应可分为亲电取代反应和亲核取代反应两类。
2. 亲电取代反应亲电取代反应是指受电子亲和性较强的亲电试剂攻击亲电子较弱的反应物分子,生成中间体,最终得到产物的过程。
常见的亲电试剂包括卤素、酸、酸酐等。
亲电取代反应机制有S_N1和S_N2两种。
以S_N2反应为例,它是一种亲核反应,反应速率与亲核试剂浓度成正比。
在反应中,亲核试剂一步到位地攻击反应物,并将原来连接在反应物上的基团进行取代。
S_N2反应要求反应底物为二次或三次碳中心,而且通常是立体拥挤较少的反应物。
3. 亲核取代反应亲核取代反应是指亲核试剂攻击亲电子较强的反应物分子,形成中间体,再经过负电离生成产物的过程。
常见的亲核取代反应有酯酸酐反应、酯醇反应、羧酸取代反应等。
以酯酸酐反应为例,该反应通常需要在碱性条件下进行。
在反应中,亲核试剂攻击反应物中的酯酸酐,产生中间体,最终生成酯。
二、消除反应1. 概述消除反应是有机化学中另一种重要的反应类型。
这种反应中,分子内或分子间的官能团或原子被去除,使得两个碳原子之间的键数量减少。
消除反应可分为β-消除反应、α-消除反应以及氢氧根消除反应等。
2. β-消除反应β-消除反应是指由于邻位取代基影响,在α位和β位之间发生消除,生成双键或三键的过程。
β-消除反应常见的机制有E1、E2和E1cb三种。
以E2反应为例,它是一种分子间反应,反应速率与底物浓度和碱的浓度成正比。
在反应中,碱通过攻击底物的氢,同时使得相邻的取代基离去,生成双键。
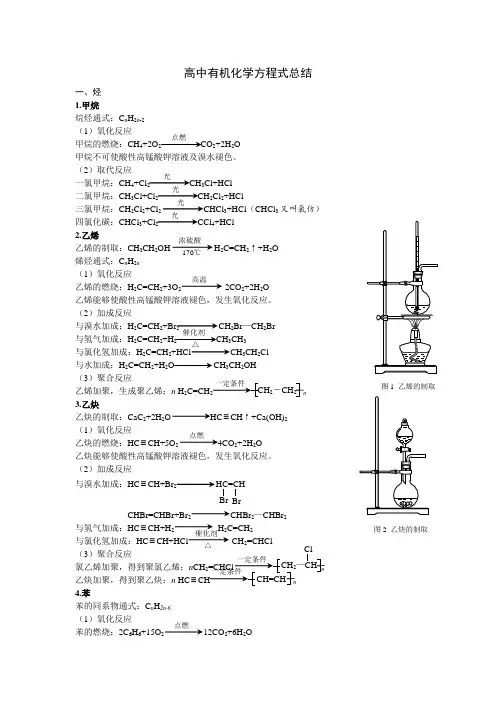
高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯能够使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔能够使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O点燃光光光光浓硫酸170℃ 高温催化剂△2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH点燃苯不能使溴水和酸性高锰酸钾溶液褪色。
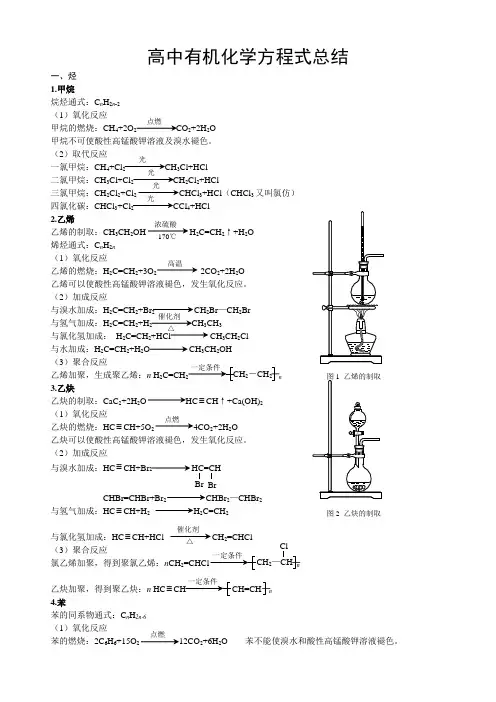
高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。

有机反应的基本类型在有机化学的学习中,我们一定要熟练掌握各种烃和烃的衍生物的基本化学性质,此外,还要弄明白有机化学反应的原理,清楚在各种反应类型中什么键断裂、又有什么新键形成,从而理解各种反应的本质,并反过来加深对有机物化学性质的理解。
下面来看看几种基本的有机反应的类型和原理吧!有机反应类型1.取代反应:有机物分子中的某些原子或原子团被其它原子或原子团所代替的反应。
包括:烷烃的卤代,醇和氢卤酸的反应,苯的溴代、硝化、磺化,苯酚和溴水的反应。
广义说:酯化、水解也可归属于取代反应。
2.加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成一种新物质的反应。
包括:烯烃、炔烃、苯环、醛和油脂等加H2,烯烃、炔烃等加X2,烯烃、炔烃等加HX,烯烃、炔烃等加H2O等等。
加成反应是不饱和碳原子的特征反应之一。
其中加氢的反应又可定为还原反应。
3.消去反应:有机物在一定条件下从一个分子中脱去一个小分子(如H2O、HX、NH3等)生成不饱和化合物的反应。
包括:醇分子内脱水生成烯烃、卤代烃脱HX生成烯烃等。
4.裂化反应:在一定温度下把分子量大、沸点高的长链烃断裂为分子量小、沸点低的短链烃的反应。
裂化举例:C16H34→C8H18+C8H16 C8H18→C4H10+C4H8裂解是深度裂化:如:C4H10→C2H6+C2H4 C4H10→CH4+C3H65.氧化反应:有机物燃烧或得氧失氢的反应。
包括:燃烧氧化和去氢加氧的催化氧化。
6.聚合反应:包括加聚反应和缩聚反应。
加聚反应是由不饱和的单体聚合生成高分子化合物的反应。
如乙烯类、混和烯类及其不饱和单体的加聚。
缩聚反应是由单体相到发生反应生成高分子化合物同时还生成小分子(如:H2O、NH3、HCl等)的反应。
如二元醇与二元酸之间的缩聚、氨基酸之间的缩聚等。
体验1下列反应,属于消去反应的是()ABCD体验思路:抓住本质,根据消去反应的定义判断。
体验过程:消去反应是有机物在一定条件下从一个分子中脱去一个小分子(如H2O、HX、NH3等)生成不饱和化合物的反应。

取代反应取代反应是指有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
包括:卤代反应、硝化反应、磺化反应、卤代烃的水解反应、酯化反应、酯的水解反应等。
由于取代反应广泛存在,几乎所有的有机物都能发生取代反应。
加成反应加成反应是指有机物分子中不饱和的碳原子跟其他原子或原子团直接结合生成新的化合物的反应。
包括:与氢气的加成反应(烯、炔和苯环的催化加氢;醛、酮催化加氢;油脂的加氢硬化)、与卤素单质的加成反应、与卤化氢的加成反应、与水的加成反应等。
只有不饱和有机物才能发生加成反应。
消去反应消去反应是指有机物在适当条件下,从一个分子脱去一个小分子(如水、HX等),而生成不饱和(双键或三键)化合物的反应。
包括醇的消去反应和卤代烃的消去反应。
在中学阶段,酚不能发生消去反应,并不是所有的醇或卤代烃都能发生消去反应。
脱水反应脱水反应是指有机物在适当条件下,脱去相当于水的组成的氢氧元素的反应。
包括分子内脱水(消去反应)和分子间脱水(取代反应)。
脱水反应不一定是消去反应,比如乙醇脱水生成乙醚就不属于消去反应。
水解反应广义的水解反应,指的凡是与水发生的反应。
中学有机化学里能够与水发生水解反应的物质,一般指的卤代烃水解、酯的水解、油脂的水解(含皂化)、糖类的水解、多肽或蛋白质的水解等。
氧化反应氧化反应是指有机物加氧或去氢的反应。
包括:①醇的催化氧化:羟基的O—H键断裂,与羟基相连的碳原子的C—H键断裂,去掉氢原子形成C =O键;②醛类及含醛基的化合物与新制碱性Cu(OH)2或银氨溶液的反应;③乙烯在催化剂存在下氧化成CH3CHO;④有机物的燃烧、不饱和烃和苯的同系物使酸性KMnO4溶液褪色等。
⑤苯酚在空气中放置转化成粉红色物质(醌)。
还原反应还原反应指的是有机物加氢或去氧的反应。
包括醛、酮、烯、炔、苯及其同系物、酚、不饱和油脂等有机物的催化加氢。
酯化反应酯化反应是指酸和醇作用生成酯和水的反应。
酯化反应属于取代反应,但是并非所有生成酯的反应都属于酯化反应,比如CH3COONa+CH3CH2Br →CH3COOCH2CH3+NaBr的反应就不属于酯化反应聚合反应聚合反应是指由小分子单体相互发生反应生成高分子化合物的反应。
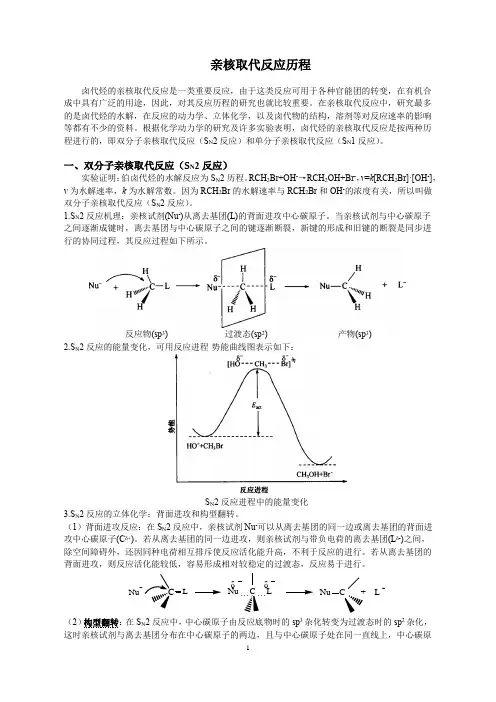
亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。

无机化学反应基本类型有化合反应,分解反应,复分解反应,置换反应四大类;有机化学反应类型有:取代反应(水解、酯化、缩合)、加成反应、消去反应、氧化反应、还原反应、聚合反应(加聚、缩聚)等6大类别.反应还可划分为氧化还原反应与非氧化还原反应.氧化还原反应中有化合价变化,非氧化还原反应中没有.有机中的氧化反应——(大多数有机物的燃烧),加氧或者去氢的反应;有机中的还原反应——去氢或者加氧的反应.取代反应和置换反应的比较:取代反应:(1)可与化合物发生反应,产物中不一定有单质.(2)反应能否进行受催化剂、温度、光照等外界条件影响较大.(3)逐步取代置换反应:(1)反应物、产物中一定有单质.(2)在水溶液中进行的置换反应应遵循金属或非金属活动性的顺序.(3)反应一般单向进行.取代反应:分子里某些原子或原子团被其它原子或原子团所替代的反应加成反应:有机分子里不饱和的碳原子与其它原子或原子团直接结合生成新的化合物的反应.消去反应:有机物从分子里脱去小分子而成为不饱和分子.酯化反应:酸和醇反应生成酯和水的反应水解反应:有机物和水作用生成两个或几个产物的反应氧化反应:有机物燃烧或得氧失氢的反应还原反应:失氧得氢的反应.(加氢反应为还原反应)加聚反应:由不饱和的单体聚合生成高分子化合物的反应.缩聚反应:由单体相互反应成高分子化合物同时还生成小分子.裂化反应:在一定条件下,把相对分子质量大,沸点高的长链烃断裂为相对分子质量小,沸点低的短链烃的反应.无机:化学反应可以分类为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应. 化合反应:由两种或两种以上的物质生成另一种物质的反应,叫做化合反应.A+B=C分解反应:由一种物质生成两种或两种以上的其它物质的化学反应,叫做分解反应.A=B+C 置换反应:一种单质与另一种化合物起反应生成另一种单质和化合物的反应叫置换反应.A+BC=AC +B复分解反应:两种化合物相互交换离子生成另外两种化合物的反应叫复分解反应.AB+CD=AD +CB。

“溴乙烷的取代反应和消去反应的实验探究”教学设计广州市玉岩中学喻亚琴一、教学内容主线分析(1)《普通高中化学课程标准(实验)》中对本单元的学习提出如下要求和活动探究建议:①认识卤代烃典型代表物的组成和结构特点。
②知道卤代烃与其他有机化合物之间的转化关系。
③根据有机化合物组成和结构的特点,认识消去反应。
④用化学方法(或红外光谱法)检验卤代烃中的卤素。
⑤调查与讨论:卤代烃在生产生活中的应用,以及对健康的危害。
(2)卤代烃在天然有机化合物中存在极少,自然界中存在的卤代烃几乎都来源于人工合成。
卤代烃是有机合成中的重要试剂,常用来提供碳正离子,而卤代烃与金属镁形成的格氏试剂又是常见的提供碳负离子的试剂,所以卤代烃在有机合成中占有极其重要的地位。
(3)卤代烃既是核心基础知识的直接体现,又是合成其他有机物的桥梁和纽带,研究卤代烃,能够帮助学生从整体上综合认识有机化学。
(4)消去反应使学生新接触到的一个反应类型,学好这个反应,就为醇的消去反应打好了基础,掌握消去反应对反应物的结构特点要求(只有连接卤原子的碳的邻碳上连接有氢原子),还有对消去的不同产物的判断。
(5)虽然卤代烃与烃类的结构差别不大,但是卤代烃的化学性质却与相应的烃的化学性质存在较大区别,这个事实可以让学生进一步加深对结构决定性质这一重要化学思想的认识。
通过对溴乙烷在氢氧化钠水溶液或氢氧化钠乙醇溶液两种不同条件下所发生反应的观察与思考,让学生学习卤代烃化学性质的同时,通过对比的方法认识有机化学的重要反应——消去反应。
在深刻思考相同反应物在不同反应条件下可发生不同反应的基础上,充分认识有机化学反应条件的重要性,从而引导学生全面把握有机化学反应规律。
二、学情分析由于在必修化学的学习阶段学生对具体的有机化合物(如甲烷、乙烯、苯、乙醇、乙醛、乙酸等)只是有了一些感性认识,在本模块第一章中学习了有机化合物的结构、分类、命名等一些概念,所以对某些较抽象或规律性的有机化学基本知识,如有机物中碳原子的成键特点、有机物结构的表示方法、同分异构体的识别等内容只是有所了解,并没有理解到位。
怎样分析判断有机反应的氧化还原性有机反应的氧化和还原,对于学生来说还是一个少于涉及因而有一些模糊的概念。
本文就以下几个问题谈谈自己的认识。
一,关于有机反应氧化还原的判断方法1,问题的提出:乙醇的脱水反应是去氢又去氧这是不是氧化还原反应?氯乙烷的消去反应是只去氢没去氧是不是氧化还原反应?已烷裂解成丙烷和丙烯没发生氢和氧的变化,是不是氧化还原反应?乙炔和氢氰酸加成是不是氧化还原反应?2,有机反应氧化还原的判断方法:通常是脱氢或者加氧是氧化反应,加氢或者脱氧是还原反应,按照这个方法有时去判断上述问题就会感到矛盾或发生错误,因此还是以化合价是否变化来判断更准确。
二,各类有机反应氧化还原的分析判断有机反应的分类法大同小异,一般分为取代反应、加成反应、消去反应、聚合反应、氧化还原反应。
本文是从化合价变化的角度把前四种类型中区分出哪些属于氧化还原反应,为什么。
(一),取代反应(1)卤化反应。
从整个反应来看,是属于有单质参加的反应,是氧化还原反应,仔细分析化合价变化:由C-H 键变为C-Cl键,碳的化合价由负变为正价,化合价上升了,是氧化还原反应。
(2)水解反应。
包括卤代烃的水解、酯的水解、油脂的水解(包括皂化反应)、二糖和多糖的水解、蛋白质的水解。
因为卤代烃的水解,由C-Cl键变为C-OH键,碳元素都显正价;酯的水解和油脂的水解酯R-CO-OR’’中的OR’’被水中的OH取代,碳元素都显正价;糖类的水解可以看成是一个加上水的加成反应,水中氢和氧的化合价前后都不变,则有机物的化合价也不变。
故所有有机物的水解反应都不是氧化还原反应;(3)酯化反应是水解反应的逆反应,故都不是氧化还原反应。
(4)硝化反应,因为是硝基-NO2取代了氢原子,化学键由C-H 变为C- NO2,碳元素由负价变为正价,故属于氧化反应,同理,磺化反应也是氧化反应(二),加成反应1,加卤素是氧化反应,加氢气是还原反应2,加化合物如加水、加卤化氢等不是氧化还原反应。
卤代烃学习目标1.卤代烃的定义、用途及危害并能对其正确命名及在有机合成中的应用。
2.卤代烃的水解反应、消去反应与醇的消去反应的异同。
3.设计实验验证卤代烃中卤原子种类及消去产物;4.正确书写醇消去反应方程式及产物验证。
重点难点重点:水解反应、消去反应;卤原子种类及消去产物的验证及在有机合成中的应用;难点:规范书写卤代烃的命名、方程式的书写及实验中防干扰思想;1.化学性质:(1)CH2BrCH2Br与NaOH水溶液反应方程式________________________________。
(2)为了检验溴乙烷中含有溴元素,对以下操作进行排序__________。
①加AgNO3溶液②加NaOH溶液③加热④加硝酸至溶液呈酸性Ⅰ④操作的目:_____________________Ⅱ此实验要控制水浴加热,其目:_______________________________。
水解反应完全的标志____________________。
(3)1,2-二溴乙烷的消去反应方程式____________________________________,选五42页图2-18中水的作用____________________。
Ⅱ思考:为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
以上三种分析是否合理,说明原因2.醇的消去反应:(1)2-甲基-2-丙醇消去反应方程式:________________________________________________ (2)实验室制备乙烯(选五51页)①:=3:1 烧瓶中溶液颜色变黑体现了浓硫酸的性。
专升本有机化学知识点与反应机制全解有机化学是化学学科中的一个重要分支,对于专升本的学生来说,掌握有机化学的知识点和反应机制至关重要。
本文将对专升本有机化学中的重要知识点和反应机制进行全面解析,帮助大家更好地理解和掌握这门学科。
一、有机化合物的结构1、碳原子的杂化轨道碳原子在形成有机化合物时,通常会发生杂化。
常见的杂化方式有sp³、sp²和 sp 杂化。
sp³杂化的碳原子形成四面体结构,如甲烷;sp²杂化的碳原子形成平面三角形结构,如乙烯;sp 杂化的碳原子形成直线结构,如乙炔。
2、共价键的类型有机化合物中的共价键包括单键、双键和三键。
单键通常是σ 键,双键由一个σ 键和一个π 键组成,三键则由一个σ 键和两个π 键构成。
π 键的稳定性相对较差,容易发生加成反应。
3、同分异构体同分异构体是指具有相同分子式但结构不同的化合物。
同分异构体分为构造异构体和立体异构体。
构造异构体包括碳链异构、官能团位置异构和官能团异构;立体异构体包括顺反异构和对映异构。
二、有机化合物的命名1、烷烃的命名烷烃的命名遵循“最长碳链、最多支链、最低系列”的原则。
首先选择最长的碳链作为主链,然后从靠近支链的一端开始编号,确定支链的位置和名称,最后将支链的名称和位置写在主链名称之前。
2、烯烃和炔烃的命名烯烃和炔烃的命名要先确定主链,使双键或三键的位置编号最小。
然后标明双键或三键的位置,并在名称中注明“烯”或“炔”字。
3、芳香烃的命名芳香烃通常以苯环为母体,根据取代基的位置和名称进行命名。
当苯环上有多个取代基时,要遵循“小基团优先”的原则进行编号。
三、有机化学反应类型1、加成反应加成反应是指不饱和键(双键或三键)与试剂发生反应,形成饱和键的过程。
常见的加成试剂有氢气、卤素、卤化氢等。
例如,乙烯与氢气加成生成乙烷,与溴水加成生成 1,2-二溴乙烷。
2、取代反应取代反应是指有机化合物中的某个原子或基团被其他原子或基团所取代的反应。
高考必记的重要的有机化学方程式一、烃1.甲烷▲烷烃通式:C n H 2n+2 (n ≥1) (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷(烷烃)不能使酸性高锰酸钾溶液、溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl (一氯甲烷呈气态,其余三种均为油状液体)二氯甲烷:CH3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯甲烷:CHCl 3+Cl 2CCl 4+HCl (CCl 4又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)2.乙烯乙烯的制取:CH3CH 2OH CH 2=CH 2↑+ H 2O (浓硫酸作催化剂、脱水剂)▲单烯烃通式:C n H 2n (n ≥2), 单环烷烃通式:C n H 2n (n ≥3) (1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 2 2CO 2+2H 2O 乙烯(烯烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:CH 2=CH 2 + H 2 CH 3CH 3与氯化氢加成:CH 2=CH 2+HCl CH 3CH 2Cl与水加成:CH 2=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n CH 2=CH nn CH 2=CH —CH=CH CH 2—CH=CH —CH 2 n3.乙炔 n 2n-2 2)乙炔的制取:CaC 2+2H 2O CH ≡CH ↑+ Ca (OH )2(1)氧化反应乙炔的燃烧:2CH ≡CH +5O 2 4CO 2+2H 2O乙炔(炔烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应 与溴水加成:CH ≡CH+Br 2 HC=CH 1,2—二溴乙烯BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2 1,1,2,2CH ≡CH+2Br 2 CHBr 2—CHBr 2与氢气加成:CH ≡CH+H 2 CH 2=CH 2CH ≡CH +2H 2 CH 3—CH 3与氯化氢加成:CH ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n CH ≡ n点燃光光光光浓硫酸170℃点燃Ni△催化剂加热、加压2-CH 2点燃Br 2—CHClCH=CHNi△Ni△ 图1 乙烯的制取图2 乙炔的制取4.苯▲苯及其苯的同系物通式:C n H2n-6 (n≥6)(1)氧化反应苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
【同步实验课】醇的取代、消去反应实验【实验目的】醇的取代、消去反应实验【实验原理】乙醇的取代反应:C2H5OH + HBr−−−→加热C2H5Br + H20。
乙醇的消去反应:C2H5OHo170C−−−→浓硫酸CH2=CH2↑ + H20。
【实验试剂】乙醇、浓硫酸、溴化钾、溴水、高锰酸钾溶液【实验装置】取样管、圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管、分液漏斗、碎瓷片【实验一】乙醇制取溴乙烷实验实验操作图解操作实验现象实验结论1.圆底烧瓶中加入10毫升水。
2.量取10毫升无水乙醇加入圆底烧瓶中。
3.量取20毫升浓硫酸在搅拌下将浓硫酸逐滴滴入烧瓶中,浓酸与水混合剧烈放热,因此一定要缓慢加入,否则会因局部过热而导致液滴飞溅或释放酸雾。
4.称取16克溴化钾在研钵中研磨成细颗粒状,在搅拌下分批加入研细的溴化钾固体混合完毕后,开启加热。
5.在加热及搅拌下进行反应,接收管的末端浸入亚硫酸钠溶液中,防止生1.加10mL水2.量10mL乙醇加入至圆底烧瓶3.量取20毫升浓硫酸在搅拌下逐滴滴入烧瓶中。
4.称16克KBr,研细,分批加入圆底烧瓶。
01实验梳理02实验点拨03典例分析04对点训练05真题感悟成的溴乙烷挥发并除去可能生成的溴单质。
6.一段时间后,观察现象。
7.生成的溴乙烷被蒸出进入到接收瓶内,观察现象。
8.将接收瓶内液体转移至分液漏斗中,放出下层产物。
9.使用饱和亚硫酸氢钠溶液、饱和碳酸氢钠溶液和浓硫酸依次清洗产物,并再次分液。
5.加热及搅拌下进行反应。
6.加热一段时间。
7.溴乙烷被蒸出进入接收瓶。
8.分液。
9.再次洗涤分液。
烧瓶内混合物变成黄色并有气泡冒出,说明反应已经开始。
溴乙烷密度大于水沉在锥形瓶底部下层为无色油状液体。
溴乙烷的密度小于浓硫酸,上层为溴乙烷。
【实验三】乙醇的消去反应制乙烯实验操作图解操作实验现象实验结论1.检验气密性。
在烧瓶里注入乙醇和浓硫酸(体积比1:3)的混合液约20mL(配置此混合液在冷却和搅拌下将15mL浓硫酸满满倒入5mL酒精中)。
有机化学基础知识点整理取代反应与消除反应的比较有机化学基础知识点整理——取代反应与消除反应的比较有机化学是化学中一个重要的分支,研究碳基化合物的结构、性质和反应。
在有机化学中,取代反应和消除反应是两个基本的反应类型。
本文将对这两种反应进行比较,来加深对它们的理解。
一、取代反应取代反应是有机化学中最基本和最常见的反应之一。
取代反应的定义是在有机化合物中一个或多个取代基被其他基团取代或替换的化学反应。
代表性的取代反应包括烷烃的卤代反应和醇的酸酯化反应等。
1.1 卤代反应卤代反应是取代反应中最典型的例子之一。
在卤代反应中,卤素(如溴或氯)取代了有机化合物中的一个或多个氢原子。
这种反应通常在光或热存在下进行,而且产物是一个含有卤素的有机化合物。
例如,甲烷和溴反应会生成溴甲烷。
1.2 酸酯化反应酸酯化反应是另一个重要的取代反应。
在酸酯化反应中,醇和酸反应生成酯。
这种反应通常需要酸性催化剂的存在,如硫酸等。
例如,乙醇和醋酸反应可以生成乙醋酸乙酯。
取代反应的特点是反应物中的一个基团被其他基团替代,化学键发生断裂和形成。
这种反应的反应机制和影响因素复杂,但常用于功能团的合成和有机化合物的改变。
二、消除反应相对于取代反应,消除反应在有机化学中使用较少,但仍然有一定重要性。
消除反应通常涉及有机化合物中的两个基团的去除,以形成双键或三键。
2.1 β-消除反应β-消除反应最常见于有机化合物中的官能团之间。
在这种反应中,有机化合物中的酸性氢原子被去除,从而使相邻碳原子上的一个或多个氢原子移除,形成双碳双键。
例如,乙烯基甲烷在碱存在下发生β-消除反应,生成乙烯。
2.2 酯酯、酮酮和炔烃的消除反应另一个常见的消除反应是酯酯、酮酮和炔烃的消除反应。
在这种反应中,有机化合物中的两个基团发生去除,从而形成双键或三键。
例如,环丙酮在高温下经过消除反应,生成丙炔。
消除反应的特点是反应物中两个基团的离开,使得化合物中的双键或三键形成。
这种反应对于有机合成中的环化反应和特定官能团的合成具有重要意义。