2020届高考二轮复习小专题大π键
- 格式:pdf
- 大小:1.73 MB
- 文档页数:17

人教版选修三物质结构与性质高考题中的大π键问题1、什么是大π键?在多原子分子中,如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π 键或共轭大π键2、形成大π键的条件是什么?大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键(1)这些原子都在同一平面上;(2)这些原子有相互平行的p轨道;(3)p轨道上的电子总数小于p轨道数的2倍3、如何表示大π键?π指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4如:43π,b≦a4、大π键表示为:b a(1)先计算粒子的总价电子数(m)(2)计算原子之间的δ键,一对δ键存在2个电子(n)(3)中心原子的孤对电子数(o)(4)外围原子的价层电子中的孤对电子数,如:O原子为2s、2p中各有1对,共4个电子(p)(5)大π键的电子,剩余电子,共有:b=m—n-o-pπ(6)表示:共有几个原子参加,则即有几个p轨道平行,数目为a,大π键表示为:b a5、举例说明例1、CO2中的大π键:分析:(1)CO2中C原子为sp杂化,两端的O原子可视为不杂化(2)C原子sp杂化轨道为两个能量相等的Px轨道,其中各含有1个成单电子;Py轴上有1个成单电子;Pz轴上也有1个成单电子(3)O原子2s2、2p轨道中其中一个轨道上面均为两个自旋相反的电子。
另两个P轨道上的成单电子分别与C原子的sp杂化轨道形成δ键和π键。
(4)第一套:y轴从左至右的电子数为:1、1、2,共4e-;第二套:z轴从左至右的电子数为:2、1、1,共4e-;均为三个P轨道,故CO2中存在两套Π34的大π键。
另计算如下:(中心原子C不存在孤对电子)(1)CO2中的价电子总数为4+6×2=16(2)C与O形成δ键的电子数为2×2=4 (C和O各拿出1个电子,共2组)(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8(4)形成大π键的电子,即为剩余电子,共有:16-4-8=4π(5)O、C、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为43例2、NO3—中的大π键:(中心原子N不存在孤对电子)(1)NO3—中的价电子总数为5+6×3+1=24(2)N与O形成δ键的电子数为3×2=6 (N和O各拿出1个电子,共3组)(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),3个O原子共有:4×3=12(4)形成大π键的电子,即为剩余电子,共有:24-6-12=6π(5)O、O、N、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为64例3、O3中的大π键:(中心原子O存在一对孤对电子)O3可以看成O·O2(1)O3中的价电子总数为6×3=18(2)中心O与另两个O原子形成δ键的电子数为2×2=4(3)中心O存在一对孤对电子(4)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8(5)形成大π键的电子,即为剩余电子,共有:18-4-2-8=4π(6)O、O、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为43提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去说明:如果能画出草图,则可更好地理解各个原子之间的成键情况。

基于高考试题中大π键问题的探究高考是一项重要的考试,对于每个参加的考生来说都是人生中的重要时刻。
高考试题中总会有一些难题,让考生们感到困惑和头疼。
其中一个比较常见的难题就是关于大π键的问题。
大π键是有机化学中的重要概念,理解这个概念对于理科生来说尤为重要。
本文将探究高考试题中关于大π键问题的解答方法和思路,帮助考生们更好地理解和应对这类问题。
让我们从大π键的基本概念开始。
大π键是指由一个σ键和一个π键组成的共价键,它是有机物中碳与碳之间最常见的键。
“大π键”称之为大,是因为通常情况下π键的力度比σ键要大,因此我们把这个共价键叫做大π键。
大π键的存在使得碳原子能够形成广泛的化学结构,从而构成了很多有机化合物。
在高考试题中,关于大π键的问题一般会以化学式或者分子结构为背景,要求考生们推导出相应的结构式或者性质。
考生们需要掌握大π键的构成和作用,能够根据题目中给出的信息进行分析和推理。
下面是三个典型问题的解答思路和方法。
第一个问题是化学式推导。
通常情况下,大π键的构成是可以根据给定的化学式进行推导的。
考生们需要根据题目中给出的元素符号和化学式,推导出相应的分子结构。
关于大π键的推导方法有很多,最常见的是根据电子数目和价电子对数量进行推导。
对于已知的化学式C2H6,根据碳原子和氢原子的价电子对数量,我们可以推导出这个分子是一个饱和烷烃,其中碳原子之间没有大π键。
第二个问题是性质预测。
大π键的存在对于有机化合物的性质有很大的影响,因此在高考试题中,常常会涉及到根据大π键的存在与否来预测化合物的性质。
对于一个已知的含有大π键的分子,我们可以预测它的化学活性较高,容易发生反应。
这是因为大π键的存在使得分子轻松地进行断裂和重组。
第三个问题是鉴别结构。
有时候高考试题中会给出一个化合物的结构式,要求考生们根据给定的结构式来推导出它的性质或者鉴别其他的结构。
这就需要考生们对大π键的构成和作用有更深入的理解。
通过观察结构式中的碳原子之间是否有共轭、环状结构以及π键的数量等特点,我们可以推断出分子的性质和结构。


基于高考试题中大π键问题的探究首先,我们需要了解什么是大π键。
大π键是一种共享电子对的键型,通常就是由一个饱和键和一个不饱和键组成。
在一个不饱和键中,由于某些原因,原子没有固定的双电子对附加到它的电子云中。
这就使得不饱和键具有了高反应性和较强的中间性质,可以和其他原子和分子形成共轭体系。
在高考试题中,我们通常会遇到以下几种大π键的问题:1. 大π键的位置和种类许多化学试题会考察化学物质的大π键位置和种类,要求考生根据化学式或者化学结构图给出答案。
例如,“判断以下四种材料中哪一个不含大π键?”或者“列举出以下化合物中所有的大π键位置”。
解决这类问题,最重要的是要熟悉各种化学物质的结构,特别是对于含有大π键的物质要多加注意。
考生可以使用手画结构图、标注结构等方法来帮助自己理解和记忆。
2. 大π键的性质和反应大π键的特殊性质常常被高考试题所考察,这些性质包括了大π键的稳定性、互相作用和反应等。
例如,“以下哪个原因能够解释为什么大π键比单键反应更快?”或者“对于一种含有大π键的化合物,它在发生加氢反应时会发生什么变化?”考生需要理解大π键的反应方式和性质,如电子云的形状和位置对反应的影响,还要掌握不同反应类型的机理。
对于一些比较抽象难懂的知识点,可以通过课堂笔记和网上资料等方式做深入理解。
大π键不仅在化学课程中有重要的地位,也在现实生活中有着广泛的应用。
在高考试题中,大π键常常和某些化学或生物过程联系起来,要求考生具有一定的应用推理能力。
例如“大π键在生物分子中有何作用?”或者“一些含有大π键的物质能够用于什么方面?”解决这些问题,考生需要通过对大π键的化学反应机理和结构特征的理解,联系实际应用场景进行思考,尝试提出具体措施和应用效果评估。
总之,掌握大π键理论、性质和应用对于成功应对高考试题有着重要的作用。
考生要深入理解这一概念,尝试练习各种类型的应用题目,对于掌握和掌握化学知识有很大的帮助。

1.大π键的定义:π66苯环中C采取sp 2杂化,每个碳原子有一个未参与杂化的p轨道,6个p轨道肩并肩重叠,每个碳原子有一未成对的p电子,形成了π66大π键.多个原子上有相互平行的P轨道,它们连贯地“肩平肩”地重叠在一起构成一个整体,p电子在这个整体内运动形成离域的化学键,称其为大π键。
表示方法: πm nm为形成大π键的原子数,一般为IIIA,IVA,VA,VIA,VIIA 族元素;n为大π键中的共用电子个数,且n < 2m3.大π键的形成条件:✧(1)所有参与形成离域π键的原子必须在同一直线或同一平面上。
所以中心原子只能采取sp2或sp杂化。
✧(2)参与离域π键的原子都必须提供一个或两个没有杂化的互相平行的p轨道。
✧(3) 形成离域π键的p电子的总数小于p轨道数的两倍。
1、数出有几个σ键注意:形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤电子对参与形成大π键3、数出形成大π键的电子总数(离子得失的电子数,计算在大π键的电子数内)2、画出第IVA、 VA、 VIA、VII族元素的电子式6个C的6个p轨道在苯环平面上下方相互重叠,6个电子在大π键内运动,形成先画出苯环里的6个C-C σ键和6个C-H σ键。
每个C原子补1个电子,使之满足4个价电子π66CH 2=CH-CH=CH 2 4个碳原子的4个p轨道,4个电子,形成了一个离域的 大 键π441,3-丁二烯中的碳原子取sp 2杂化,先画出所有的σ键,每个碳原子补一个电子,使之满足4个价电子π666个原子的6个p轨道在分子平面上下方相互重叠,6个电子在大π键内运动,形成先画出吡啶里的4个C-Cσ键和5个个C-Hσ键,以及2个C-Nσ键。
每个C原子补1个电子,使之满足4个价电子;N原子补3个电子,使之满足5个价电子。
HHHHHHHHHπ655个原子的5个p轨道在分子平面上下方相互重叠,6个电子在大π键内运动,形成先画出吡咯里的3个C-Cσ键和4个个C-Hσ键,以及2个C-Nσ键,1个N-Hσ键。

基于高考试题中大π键问题的探究高考是每个中国学生的一次重要考验,对于学生、家长以及老师来说都是一项重大事件。
高考试题的出现直接关系到考生的命运,而大π键问题作为化学中的一个重要知识点,也是高考化学题中的常见问题。
本文将从大π键的概念、性质和应用出发,探究高考试题中关于大π键的问题,帮助考生更好地理解和掌握这一知识点。
一、概念大π键是指含有多个π键的分子内键,其中π电子云重叠构成一个大的π键。
在有机化学中,大π键在分子中起到了重要的作用,可以影响分子的化学性质、反应活性等。
常见的大π键有双键、三键等,它们都由π电子云重叠构成。
二、性质1. 不饱和大π键的分子通常是不饱和的,因为其中含有多个π键,这些π键可以进行共轭作用,增加了不饱和度,使得分子更容易发生化学反应。
2. 反应活性高大π键的分子由于不饱和度高,其反应活性也较高。
π电子云重叠形成了一个大的π键,这种结构增加了分子的化学反应活性,使得其在化学反应中更容易发生加成、加成-消去等反应。
3. 极性大π键的分子中π电子云的分布不均匀,由于π电子云的重叠,使得共轭双键中的C-C键成为极性键,而三键中的C≡C键由于共轭作用而减弱了极性,因此大π键的分子也具有一定的极性。
三、应用1. 有机合成大π键在有机合成中有着广泛的应用,很多有机反应都是以大π键为基础的。
比如烯烃在加成反应中可以和卤代烃发生卤代反应、醇发生水合反应等,这些反应都是以烯烃中的π键参与的。
芳香族化合物中的苯环也是一个大π键,它可以发生氢代反应、取代反应等。
2. 生物活性很多天然产物中都含有大π键的分子结构,比如用于抗生素合成的苯环、双键等。
大π键的分子结构使得这些化合物具有较高的生物活性,从而成为医药领域中的重要药物。
四、高考试题中的大π键问题在高考化学试题中,大π键通常会涉及到有机化合物的性质、化学反应以及有机化合物的应用等方面。
常见的高考试题类型有:1. 确定化合物的结构通过化合物的性质、化学反应等信息,确定有机化合物的结构,包括确定有机化合物中是否含有大π键、大π键的位置和种类等。


大π键专练习20题(高中化学)带答案学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列有关说法正确的是A .咪唑为平面结构,结构为,形成的大π键可表示为55∏ B .34H AsO 、33H AsO 、32H AsO 三种酸中酸性最强的是34H AsOC .某含钛配合物,化学式为()225TiCl H O Cl ⎡⎤⎣⎦,1mol 该配合物中σ键的数目为A 18ND .3SrCO 和3CaCO 受热均可分解,且分解温度:33SrCO CaCO <2.下列说法中,正确的是A .芳香烃的分子通式是C n H 2n-6(n≥6)B .苯的同系物是分子中仅含有一个苯环的所有烃类化合物C .在苯的同系物分子中存在大π键,每个碳原子均采取sp 2杂化D .苯和甲苯都能与卤素单质、浓硝酸等发生取代反应3.有关苯的结构和性质,下列说法正确的是A .苯分子中碳碳键是单键和双键交替排列的B .易被酸性KMnO 4溶液氧化C .与溴水发生加成反应而使溴水褪色D .苯分子中存在大π键,碳原子采取sp 2杂化4.叶酸拮抗剂是一种多靶向性抗癌药物,常以苯和丁二酸酐为原料合成过程中,某一中间体(X)结构如右图所示:下列有关说法错误的是A .基态N 原子的核外电子空间运动状态有5种B .沸点:高于C .X 结构中,C 、N 原子杂化方式种数相同D .X 结构中含有66∏大π键 5.二茂铁()552Fe C H ⎡⎤⎣⎦分子是一种金属有机配合物,它的结构如图所示。
下列说法正确的是A .二茂铁中2Fe +与环戊二烯离子(C 5H 5-)之间为离子键B .1mol 环戊二烯()中含有σ键的数目为10N AC .环戊二烯离子(C 5H 5-)中的大π键可表示为65ΠD .Fe 是第ⅧB 的一种元素,属于d 区6.下列说法正确的是A .硫酸氢钠溶于水、加热至熔融态都破坏了离子键和共价键B .氯化氢气体溶于水破坏了离子键,金刚石熔化破坏了共价键C .冰→水→氢气和氧气依次破坏了氢键和范德华力,共价键D .利用微机械剥离石墨制得石墨烯破坏了共价键和大π键7.分子或离子中的大π键可表示为y x ∏,其中x 表示参与形成大π键原子总数,y 表示π电子数,已知π电子数=价电子总数-(σ电子对数+孤电子对数)×2。

基于高考试题中大π键问题的探究大π键是有机化学中常见的一种键型,由一个碳原子与另一个原子(通常是一个碳原子或氧、氮等元素)共用三个电子对形成。
大π键的存在对于有机化合物的结构、性质以及反应机理具有重要的影响。
在高考化学试题中,大π键的性质和应用是被广泛提及的,因此本文将基于高考试题,探讨大π键的相关问题。
一、大π键的稳定性和特性题目1:有机化合物中,双键和三键的键能分别为单键的多少倍?请解释其原因。
答案:双键的键能为单键的2倍左右,三键的键能为单键的3倍左右。
这是因为在双键和三键中,存在较强的双电子共价键和较弱的单电子非共价键(孤对电子),其中非共价键的能量较低,因此容易遭受攻击,从而破裂形成单键状态。
相比之下,单键所包含的所有电子对都是双电子共价键,稳定性较高,需要较大的能量才能破裂。
题目2:以下哪种有机化合物中,大π键的稳定性最高?A. 反式-2-丁烯C. 1,3-丁二烯答案:B。
顺式-2-丁烯的大π键稳定性最高,因为双键两侧的两个基团都是相似的甲基基团,能够相互靠近,形成稳定的形象吸引。
二、大π键的反应题目3:以下哪组化合物可以发生双醛反应?B. 焦磷酸和正丁烯C. 乙烯和氢氧化钠D. 丙烯和氢气答案:C。
双醛反应是指乙烯或二烯族化合物与氢氧化钠等亲电试剂作用,发生加合反应,生成β-羟醛(羟烯醇)化合物的反应。
这是因为乙烯和二烯族化合物中的双键具有电子云密度较高、亲电性较强的特点,容易对亲电试剂进行攻击而发生反应。
题目4:以下何种试剂可以将类苯酚中的双键直接加氢还原?B. 氢氧化钠-氢气答案:B。
类苯酚中的双键较为稳定,难以发生加成反应。
因此需要使用可以直接加氢还原的试剂,如氢气和氢氧化钠。
此时,双键负荷较高的碳原子上的π电子被氢离子进攻,形成碳正离子,然后再被氢分子的一个质子还原形成单键。
三、大π键的空间构象题目5:以下哪种化合物存在顺式构象?C. 烯丙基乙酮答案:D。
顺式-2,3-丁二烯存在顺式构象,即两个亚基团上的官能团都在同一侧的构象。
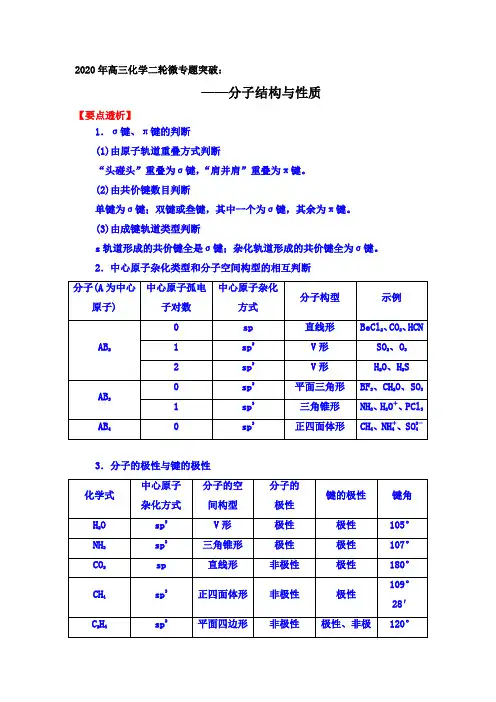
2020年高三化学二轮微专题突破:——分子结构与性质【要点透析】1.σ键、π键的判断(1)由原子轨道重叠方式判断“头碰头”重叠为σ键,“肩并肩”重叠为π键。
(2)由共价键数目判断单键为σ键;双键或叁键,其中一个为σ键,其余为π键。
(3)由成键轨道类型判断s轨道形成的共价键全是σ键;杂化轨道形成的共价键全为σ键。
2.中心原子杂化类型和分子空间构型的相互判断3.分子的极性与键的极性性C2H2sp 直线形非极性极性、非极性180°sp2平面六边形非极性极性、非极性120°BF3sp2平面三角形非极性极性120°BeCl2sp 直线形非极性极性180°4.范德华力、氢键、共价键的比较作用力范德华力氢键共价键作用粒子分子或原子(稀有气体) 氢原子与氟、氮、氧原子(分子内、分子间)原子特征无方向性、无饱和性有方向性、有饱和性有方向性、有饱和性强度比较共价键>氢键>范德华力影响强度的因素①随着分子极性和相对分子质量的增大而增大②组成和结构相似的物质,相对分子质量越大,范德华力越大对于A—H…B—,A、B的电负性越大,B原子的半径越小,氢键强度越大成键原子半径越小,键长越短,键能越大,共价键越稳定对物质性质的影响①影响物质的熔沸点、溶解度等物理性质②组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大①影响分子的稳定性,共价键键能越大,分子稳定性越强②影响原子晶体的熔沸点、硬度5.常见等电子体粒子通式 价电子总数 立体构型 CO 2、SCN -、NO +2、N -3 AX 2 16e - 直线形 CO 2-3、NO -3、SO 3AX 3 24e - 平面三角形SO 2、O 3、NO -2AX 2 18e - V 形 SO 2-4、PO 3-4 AX 4 32e - 正四面体形 PO 3-3、SO 2-3、ClO -3AX 3 26e - 三角锥形 CO 、N 2 AX 10e - 直线形 CH 4、NH +4AX 48e -正四面体形6.配位键和配合物 (1)配位键由一个原子提供一对电子与另一个接受电子的原子形成的共用电子对。

2020届高三化学选修三二轮专题复习——西格玛键和派键2020届届届届届届届届届届届届届届——届届届届届届届一、单选题(本大题共20小题,共40分)1.硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键),下列有关硝基胍的说法正确的是()A. 硝基胍分子中只含极性键,不含非极性键B. 硝基胍中有C、H、O、N四种元素,属于氨基酸C. 硝基胍分子中σ键与π键的个数比是5:1D. 10.4 g该物质含有11×6.02×1023个原子2.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。
下列说法正确的是()A. W、Y、Z的电负性大小顺序一定是Z>Y>WB. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>ZC. Y、Z形成的分子的空间构型可能是正四面体D. WY2分子中σ键与π键的数目之比是2∶13.大多数概念间存在如下三种关系,下列概念间关系判断正确的是()概念I概念II相互关系A共价分子共价化合物包含关系B分解反应吸热反应包含关系C非金属氧化物酸性氧化物相交关系D分散系胶体相离(并列)关系A. AB. BC. CD. D4.下列说法正确的是()1/ 20A. 硼酸[B(OH)3]分子,B原子与3个羟基相连,其键角为120o,则分子中B原子为sp杂化B. 在乙烯分子中有5个σ键和1个π键,它们分别是sp杂化轨道形成σ键,未杂化的2p轨道形成π键C. PCl3与BF3空间结构相似D. S2Cl2的电子式为5.下列说法不正确的是()A. 干冰升华和液氯气化时,都只需克服分子间作用力B. 硫酸氢钠晶体溶于水,需要克服离子键和共价键C. NH3和NCl3中,每个原子的最外层都具有8电子稳定结构D. 石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成6.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。
【基础知识】分子结构与性质考点四 大π键(离域π键)【必备知识】定义: 个及以上原子构成离子团或分子中,原子有彼此平行的未参与杂化的 轨道电子连贯重叠在一起,构成π型化学键,又称离域或共轭大π键。
条件:①原子在同一平面或直线;②中心原子 或 杂化(若提供d 轨道则中心原子应为sp 3d 杂化)。
表示:πn m (m :参与形成大π键的原子数;n :参与形成大π键的电子数,n<2m ) 分析方法——图示法分析步骤:①判断出中心原子杂化方式,并画出σ键。
②未成对电子优先形成大π键。
例:用图示法表示下列物质的大π键物质图示解析所有C 原子均采取 杂化,1、4号C 原子的两个sp 2杂化轨道分别与H 原子的1s 轨道成键,一个sp 2杂化轨道与2、3号C 原子的sp 2杂化轨道成键,这样4个C 原子具有一个含一个孤电子的未参与杂化的2p 轨道,它们是相互平行的,形成 。
中心原子C 采取 杂化,6个C 原子具有一个含一个孤电子的未参与杂化的2p 轨道,它们是相互平行的,形成 。
CO 32-中心C 原子采取 杂化,周围三个O 原子的未成对电子的2pz 轨道优先参与形成Π键,各提供一个2p 电子,再加上得到两个电子,即 。
CO 2 C OO C OC OO中心C 原子采取 杂化,两个sp 杂化轨道与O 原子的2p 轨道成键,剩余的未参与杂化的有两个含1个孤电子的2p 轨道(2py 、2pz ),O 原子也有暂未成键的两个2p 轨道对称性与其一致,故而可在y 方向上和z 方向上均形成一个 。
例、用图示法表示下列物质的大π键物质图示表示物质图示表示SO2NO2-BF3NO3-SO3ClO2其他分析方法:①Π电子总数计算:n=价电子数-σ键电子总数-孤对电子总数=价电子总数- 杂化轨道数目×2- 孤电子对数×2②等电子体:如3原子16电子微粒CO2、CS2、N2O、COS、N-、SCN-,有两套Π43;3原子18电子微粒SO2、O3、NO2-,有Π43;4原子24电子微粒SO3、BF3、NO3-、CO32-,有Π64。
如何判断分子或离子中的大π键1、什么是大π键?在多原子分子中,如有相互平行的p 轨道,它们连贯重叠在一起构成一个整体,p 电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π 键或共轭大π键2、形成大π键的条件是什么?大π键是3 个或3 个以上原子彼此平行的p 轨道从侧面相互重叠形成的π键(1)这些原子都在同一平面上;(2)这些原子有相互平行的p 轨道;(3)p 轨道上的电子总数小于p 轨道数的2 倍3、如何表示大π键?如:34 指平行于p 轨道的数目有 3 个(一般粒子有几个原子,就是几个p 轨道),平行p 轨道里的电子数为44、大π键表示为:a b ,b≦a(1)先计算粒子的总价电子数(m)(2)计算原子之间的δ键,一对δ键存在2 个电子(n)(3)中心原子的孤对电子数(o)(4)外围原子的价层电子中的孤对电子数,如:O 原子为2s、2p 中各有1 对,共4 个电子(p)(5)大π键的电子,剩余电子,共有:b=m—n-o-p(6)表示:共有几个原子参加,则即有几个p 轨道平行,数目为a,大π键表示为:a b5、举例说明例1、CO2中的大π键:分析:(1)CO2中 C 原子为sp 杂化,两端的O 原子可视为不杂化(2) C 原子sp 杂化轨道为两个能量相等的Px 轨道,其中各含有1 个成单电子;Py 轴上有1 个成单电子;Pz 轴上也有1 个成单电子(3)O 原子2s2、2p 轨道中其中一个轨道上面均为两个自旋相反的电子。
另两个P 轨道上的成单电子分别与 C 原子的sp 杂化轨道形成δ键和π键。
(4)第一套:y 轴从左至右的电子数为:1、1、2,共4e-;第二套:z 轴从左至右的电子数为:2、1、1,共4e-;均为三个P 轨道,故CO2中存在两套Π34的大π键。
另计算如下:(中心原子 C 不存在孤对电子)(1)CO2中的价电子总数为4+6×2=16(2)C 与O 形成δ键的电子数为2×2=4(C 和O 各拿出1 个电子,共2 组)(3)成对电子O 原子中:2s、2p 中有一个轨道中存在一对孤对电子(共4 个),2 个O 原子共有:4×2=8(4)形成大π键的电子,即为剩余电子,共有:16-4-8=4(5)O、C、O 原子的每个原子的某一p 轨道中共有4 个电子可共享,即大π键为34例2、NO3—中的大π键:(中心原子N 不存在孤对电子)(1)NO3—中的价电子总数为5+6×3+1=24(2)N 与O 形成δ键的电子数为3×2=6(N 和O 各拿出1 个电子,共3 组)(3)成对电子O 原子中:2s、2p 中有一个轨道中存在一对孤对电子(共4 个),3 个O 原子共有:4×3=12(4)形成大π键的电子,即为剩余电子,共有:24-6-12=6(5)O、O、N、O 原子的每个原子的某一p 轨道中共有4 个电子可共享,即大π键为46例3、O3中的大π键:(中心原子O 存在一对孤对电子)O3可以看成O·O2(1)O3中的价电子总数为6×3=18(2)中心O 与另两个O 原子形成δ键的电子数为2×2=4(3)中心O 存在一对孤对电子(4)成对电子O 原子中:2s、2p 中有一个轨道中存在一对孤对电子(共4 个),2 个O 原子共有:4×2=8(5)形成大π键的电子,即为剩余电子,共有:18-4-2-8=4(6)O、O、O 原子的每个原子的某一p 轨道中共有4 个电子可共享,即大π键为34提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去说明:如果能画出草图,则可更好地理解各个原子之间的成键情况。
共价键的类型按成键方式可分为σ键和π键。
大π键作为π键概念的延伸与拓展,常见于信息题中。
由三个或三个以上的原子形成的π键,在多原子分子或离子中,如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键或共轭大π键,简称大π键,大π键具有特殊的稳定性。
一、共价键的分类按电子对是否偏移分为:极性共价键和非极性共价键。
按照共用电子对的数目分为:单键,双键,叁键按照电子云的重叠方式:σ键和Π键二、定域和离域定域键:我们学过的键和Π键通常可以被成为定域键,因为这些价电子活动范围局限在两个原子间。
但是有些化合物或离子中的电子不仅仅局限于两个原子之间,而是在参加成键的多个原子形成的分子或离子骨架中运动,这种化学键被称为离域键。
如果这些电子来自p轨道,则这些电子所形成的是Π键。
三、什么是离域π键1、在一个平面形的多原子分子中,如果相邻原子有垂直于分子平面的、对称性一致的、未参与杂化轨道的原子轨道,那么这些轨道可以相互重叠,形成多中心π键。
这种多中心π键又称为“共轭π键”或“离城π键”,简称“大π键”。
2、大Π键的形成条件(1)所有参与离城π键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取sp或sp2杂化;(2)所有参与离域键的原子都必须提供个成两个相互平行的p 轨道;(3)根据泡利不相容原理,参与离城π键的P轨道上的电子数必须小于2倍的P轨道数。
3、大Π键对分子性质有一定的影响。
(1)使分子稳定性增加苯有离域π键,苯的离域π键表示为π66。
它平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的,既不是单键,也不是双键。
使苯环具有特殊的稳定性,这是与烯烃不同的。
所以苯的化学性质显现为芳香烃的性质,不易发生加成和氧化反应,易发生取代反应。
再如BF3中π46,因而能稳定单独存在,但与其化学式相似的AlCl3,由于AI的原子半径较大,不容易形成大π键,故气态般以双聚体 Al2Cl6形成存在。
基于高考试题中大π键问题的探究高考是中国教育体系中的重要组成部分,也是衡量学生学业水平的一项关键指标。
大π键问题是高考中一个常见的难点题型,考察了学生对分子结构和化学键的理解。
本文将从分子结构、化学键的概念和意义以及大π键的形成条件等方面对大π键问题进行探究。
我们来了解一下分子结构和化学键的概念。
在化学中,分子是由原子通过化学键连接在一起的粒子。
分子结构描述了分子中各个原子的相对位置和空间排布关系。
化学键是两个或多个原子通过共享电子而形成的连接,它能够稳定地将原子结合在一起。
大π键是一种重要的化学键类型,它由两个碳原子之间的相互重叠的2p轨道上的π电子形成。
π电子是位于原子外层的价电子,它们参与共享形成分子的化学键。
大π键具有很高的反应活性和化学稳定性,对于有机化学、有机合成以及聚合反应等领域具有重要意义。
大π键的形成条件主要有两个方面:一是原子的轨道杂化,二是大π键的轨道重叠。
在化学键形成过程中,碳原子通过轨道杂化将一个2s轨道和三个2p轨道杂化为四个等能量的sp3杂化轨道,从而提供了形成σ键的可能。
而π键形成则涉及到两个碳原子之间π电子的重叠,即碳原子上的2pπ轨道重叠形成共价键。
大π键的形成除了对碳原子有着重要的影响外,还对有机化合物的性质和反应起着决定性的作用。
大π键的存在使得化合物分子呈现出较强的反应活性,容易发生加成、消去等反应。
大π键的存在还使得有机化合物具有较高的热稳定性,对化学物质的热和电导率等物理性质也有一定的影响。
在高考试题中,大π键问题常常以化学方程式或分子结构的形式出现。
学生需要通过分析分子结构、了解化学键类型以及大π键形成的条件等知识,来判断大π键是否存在,以及对反应的影响。
解答这类问题需要学生对相关的概念和原理有清楚的理解,并具备一定的推理和分析能力。
大π键问题是高考中的一类难点题型,需要学生对分子结构和化学键的概念以及大π键的形成条件有着深入的理解。
掌握这些知识不仅可以帮助学生解答试题,更可以帮助他们理解有机化合物的性质和反应机理,为将来的学习和科研打下坚实的基础。
微专题大派键1.铁触媒是重要的催化剂,co易与铁触媒作用导致其失去催化活性:硝酸钾中NO3-的空间构型 ____________ ,分子中的大7T键可用符号兀盟表示,其中m代表参与形成的大7T键原子数,"代表参与形成的大7T键电子数(如苯分子中的大冗键可表示为应),则NO3冲的大兀键应表示为_________________ O2.根据要求回答下列问题:与BF3互为等电子体的分子和离子分别为___________________ (各举1例);已知分子中的大7T键可用符号II箫表示,其中m代表参与形成大n键的原子数,n代表参与形成大兀键的电子数(如苯分子中的大冗键可表示为II :),则BF3中的大n键应表示为_______________________ o3.《日华子本草》中已有关于雄黄的记载“雄黄,通赤亮者为上,验之可以虫死者为真。
”雄黄(AS4S4)和雌黄(A S2S3)是提取碑的主要矿物原料,二者在自然界中共生。
回答下列问题:SO2分子中的o键数为 _____ 个,分子的空间构型为____________ o分子中的大兀键可用符号兀;表示,其中m代表参与形成大兀键的原子数,n代表参与形成大兀键的电子数(如苯分子中的大兀键可表示为兀:),则SO2中的大兀键应表示为____________ 。
SO?分子中S—O键的键角 _____ NO3「中N—O键的键角(填“〉”、“<”、“=”)。
4.我国科学家最近成功合成了世界上首个五氮阴离子盐(^5)6(H3O)3(AW4)4CZ (用R代表).回答下列问题:R 中阴离子N;中的b键总数为_________ 个.分子中的大兀键可用符号口;;,表示,其中m代表参与形成的大兀键原子数,"代表参与形成的大兀键电子数(如苯分子中的大龙键可表示为H:),则N,中的大兀键应表示为______________________ 。
5.我国是世界上最早制得和使用铜、锌的国家,铜、锌及其化合物在日生产和生活中有着广泛的应用。
2020届高三化学选修三二轮专题复习——西格玛键和派键2020届届届届届届届届届届届届届届——届届届届届届届一、单选题(本大题共20小题,共40分)1.硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键),下列有关硝基胍的说法正确的是()A. 硝基胍分子中只含极性键,不含非极性键B. 硝基胍中有C、H、O、N四种元素,属于氨基酸C. 硝基胍分子中σ键与π键的个数比是5:1D. 10.4 g该物质含有11×6.02×1023个原子2.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。
下列说法正确的是()A. W、Y、Z的电负性大小顺序一定是Z>Y>WB. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>ZC. Y、Z形成的分子的空间构型可能是正四面体D. WY2分子中σ键与π键的数目之比是2∶13.大多数概念间存在如下三种关系,下列概念间关系判断正确的是()概念I概念II相互关系A共价分子共价化合物包含关系B分解反应吸热反应包含关系C非金属氧化物酸性氧化物相交关系D分散系胶体相离(并列)关系A. AB. BC. CD. D4.下列说法正确的是()1/ 20A. 硼酸[B(OH)3]分子,B原子与3个羟基相连,其键角为120o,则分子中B原子为sp杂化B. 在乙烯分子中有5个σ键和1个π键,它们分别是sp杂化轨道形成σ键,未杂化的2p轨道形成π键C. PCl3与BF3空间结构相似D. S2Cl2的电子式为5.下列说法不正确的是()A. 干冰升华和液氯气化时,都只需克服分子间作用力B. 硫酸氢钠晶体溶于水,需要克服离子键和共价键C. NH3和NCl3中,每个原子的最外层都具有8电子稳定结构D. 石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成6.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。