细胞因子释放综合征评估和管理共40页
- 格式:ppt
- 大小:4.76 MB
- 文档页数:40

SIRS量化评分----基层麻醉管理的评价指标史计月.作者单位:056029 邯郸市,河北工程大学附属医院麻醉科2001年首届亚州麻醉质量控制学术研讨会上上海瑞瑞金医院麻醉科于布为教授首次提出“理想麻醉状态”,即手术麻醉后机体建立的一种新的稳态。
其主要内容包括:①脑电双频谱分析(BIS)<50或听觉诱发电位<20,以确保术中无知晓,术后无记忆;②心率变异指数(HRV)30~40,交感抑制适度;③心率(HR)50~80次/分钟,以保证心肌负荷适度,氧供平衡;④ST分析<±0.2mV;⑤动脉血压12~15/8~11kPa(90~110/60~80mmHg),正常且有>4 kPa(30 mmHg)的脉压。
⑥容积脉搏图波形(Pleth)波形宽大、振幅高、无随机械呼吸周期出现的波动,反映交感神经紧张度、末梢灌注、组织器官灌注和有效循环血量。
此概念及相关指标综合了当今麻醉深度监测与麻醉目标管理的核心理论与技术。
然而,此概念所涉及的指标在当前经济水平下,国内相当多的基层医院(二甲及以下级别医院)尚不具有推广应用相关设备的条件,即使非教学科研为主的三级医院日常临床麻醉中也未必普遍应用。
因而,相当多的麻醉科医师称之为真正的“理想麻醉状态”。
然而,当今临床麻醉目标化管理是必然趋势,“理想麻醉状态”可望不可及;传统“通用临床麻醉深度判断标准”缺乏必要的数据化指标,加之肌松剂的应用相关指标已经无实际意义。
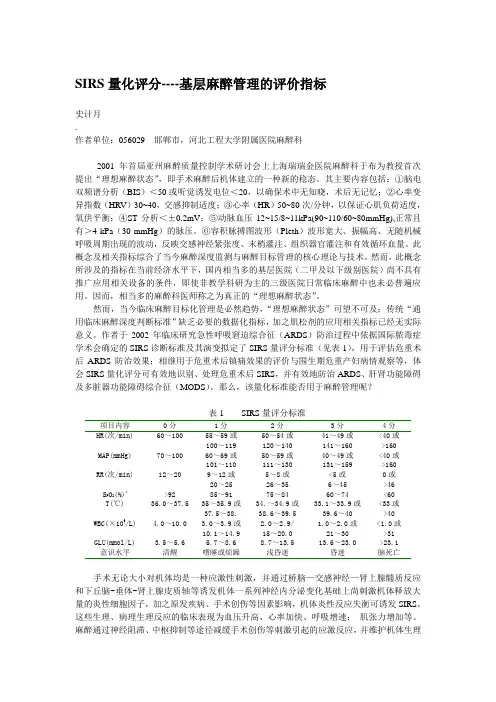
作者于2002年临床研究急性呼吸窘迫综合征(ARDS)防治过程中依据国际脓毒症学术会确定的SIRS诊断标准及其演变拟定了SIRS量评分标准(见表1),用于评估危重术后ARDS防治效果;相继用于危重术后镇痛效果的评价与围生期危重产妇病情观察等,体会SIRS量化评分可有效地识别、处理危重术后SIRS,并有效地防治ARDS、肝肾功能障碍及多脏器功能障碍综合征(MODS)。
那么,该量化标准能否用于麻醉管理呢?表1 SIRS量评分标准项目内容0分1分2分3分4分HR(次/min)MAP(mmHg) RR(次/min)S P O2(%)*T(℃) WBC(×109/L)GLU(mmol/L) 意识水平60~10070~10012~20>9236.0~37.54.0~10.03.5~5.6清醒55~59或100~11960~69或101~1109~12或20~2585~9135~35.9或37.5~38.3.0~3.9或10.1~14.95.7~8.6嗜睡或烦躁50~54或120~14050~59或111~1305~8或26~3575~8434.~34.9或38.6~39.52.0~2.9/15~20.08.7~13.5浅昏迷41~49或141~16040~49或131~159<5或6~4560~7433.1~33.9或39.6~401.0~2.0或21~3013.6~23.0昏迷<40或>160<40或>1600或>46<60<33或>40<1.0或>31>23.1脑死亡手术无论大小对机体均是一种应激性刺激,并通过桥脑—交感神经—肾上腺髓质反应和下丘脑-垂体-肾上腺皮质轴等诱发机体一系列神经内分泌变化基础上尚刺激机体释放大量的炎性细胞因子,加之原发疾病、手术创伤等因素影响,机体炎性反应失衡可诱发SIRS。

西部医学2019年10月第31卷第10期Med J West China,October2019,Vol.31,No.10・1477・•专家述评・细胞因子释放综合征的发病机制及诊断分级与处理方案*何爱丽贾亚春(西安交通大学第二附属医院血液内科,陕西西安710004)【摘要】嵌合抗原受体T细胞治疗(CAR-T)作为近年来肿瘤治疗的新方法,在血液肿瘤中取得了令人惊喜的结果。
细胞因子释放综合征(CRS)是免疫治疗,尤其是CAR-T治疗的一种最常见不良反应,临床症状多样、发生率高,严重者可造成多器官功能衰竭甚至危及患者生命。
CRS的发病机制目前仍不清楚,其发生及严重程度与细胞因子如白细胞介素-6等升高、血管内皮激活相关。
及早诊断及治疗CRS具有重要的临床意义。
托珠单抗及糖皮质激素是目前控制CRS的主要药物,合适时机应用是控制CRS的关键。
【关键词】免疫治疗;嵌合抗原受体T细胞;细胞因子释放综合征【中图分类号】R730.51【文献标志码】A doi:10.3969/j.issn.1672-3511.2019.10.001Progress of cytokine release syndromeHE Ai】i,JIA Yachun{Department of Hematology»The Second Affiliated Hospital of Xi'an J iaotong University»Xian710004,China}(Abstract]Antigen receptor T cells(CAR-T)has achieved surprising results in tumor therapy especially in hematological malignant diseases.Cytokine release syndrome(CRS)is one of the most common adverse reactions of CAR-T.The clinical symptoms of CRS are various and the incidence is high.Severe cases can cause multiple organ failure and even endanger the lives of patients.The pathogenesis of CRS is still unclear.The occurrence and severity of CRS are related to the elevation of cytokines such as IL-6.Early diagnosis and management is very important.Tocilizumab and glucocorticoid are used to control CRS at present.It is crucial to use drugs at the appropriate time.[Key words!Immunotherapy;Chimeric antigen receptor T-cell Immunotherapy;Cytokine release syndrome2013年,肿瘤免疫治疗被《科学》杂志评为突破性研究进展第一位⑴。

细胞因子风暴造成细胞坏死的机制-概述说明以及解释1.引言1.1 概述细胞因子风暴是一种免疫系统过度激活的病理状态,在某些疾病中常常出现。
它是一种细胞因子的异常释放和异常反应导致的炎症反应,进而造成细胞坏死的过程。
细胞因子是一类由免疫细胞产生的蛋白质,具有调节免疫反应和细胞通信的功能。
然而,在一些情况下,细胞因子的过度释放会导致细胞氧化应激、炎症反应和细胞损伤。
细胞因子风暴引起细胞坏死的机制并不完全清楚,但已有一些重要的发现。
首先,细胞因子的过度释放会导致免疫系统中多种细胞类型的活化,包括单核细胞、巨噬细胞和淋巴细胞。
这些活化的细胞会产生更多的细胞因子,形成一个正反馈的反应环路,进一步增加细胞因子的释放和细胞坏死的可能性。
其次,细胞因子风暴会导致细胞内和细胞外的损伤信号的累积。
这些信号包括氧化应激、线粒体损伤和受体激活等。
氧化应激会导致细胞内产生过多的活性氧自由基,进一步损伤细胞结构和功能。
线粒体损伤会导致线粒体膜的破裂和线粒体呼吸链功能的丧失,从而导致细胞能量代谢的紊乱。
受体激活则会触发细胞内多种信号转导通路,加剧细胞损伤和坏死的过程。
此外,细胞因子风暴还会导致免疫系统中其他免疫细胞的异常激活和功能降低。
例如,细胞因子的过度释放会抑制淋巴细胞的增殖和功能,降低机体对病原体的免疫反应能力。
这可能进一步导致细胞的坏死和病情的恶化。
总的来说,细胞因子风暴引起细胞坏死的机制是一个复杂而多方面的过程。
它涉及免疫细胞的异常激活与细胞因子的过度释放,细胞内和细胞外损伤信号的累积,以及免疫系统的功能异常。
对于细胞因子风暴造成细胞坏死的机制的深入研究,有助于我们更好地了解和干预相关疾病的发展过程,为未来的治疗提供新的策略。
1.2 文章结构文章结构部分的内容可以如下所示:文章结构部分的主要目的是向读者介绍文章的整体组织和布局,使读者能够清楚地了解文章的框架和内容安排。
本篇文章的结构如下:第一部分是引言部分,包含概述、文章结构和目的。

在A型血友病FVIII免疫应答:关于风险因素的概述堪机阿卡沙.戈什及.朽迈提.的蒂线上发表于2009年1月17日2009年Humana公司新闻抽象发展的抑制剂也许是最严重的并发症,凝血因子VIII (FVIII)更换治疗几乎可以排除高效的临床A型血友病患者的很大努力的管理。
因此,我们一直专注于改善FVIII抗体的形成的原因并找到替代的治疗方法。
几个患者相关因素已涉及到的风险抑制剂的发展,如种族,FVIII基因突变类型,家族病史的抑制剂,HLA单倍型,IL10基因的启动子区域的多态性,肿瘤坏死因子的单核苷酸多态性的α基因,等等。
除了遗传决定因素,有几个非遗传因素主要包括治疗喜欢的类型和特点用于治疗凝血因子浓缩物的纯度,在初始治疗时的年龄,初始剂量精矿,模式输液,手术,给药频率之前抑制剂的发展,和强度的治疗或定期预防。
在早期的炎症过程中童年是正在讨论的环境因素,以及免疫应答抗原、无法改变的遗传风险和环境因素可能增加或减少的抑制剂在个别病人的风险。
此外,还有其他的影响FVIII抑制剂的发展因素,例如压力原因,年龄,恶性肿瘤,感染,妊娠,抗生素等。
在这种情况下,抑制剂发生在没有血友病的和正常血浆的FVIII水平。
收购抑制剂的FVIII nonhemophiliacs(抗体)造成进一步的挑战治疗,这往往伴有显着发病率和死亡率。
预后的情况下,自身抗体有关的潜在的疾病过程和被与高死亡率。
为了更好地了解这些复杂的相互作用可能导致的发展预防措施,以尽量减少抑制物的形成。
可改变的危险因素的抑制因子形成提供预测的关键,也许是防止在血友病患者中形成的抑制剂。
关键词:FVIII抑制因子A型血友病MHC单倍型预防措施获得性血友病介绍抗体中和的促凝血功能FVIII,被称为抑制剂,在血友病中仍然可能是最严重的并发症的凝血因子替代疗法【1】。
这些患者中的各种出血发作的频率和出血量的几倍升级使管理变得极其困难【2】。
显然,该抑制剂是治疗因患病率的增加而增加FVIII血友病患者的治疗强度浓缩物和重组FVIII在诱导这些患者的常规治疗方案。

CAR-T细胞因子释放综合症的诊断和处置近年来肿瘤免疫治疗领域的新技术发展迅速,嵌合抗原受体(chimeric antigen receptors)T细胞(CAR-T)介导的免疫治疗,对与B淋巴细胞白血病和淋巴瘤患者的临床疗效取得了突破性进展,使得许多晚期的,复发性和难治性患者,重新获得完全缓解。
在CAR-T这种新型免疫治疗的部分病例中,可能出现一类特殊的临床综合症,这种综合症的发生,常表现有发热,低血压,缺氧,以及出现与血清中某些细胞因子水平显着升高有关的神经系统症状。
上述一系列临床表现和实验室检查点改变被称为细胞因子释放综合症(Cytokine Release Syndrome,CRS)。
目前,这种CRS现象的生物学性质大多尚未明确定义。
广告novoprotein病毒转导增强剂: NovoNectin (FN)总结具有临床表现的CRS或重症CRS的诊断指标,主要包括:发热;特征性细胞因子升高;和临床毒性的存在(表1)。
并发CRS患者的典型发烧,通常在回输CAR-T细胞后约24小时开始并且可以持续数天。
然而,发烧并不总能够预示临床发生相关毒性的多少,严重程度和发病趋势。
已有的临床观察发现,至少7个细胞因子水平在血清中的增高与患者发生CRS具有明确的相关性,这些细胞因子是:IFN-γ (干扰素-γ),Fracktalkine (分形趋化因子),GM-CSF (粒-巨噬细胞生长因子),IL-5(白细胞介素-5),IL-6 (白细胞介素-6),Flt-3L (人FMS样酪氨酸激酶3配体)和IL-10 (白细胞介素-10)。
7种细胞因子在需要治疗的重症CRS患者中,至少有2项比治疗前基线水平增高75倍。
重症CRS患者都出现了至少一个下述临床表现:缺氧,低血压,和/或神经系统的异常改变因此,结合临床和实验室数据,可以根据以下3项指标来确诊患者CRS的发生: 1. 持续发烧超过3天(~38 C°); 2. 选择性细胞因子升高; 3. 伴有临床毒性反应的证据。


《人工肝血液净化系统治疗细胞因子风暴综合征专家共识》(2024)要点1 CSS定义CSS是一种由感染、肿瘤和自身免疫性疾病等病因引起的免疫反应失控的临床综合征。
其主要特征是血浆中细胞因子水平明显升高,并导致发热、全身多个系统或脏器出现炎症反应及功能损害。
2 CSS发生机制免疫网络中的细胞因子作用十分复杂,呈现交叉式的网络作用特点,既可促进局部组织的炎症反应,也可调节免疫细胞的活化和增殖,从而影响感染的清除和组织修复过程。
当这一网络失去控制时,可出现CSS。
干扰素γ(IFNγ)、IL-1、IL-6、肿瘤坏死因子(TNF)和IL-18是在CS中水平显著升高的关键细胞因子。
这些细胞因子在免疫反应中扮演着重要的角色,并且被认为是导致CS的核心免疫病理学因素之一。
2.1 引发血管和组织的通透性增加2.2 激活凝血系统阻碍微循环2.3 诱导炎症介质加重组织损伤2.4 免疫抑制导致多脏器衰竭综上所述,CSS对机体产生的损害是多途径的,并可能导致严重的多脏器衰竭。
3 CSS的病因3.1 病原微生物诱发CSS原发病原微生物感染可诱发CSS。
3.2 免疫和肿瘤及治疗相关的CSS、CRS免疫和肿瘤及治疗相关的CSS、CRS继发于各类风湿免疫性疾病,如类风湿性关节炎、成人Still病等,出现巨噬细胞活化综合征(MAS),最终诱导CSS和多脏器衰竭。
3.3 手术和创伤相关的CSS、CRS外科手术,如心脏搭桥术和脾脏切除术,缺血再灌注损伤等,也可能诱发CSS和CRS。
4 人工肝治疗CSS适应证同时具有以下3项的患者:(1)急性发热起病,病程多在发病1周内(一般不超过2周,血细胞因子水平持续升高者可视情况而定);(2)具有脏器功能急性损害、障碍表现者;(3)血清IL-6水平≥5×正常值上限(ULN),或每日上升速度≥1×ULN伴或不伴有其他细胞因子如IL-1、IL-2、IL-4、IL-10、TNF-α和IFNγ等升高。
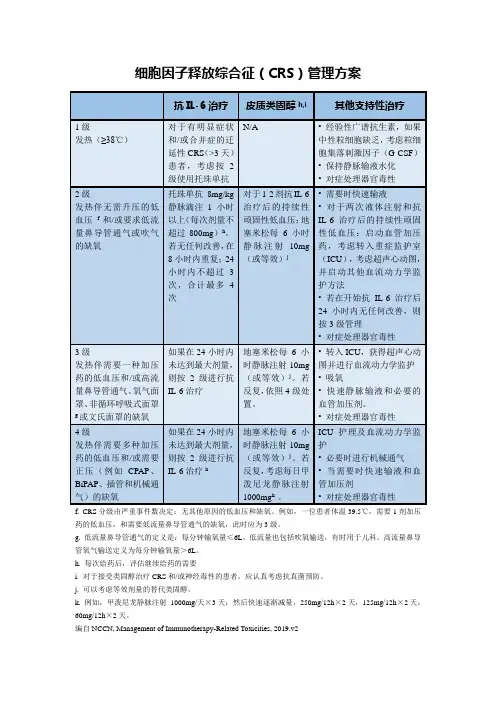
细胞因子释放综合征(CRS)管理方案抗IL-6治疗皮质类固醇h,i其他支持性治疗1级发热(≥38℃)对于有明显症状和/或合并症的迁延性CRS(>3天)患者,考虑按2级使用托珠单抗N/A • 经验性广谱抗生素,如果中性粒细胞缺乏,考虑粒细胞集落刺激因子(G-CSF)• 保持静脉输液水化• 对症处理器官毒性2级发热伴无需升压的低血压f和/或要求低流量鼻导管通气或吹气的缺氧托珠单抗8mg/kg静脉滴注1小时以上(每次剂量不超过800mg)h。
若无任何改善,在8小时内重复;24小时内不超过3次,合计最多4次对于1-2剂抗IL-6治疗后的持续性顽固性低血压:地塞米松每6小时静脉注射10mg(或等效)j• 需要时快速输液• 对于两次液体注射和抗IL-6治疗后的持续性顽固性低血压:启动血管加压药,考虑转入重症监护室(ICU),考虑超声心动图,并启动其他血流动力学监护方法• 若在开始抗IL-6治疗后24小时内无任何改善,则按3级管理• 对症处理器官毒性3级发热伴需要一种加压药的低血压和/或高流量鼻导管通气、氧气面罩、非循环呼吸式面罩g或文氏面罩的缺氧如果在24小时内未达到最大剂量,则按2级进行抗IL-6治疗地塞米松每6小时静脉注射10mg(或等效)j。
若反复,依照4级处置。
• 转入ICU,获得超声心动图并进行血流动力学监护• 吸氧• 快速静脉输液和必要的血管加压剂。
• 对症处理器官毒性4级发热伴需要多种加压药的低血压和/或需要正压(例如CPAP、BiPAP、插管和机械通气)的缺氧如果在24小时内未达到最大剂量,则按2级进行抗IL-6治疗h地塞米松每6小时静脉注射10mg(或等效)j。
若反复,考虑每日甲泼尼龙静脉注射1000mg k 。
ICU护理及血流动力学监护• 必要时进行机械通气• 当需要时快速输液和血管加压剂• 对症处理器官毒性f. CRS分级由严重事件数决定:无其他原因的低血压和缺氧。
例如,一位患者体温39.5℃,需要1剂加压药的低血压,和需要低流量鼻导管通气的缺氧,此时应为3级。

CAR-T细胞的研究进展[摘要]嵌合抗原受体T(CAR-T)细胞治疗被认为是治疗复发或难治性肿瘤,特别是血液系统恶性肿瘤的有效方法。
尽管最初批准的抗CD19 CAR-T疗法取得了令人印象深刻的结果,但也经历了高复发率和耐药性等挫折,促使人们需要发现更有效的工程CAR-T细胞用于治疗。
CAR-T细胞在结构和制造方面的创新导致了疗效和持久性的显著改善,特别是随着第四代CAR-T细胞的发展。
与免疫调节剂配对,第四代和下一代CAR-T细胞的使用将不会因为细胞毒效应而受到限制,将成为克服肿瘤微环境的有效工具。
本文综述了CAR-T细胞结构在胞外区、跨膜区和胞内区的最新变化,结合创新的制造技术和改进的细胞来源,展望了CAR-T细胞治疗的未来发展前景。
[关键词]CAR-T细胞疗法;恶性血液病;免疫治疗随着临床试验的扩大,检查点抑制疗法已经显示出在短期内逆转复发患者CAR-T细胞耗竭的能力,并通过诱导释放转基因免疫修饰物来塑造肿瘤环境。
基于这些原理的CAR-T细胞疗法被称为第四代CAR-T细胞疗法[1]。
此外,除了免疫调节剂外,T细胞结合体和一些膜受体也与第二代CAR-T细胞转导,通常被称为下一代CAR-T细胞。
这些CAR-T细胞不受T细胞毒性的限制,是输注后重建免疫系统的强大工具。
作为到目前为止最受期待的进展,第四代和下一代CAR-T细胞被分为两类,利用分泌分子的细胞和利用膜受体的细胞。
到目前为止,修饰细胞内域的创新方法一直是几代人CAR-T细胞革命性变化的主要驱动力。
仅含有CD3 ITAM片段的第一代CAR-T细胞因缺乏持久性和增殖能力而过时。
第二代抗CD19 CAR-T细胞在B细胞ALL和NHL患者中显示出强大的抗肿瘤效果,并被配方为含有一个刺激表位的内域,如CD28或4-1BB[2]。
探索共刺激结构域潜力的研究正在进行中,新的共刺激结构域,如ICOS和CD27,已经在临床前实验中显示出在消除肿瘤细胞方面的有效性[3]。

诺华第一个CAR-T获批产品Kymriah,产品说明书全篇翻译版丨医麦精品汇1、介绍及使用KYMRIAH是以CD19为靶点的基因改造的T细胞免疫治疗产品,可用于治疗25岁以下患有难治性或两次复发以上的急性B淋巴细胞白血病患者。
2、剂量及管理本品只能自体使用本品只能静脉输注2.1、剂量一个疗程包括氟达拉滨和环磷酰胺淋巴细胞删除性化疗,然后输注KYMRIAH [见临床研究(14)]。
KYMRIAH单剂量单位基于在白细胞分离术患者体重以及含有嵌合抗原受体(CAR)阳性活T细胞*的数量。
---对于50公斤以下体重患者,输注剂量为0.2〜5.0×10^6个CAR阳性T细胞/公斤体重---对于50公斤以上的患者,静脉注射0.1〜2.5×10^8总CAR阳性T细胞(非重量)。
*实际回输剂量参见产品分析证明书。
淋巴细胞删除性化疗:氟达拉滨(30mg / m^2,每天静脉注射4天)和环磷酰胺(500mg / m^2静脉内静脉注射2天,第一次回输与环磷酰胺滴注同日)。
淋巴细胞清除化疗后2〜14天灌注KYMRIAH。
2.2、输液准备和管理如果患者在先前的化疗动性中,发生活动性的不受控的感染,活动性的移植物抗宿主病(GVHD)、淋巴细胞删除性化疗后导致了严重不良反应(包括肺部反应,心脏反应或低血压等),请推迟KYMRIAH的输注。
协调KYMRIAH的解冻和输液时间。
一旦解冻,KYMRIAH可以在室温(20°C 至25°C)下储存30分钟。
提前确认输注时间,并调整解冻的开始时间,以便患者准备好时可以使用KYMRIAH进行输液。
准备输注:1.在输液之前和恢复期间,确保妥珠单抗和急救设备的到位。
2.在KYMRIAH输液前约30至60分钟预先给予对乙酰氨基酚和苯海拉明或其他H1-抗组胺药。
除非在危及生命的紧急情况下,在任何时候请不要使用皮质类固醇。
3.患者身份确认:在KYMRIAH准备之前,将患者身份与KYMRIAH输液袋上的患者标识符进行匹配。