65可逆过程与不可逆过程式卡诺定理讲解
- 格式:pptx
- 大小:466.28 KB
- 文档页数:20



第七节可逆过程和不可逆过程卡诺定理可逆过程和不可逆过程是热力学中非常重要的概念。
卡诺定理则是描述了一个理想的热机的最高效率。
本文将对可逆过程和不可逆过程以及卡诺定理进行详细的解释。
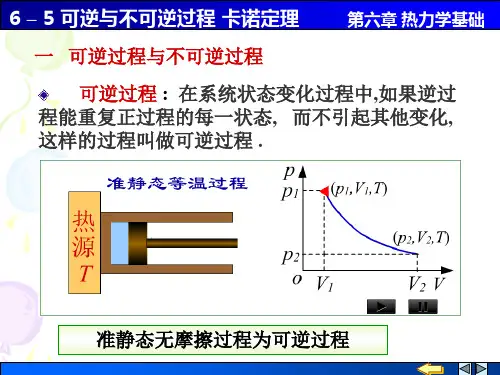
可逆过程指的是在热力学系统中,系统经历的过程是可逆的,即系统在这个过程中可以在任何阶段都可以在微观和宏观层面上逆转,使得系统可以恢复到原来的状态。
可逆过程具有以下几个特点:1.可逆过程是一个平衡过程,系统在这个过程中始终处于平衡状态。
2.系统在可逆过程的每个阶段都与外界处于接触,并可以进行无限小的温度和压强的变化。
3.可逆过程是一个准静态过程,即过程中没有产生任何的涡旋、不均匀性或者阻力,所有过程都是可逆的。
4.可逆过程是热量和功的交换过程中效率最高的过程。
相反,不可逆过程则是指系统在经历这个过程后无法完全恢复到原来的状态。
不可逆过程具有以下特点:1.不可逆过程是一个非平衡的过程,系统在这个过程中不处于平衡状态。
2.不可逆过程中会产生不可逆性损失,包括摩擦、散热等。
3.不可逆过程是一个动态过程,其中会产生涡旋、不均匀性和阻力等。
卡诺定理是热力学中非常重要的原理,它给出了一个理想的热机的最高效率。
卡诺定理的表述如下:1.如果一个热机以两个恒温热源之间的热量的交换为基础,在假设无内部损失的情况下,那么这个热机的效率将是最高的。
2.如果两个恒温热源的温度分别是T1和T2(T1>T2),那么理想热机的最高效率η最高可以表示为:η最高=1-T2/T13.卡诺定理中的温度是绝对温度,即开尔文温度。
卡诺定理指出了一个理想的热机的最高效率,这被称为卡诺效率。
卡诺效率只取决于热源的温度,而不取决于工作物质的性质。
卡诺效率告诉我们,无论是什么样的热机,只要它按照卡诺循环工作,并且利用两个恒温热源的温度差,就可以获得最高的效率。
实际上,实际热机的效率总是低于卡诺效率的,因为它受到了内部损失的影响,包括摩擦、散热等。
在实际应用中,热机的效率往往接近于卡诺效率,而这取决于系统的工作条件、材料的选择和现实的限制。






可逆过程和不可逆过程卡诺定理在热力学中,可逆过程和不可逆过程是两个重要的概念。
可逆过程是指在系统与外界之间没有任何熵的产生或者损失的过程,而不可逆过程则相反,是指在过程中系统与外界之间熵的变化是不可逆转的。
卡诺定理则是用来描述这两种过程之间的关系以及热量转变的极限效率。
1. 可逆过程可逆过程是指在系统与周围环境之间没有任何熵的变化的过程。
在可逆过程中,系统与外界之间的所有能量交换都是可逆的,并且没有能量的产生或耗散。
可逆过程是理想化的概念,在实际系统中几乎是无法达到的。
可逆过程具有以下特征:- 在可逆过程中,系统与环境之间的温度差可以无限接近于零,即温度梯度可以非常小。
- 系统与环境之间的压力差可以无限地缩小,即压力梯度可以非常小。
- 可逆过程中,系统与环境之间的能量转化是无损耗的,没有任何能量的产生或消耗。
- 可逆过程是可逆的,即可以通过反向的过程将系统恢复到原来的状态。
2. 不可逆过程不可逆过程是指在系统与周围环境之间有熵的产生或者损失的过程。
在不可逆过程中,系统与外界之间存在着能量的转化损耗,熵在过程中产生或消耗。
不可逆过程具有以下特征:- 在不可逆过程中,系统与环境之间存在有限的温度差,即系统与环境之间有较大的温度梯度。
- 系统与环境之间存在有限的压力差,即存在较大的压力梯度。
- 不可逆过程中,系统与环境之间有能量的损耗或者产生。
- 不可逆过程是不可逆的,无法通过反向的过程将系统恢复到原来的状态。
3. 卡诺定理卡诺定理是描述可逆和不可逆过程之间关系的一个重要定理。
卡诺定理指出,任意两个工作在相同温度下的系统,如果一个系统是可逆的,另一个是不可逆的,那么它们之间的热量转化效率是不同的。
卡诺定理的数学表达式如下:η = 1 - Tc / Th其中,η表示热量转化的效率,Tc表示冷源的温度,Th表示热源的温度。
根据卡诺定理,热量转化效率的上限就是可逆过程的效率,而不可逆过程的效率要低于可逆过程。
卡诺循环的原理卡诺循环科技名词定义中⽂名称:卡诺循环英⽂名称:Carnot cycle定义:由两个可逆的等温过程和两个可逆的绝热过程所组成的理想循环。
百科名⽚卡诺循环卡诺循环(Carnot cycle) 是由法国⼯程师尼古拉·莱昂纳尔·萨迪·卡诺于1824年提出的,以分析热机的⼯作过程,卡诺循环包括四个步骤:等温膨胀,绝热膨胀,等温压缩,绝热压缩。
即理想⽓体从状态1(P1,V1,T1)等温膨胀到状态2(P2,V2,T2),再从状态2绝热膨胀到状态3(P3,V3,T3),此后,从状态3等温压缩到状态4(P4,V4,T4),最后从状态4绝热压缩回到状态1。
这种由两个等温过程和两个绝热过程所构成的循环成为卡诺循环。
简介卡诺循环包括四个步骤:等温膨胀、绝热膨胀、等温压缩、绝热压缩等温膨胀,在这个过程中系统从环境中吸收热量;绝热膨胀,在这个过程中系统对环境作功;等温压缩,在这个过程中系统向环境中放出热量;绝热压缩,系统恢复原来状态,在这个过程中系统对环境作负功。
卡诺循环可以想象为是⼯作与两个恒温热源之间的准静态过程,其⾼温热源的温度为T1,低温热源的温度为T2。
这⼀概念是1824年N.L.S.卡诺在对热机的最⼤可能效率问题作理论研究时提出的。
卡诺假设⼯作物质只与两个恒温热源交换热量,没有散热、漏⽓、摩擦等损耗。
为使过程是准静态过程,⼯作物质从⾼温热源吸热应是⽆温度差的等温膨胀过程,同样,向低温热源放热应是等温压缩过程。
因限制只与两热源交换热量,脱离热源后只能是绝热过程。
作卡诺循环的热机叫做卡诺热机[1]。
原理卡诺循环的效率通过热⼒学相关定理我们可以得出,卡诺循环的效率ηc=1-T2/T1,由此可以看出,卡诺循环卡诺循环的效率只与两个热源的热⼒学温度有关,如果⾼温热源的温度T1愈⾼,低温热源的温度T2愈低,则卡诺循环的效率愈⾼。
因为不能获得T1→∞的⾼温热源或T2=0K(-273℃)的低温热源,所以,卡诺循环的效率必定⼩于1。
卡诺循环科技名词定义中文名称:卡诺循环英文名称:Carnot cycle定义:由两个可逆的等温过程和两个可逆的绝热过程所组成的理想循环。
百科名片卡诺循环卡诺循环(Carnot cycle) 是由法国工程师尼古拉·莱昂纳尔·萨迪·卡诺于1824年提出的,以分析热机的工作过程,卡诺循环包括四个步骤:等温膨胀,绝热膨胀,等温压缩,绝热压缩。
即理想气体从状态1(P1,V1,T1)等温膨胀到状态2(P2,V2,T2),再从状态2绝热膨胀到状态3(P3,V3,T3),此后,从状态3等温压缩到状态4(P4,V4,T4),最后从状态4绝热压缩回到状态1。
这种由两个等温过程和两个绝热过程所构成的循环成为卡诺循环。
简介卡诺循环包括四个步骤:等温膨胀、绝热膨胀、等温压缩、绝热压缩等温膨胀,在这个过程中系统从环境中吸收热量;绝热膨胀,在这个过程中系统对环境作功;等温压缩,在这个过程中系统向环境中放出热量;绝热压缩,系统恢复原来状态,在这个过程中系统对环境作负功。
卡诺循环可以想象为是工作与两个恒温热源之间的准静态过程,其高温热源的温度为T1,低温热源的温度为T2。
这一概念是1824年N.L.S.卡诺在对热机的最大可能效率问题作理论研究时提出的。
卡诺假设工作物质只与两个恒温热源交换热量,没有散热、漏气、摩擦等损耗。
为使过程是准静态过程,工作物质从高温热源吸热应是无温度差的等温膨胀过程,同样,向低温热源放热应是等温压缩过程。
因限制只与两热源交换热量,脱离热源后只能是绝热过程。
作卡诺循环的热机叫做卡诺热机[1]。
原理卡诺循环的效率通过热力学相关定理我们可以得出,卡诺循环的效率ηc=1-T2/T1,由此可以看出,卡诺循环卡诺循环的效率只与两个热源的热力学温度有关,如果高温热源的温度T1愈高,低温热源的温度T2愈低,则卡诺循环的效率愈高。
因为不能获得T1→∞的高温热源或T2=0K(-273℃)的低温热源,所以,卡诺循环的效率必定小于1。