高分子化学 第二章
- 格式:doc
- 大小:88.50 KB
- 文档页数:4







第二章缩聚和逐步聚合思考题2.1简述逐步聚合和缩聚、缩合和缩聚、线形缩聚和体形缩聚、自缩聚和共缩聚的关系和区别。
解(1)逐步聚合和缩聚逐步聚合反应中无活性中心,通过单体中不同官能团之间相互反应而逐步增长,每步反应的速率和活化能大致相同。
缩聚是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,缩聚物为主产物,同时还有低分子副产物产生,缩聚物和单体的元素组成并不相同。
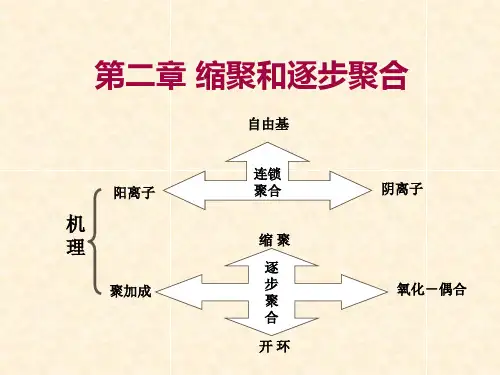
逐步聚合和缩聚归属于不同的分类。
按单体—聚合物组成结构变化来看,聚合反应可以分为缩聚、加聚和开环三大类。
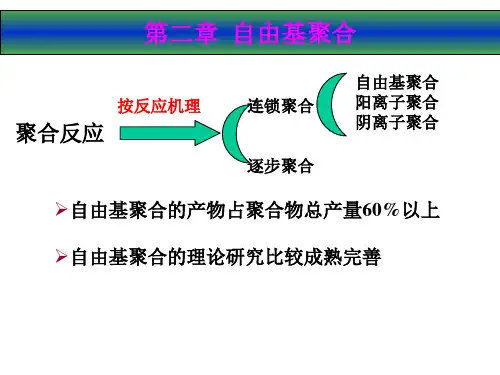
按聚合机理,聚合反应可以分成逐步聚合和连锁聚合两类。
大部分缩聚属于逐步聚合机理,但两者不是同义词。
(2)缩合和缩聚缩合反应是指两个或两个以上有机分子相互作用后以共价键结合成一个分子,并常伴有失去小分子(如水、氯化氢、醇等)的反应。
缩聚反应是缩合聚合的简称,是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,主产物为大分子,同时还有低分子副产物产生。
l-1、1-2、1-3等体系都有一种原料是单官能度,只能进行缩合反应,不能进行缩聚反应,缩合的结果,只能形成低分子化合物。
醋酸与乙醇的酯化是典型的缩合反应,2-2、2-3等体系能进行缩聚反应,生成高分子。
(3)线形缩聚和体形缩聚根据生成的聚合物的结构进行分类,可以将缩聚反应分为线形缩聚和体形缩聚。
线形缩聚是指参加反应的单体含有两个官能团,形成的大分子向两个方向增长,得到线形缩聚物的反应,如涤纶聚酯、尼龙等。
线形缩聚的首要条件是需要2-2或2官能度体系作原料。
体形缩聚是指参加反应的单体至少有一种含两个以上官能团,并且体系的平均官能度大于2,在一定条件下能够生成三维交联结构聚合物的缩聚反应。
如采用2-3官能度体系(邻苯二甲酸酐和甘油)或2-4官能度体系(邻苯二甲酸酐和季戊四醇)聚合,除了按线形方向缩聚外,侧基也能缩聚,先形成支链,进一步形成体形结构。
(4)自缩聚和共缩聚根据参加反应的单体种类进行分类,可以将缩聚反应分为自缩聚、混缩聚和共缩聚。


第二章参考答案
3. 己二酸与下列化合物反应,那些能形成聚合物?
解:己二酸为2官能度单体,f =2。
a. 乙醇:2-1体系不能形成聚合物,生成己二酸二乙酯。
b. 乙二醇:2-2体系形成线形聚合物,即聚己二酸乙二醇酯。
c. 甘油:2-3体系形成体型聚合物。
d. 苯胺:2-1体系不能形成聚合物,生成己二酰二苯胺。
e. 己二胺:2-2体系形成线形聚合物,即己二酰二胺或称尼龙-66。
5. 下列多对单体进行线形缩聚:己二酸和己二醇。
己二酸和己二胺,
己二醇和对苯二甲酸,己二胺和对苯二甲酸。
简明给出并比较缩聚物的性能特征。
⑴. 己二酸和己二醇:形成线形聚酯。
分子中无氢键,且分子柔软,所
以,聚合物的熔点低,强度小,且不耐溶剂,易水解,不能用作结构材料。
但可作为聚氨酯的预聚物、药物载体、可降解的缝合线等。
⑵. 己二酸和己二胺:形成线形聚酰胺,即尼龙-66。
其有较高的结晶
度、熔点和强度,可以用作高强度的合成纤维和工程塑料。
⑶. 己二醇和对苯二甲酸:形成线形芳香聚酯,即涤纶聚酯,苯环的存
在,提高了聚酯的刚性、强度和熔点,亚乙基赋予聚酯的柔性,使
涤纶聚酯成为合成纤维的第一大品种。
⑷. 己二胺和对苯二甲酸:形成半芳胺,即尼龙-6T,其热稳定性好,
熔点高。
6. 简述线形缩聚中的成链和成环倾向。
选定下列单体中的m值,判
断其成环倾向。
在线形缩聚时,单体及中间产物有成环倾向,一般,五、六元环的结构比较稳定,易成环;另外单体浓度对成环倾向也有影响,因成环是单分子反应,缩聚是双分子反应,因此,低浓度有利于成环,高浓度有利于线形缩聚而成链。
⑴. 氨基酸:当1
m时,经双分子缩合后,易形成六元环。
甘氨酸形成
=
甘氨酸酐。
当2
m时,经消去反应,可能形成丙烯酸。
=
当4
3or
m=时,分子内形成酰胺后,易形成五、六元环。
当5
m时,主要形成线形聚合物。
≥
⑵. 乙二醇与二元酸:不易成环,主要形成线形聚合物。
7. 简述线形缩聚的逐步机理,以及转化率与反应程度的关系。
线形缩聚的逐步机理——逐步和平衡。
⑴. 线型缩聚反应的逐步性
缩聚反应形成聚合物是官能团之间相互反应的结果。
缩聚早期,单体很快消失,转变成二聚体、三聚体、四聚体等低聚物,转化率很高,但反应程度不高,以后的缩聚反应则在低聚物之间进行。
聚合度随反应时间而增加。
延长聚合时间的主要目的主要是提高反应程度和分子量,而不在于提高转化率。
缩聚早期,单体的转化率就很高,而分子量和反应程度却很低。
⑵. 线型缩聚反应的平衡性
许多缩聚反应是可逆的,其可逆的程度可由平衡常数来衡量。
根据其大小,可将线型缩聚大致分成三类:①平衡常数小,如聚酯化反应,K≈4,低分子副产物水的存在对聚合物相对分子质量影响很大,应除去。
②平衡常数中等,如聚酰胺化反应,K≈300~500,水对聚合物相对分子质量有所影响。
③平衡常数很大或看作不可逆,如聚碳
酸酯和聚砜一类的缩聚,平衡常数总在几千以上。
不同的缩聚反应,其可逆平衡程度有明显的差别。
转化率与反应程度的关系:
转化率为参加反应变成聚合物的单体占起始单体量的百分数。
反应程度为参加反应的官能团数占起始官能团数的分率。
缩聚反应的本质是官能团之间的反应,只有官能团之间充分反应才能生成大分子,故,用反应程度才能描述反应进行的深度或相对分子量的大小。
计算题
8. 等摩尔的二元醇和对苯二甲酸在280℃下封管内进行缩聚,平衡
常数4=K ,求最终n X 。
另在排除副产物水的条件下缩聚,欲得100=n X ,问体系中残留水分有多少?
()3
141101422=+=+=∴+==-K X K K
P K P P K n -平衡时,
,=封闭体系, ()()0004.01000041101422===∴==-==-n w w
w n w X K n n K Pn K P X K
Pn P K -平衡时,,=部分排除水分,
9. 等摩尔二元醇和二元酸缩聚,另加醋酸1.5%,求999.0 995
.0或=p 时聚酯的聚合度是多少?
80995.0985.02985.01985.01211985.0015
.02222 995.0 %5.1 '=⨯⨯-++=-++==⨯=+==rP r r X N N N r P n b b a +时:
,当醋酸过量
117999
.0985.02985.01985.01211985.0015.022
22 999.0 %5.1 '=⨯⨯-++=-++==⨯=+==rP r r X N N N r P n b b a +时:,
当醋酸过量 ()()015.0122
=-++=q p q q X n 其它求聚合度的方法: ⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛⇒=++⨯=-=分子总数倍非过量基团数的2985.1015.01122 22f f P X n
10. 尼龙1010是根据1010盐中过量的癸二酸来控制分子量,如果要
求分子量为20000,问1010盐的酸值应该是多少?(以g KOH mg 计)
374101033810100盐的分子量为=重复单元的分子量尼龙M -
3.11822.590====n X M M n n n 重复单元数
因为酸过量,所以假设癸二胺的反应程度 1=P
由聚合度可以求出单体的基团数比r 。
983.03.11811211==-+=-++=r r r rp r r X n 解出:
如果癸二胺的基团数为1=a N ,则癸二酸0173.1983.01==b N ()()()盐=
酸值盐101018.537425610173.121010g mgKOH M M N N KOH a b =⨯⨯-⨯-=。