热力学第一定律
- 格式:ppt
- 大小:1.47 MB
- 文档页数:40


热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫ ⎝⎛∂∂+dp p H T⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T VT S ⎪⎭⎫⎝⎛∂∂ C p =T p T S ⎪⎭⎫ ⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。


热一定律总结一、 通用公式ΔU = Q + W绝热: Q = 0,ΔU = W 恒容(W ’=0):W = 0,ΔU = Q V恒压(W ’=0):W =-p ΔV =-Δ(pV ),ΔU = Q -Δ(pV ) ΔH = Q p 恒容+绝热(W ’=0) :ΔU = 0 恒压+绝热(W ’=0) :ΔH = 0焓的定义式:H = U + pV ΔH = ΔU + Δ(pV )典型例题:思考题第3题,第4题。
二、 理想气体的单纯pVT 变化恒温:ΔU = ΔH = 0变温: 或或如恒容,ΔU = Q ,否则不一定相等。
如恒压,ΔH = Q ,否则不一定相等。
C p , m – C V , m = R双原子理想气体:C p , m = 7R /2, C V , m = 5R /2 单原子理想气体:C p , m = 5R /2, C V , m = 3R /2典型例题:思考题第2,3,4题书、三、 凝聚态物质的ΔU 和ΔH 只和温度有关或ΔU = n C V,T 2 T 1∫ΔH = nC p, T 2 T 1∫ΔU = nC V, ΔH = nC p, ΔU ≈ ΔH = n C p, m d T T 2 T1∫ ΔU ≈ ΔH = nC p,典型例题:书四、可逆相变(一定温度T 和对应的p 下的相变,是恒压过程)ΔU ≈ ΔH –ΔnRT(Δn :气体摩尔数的变化量。
如凝聚态物质之间相变,如熔化、凝固、转晶等,则Δn = 0,ΔU ≈ ΔH 。
kPa 及其对应温度下的相变可以查表。
其它温度下的相变要设计状态函数不管是理想气体或凝聚态物质,ΔH 1和ΔH 3均仅为温度的函数,可以直接用C p,m 计算。
或典型例题:作业题第3题 五、化学反应焓的计算H 1 +Δ H m (βα αβΔ αβ可逆相变K:ΔH = Q p = n Δ α βΔH = nC p,ΔH = nC p, T 2 T1∫其他温度:状态函数法ΔU 和ΔH 的关系:ΔU = ΔH –ΔnRT (Δn :气体摩尔数的变化量。




热力学第一定律科技名词定义中文名称:热力学第一定律英文名称:first law of thermodynamics其他名称:能量守恒和转换定律定义:热力系内物质的能量可以传递,其形式可以转换,在转换和传递过程中各种形式能源的总量保持不变。
概述热力学第一定律热力学第一定律:△U=Q+W。
系统在过程中能量的变化关系英文翻译:the first law of thermodynamics简单解释在热力学中,系统发生变化时,设与环境之间交换的热为Q(吸热为正,放热为负),与环境交换的功为W(对外做功为负,外界对物体做功为正),可得热力学能(亦称内能)的变化为ΔU = Q+ W或ΔU=Q-W物理中普遍使用第一种,而化学中通常是说系统对外做功,故会用后一种。
定义自然界一切物体都具有能量,能量有各种不同形式,它能从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转化和传递过程中能量的总和不变。
英文翻译:The first explicit statement of the first law of thermodynamics, byRudolf Clausiusin 1850, referred to cyclic thermodynamic processes "In all cases in which work is produced by the agency of heat, a quantity of heat is consumed which is proportional to the work done; and conversely, by the expenditure of an equal quantity of work an equal quantity of heat is produced."基本内容能量是永恒的,不会被制造出来,也不会被消灭。
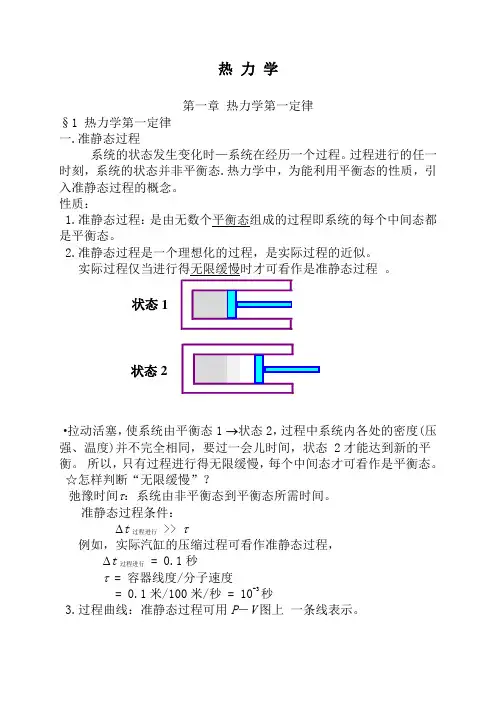
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。

第一章热力学第一定律本章主要公式及其使用条件一、热力学第一定律W Q U +∆= W Q dU δδ+=热力学中规定体系吸热为正值,体系放热为负值;体系对环境作功为负值,环境对体系作功为正值。
功分为体积功和非体积功。
二、体积功的计算体积功:在一定的环境压力下,体系的体积发生改变而与环境交换的能量。
体积功公式⎰⋅-=dV p W 外 1 气体向真空膨胀:W =0 2气体在恒压过程:)(12 21V V p dV p W V V --=-=⎰外外3理想气体等温可逆过程:2112ln lnp p nRT V V nRT W -=-= 4理想气体绝热可逆过程:)(12,T T nC W U m V -=∆=理想气体绝热可逆过程中的p ,V ,T 可利用下面两式计算求解1212,ln ln V V R T T C m V -=21,12,ln lnV V C p p C m p m V =三、热的计算热:体系与环境之间由于存在温度差而引起的能量传递形式。
1. 定容热与定压热及两者关系定容热:只做体积功的封闭体系发生定容变化时, U Q V ∆= 定压热:只做体积功的封闭体系定压下发生变化, Q p = ΔH定容反应热Q V 与定压反应热Q p 的关系:V p Q Q V p ∆+= nRT U H ∆+∆=∆n ∆为产物与反应物中气体物质的量之差。
或者∑+=RT g Q Q m V m p )(,,ν ∑+∆=∆RT g U Hm m)(ν式中∑)(g ν为进行1mol 反应进度时,化学反应式中气态物质计量系数的代数和。
2.热容 1.热容的定义式dTQ C δ=dT Q C VV δ=dT Q C pp δ=n CC VmV =,n C C p m p =, C V ,C p 是广度性质的状态函数,C V ,m ,C p,m 是强度性质的状态函数。
2.理想气体的热容对于理想气体 C p ,m - C V ,m =R 单原子理想气体 C V ,m = 23R ;C p ,m = 25R 双原子理想气体 C V ,m =25R ;C p ,m = 27R 多原子理想气体: C V ,m = 3R ;C p ,m = 4R通常温度下,理想气体的C V ,m 和C p,m 均可视为常数。
1.2 热 力 学 第 一 定 律1.2.1 热功当量热力学第一定律的数学表达式设有任一个物系做一个任意循环(如图),吸热为Q ',做功为W ,我们发现0=+'W Q J(1)由于Q '的单位为卡,功的单位为焦耳,二者 不能直接相加,Q '前必须乘以热功转换系数或称热功当量J (焦耳/卡)。
Joule (焦耳)和 Mayer (迈耶尔)自1840年起,历经20多年,用各种实验求证热和功的转换关系,得到的结果是一致的。
即: 1 cal = 4.1840 J这就是著名的热功当量,为能量守恒原理提供了科学的实验证明。
1.2.2 能量守恒定律自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转化过程中,能量的总值不变。
到1850年,科学界公认能量守恒定律是自然界的普遍规律之一。
1.2.3 热力学能(Internal energy)系统总能量通常有三部分组成: 1)系统整体运动的动能 2)系统在外力场中的位能 3)热力学能,也称为内能 1.2.3.1 定义热力学能是指系统内部能量的总和,包括分子运动的平动能、分子内的转动能、振动能、电子能、核能以及各种粒子之间的相互作用位能等。
p V热力学中一般只考虑静止的系统,无整体运动,不考虑外力场的作用,所以只注意热力学能1.2.3.2 热力学能的特点1) 内能是体系内部能量的总和 U ,单位J ,kJ ,包括:• 对于组成一定的均匀体系,只要体系的量确定, U 由体系的两个性质确定。
2)3)4) 5) 6) 热力学能是状态函数。
∆U=U 2-U 1,, 微小变化d U 。
1.2.4 热力学第一定律的数学表达式W Q dU δδ+=或 W Q U +=∆这就是热力学第一定律的数学表达式。
对于非循环过程,状态函数的变化值只与初末态有关,与具体的历程无关:w ad =U f -U i =△Uh =A f -A i =△A △U = Q + W (宏观过程)—the First Law of thermodynamics无穷小过程)process( mal infinitesi -+=W Q dU δδ热力学第一定律是能量转化和守恒定律的特殊形式。
热力学第一定律热力学第一定律,也被称为能量守恒定律,是热力学基本定律之一。
它阐述了能量在物理系统中的守恒原理,即能量不会被创造或消灭,只会在不同形式之间转换或传递。
该定律在许多领域都有广泛的应用,包括工程、物理、化学等。
1. 定律的表述热力学第一定律可从不同的角度进行表述,以下是几种常见的表述方式:1.1 内能变化根据热力学第一定律,一个封闭系统内能的变化等于系统所吸收的热量与系统所做的功的代数和。
数学表达式如下:ΔU = Q + W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统所做的功。
1.2 能量守恒根据能量守恒定律,能量既不能被创造也不能被摧毁,只会在不同形式之间传递或转换。
能量的总量在一个封闭系统中保持不变。
2. 系统内能的变化系统内能的变化是热力学第一定律的核心内容之一。
系统内能的变化是由系统吸收或释放的热量以及系统所做的功决定的。
2.1 系统吸收的热量系统吸收的热量指的是系统从外界获得的热能。
当一个热源与系统接触时,能量会以热量的形式从热源传递到系统中。
系统吸收的热量可以引起系统内能的增加。
2.2 系统所做的功系统所做的功指的是系统对外界做的能量转移。
当系统对外界施加力并移动时,能量会以功的形式从系统传递到外界。
系统所做的功可以引起系统内能的减少。
3. 热力学第一定律的应用3.1 工程应用热力学第一定律在工程领域有着广泛的应用。
例如,在能源系统的设计与优化中,需要根据系统的能量转换过程,计算系统的内能变化和热功效率等参数,以提高能源利用效率。
3.2 物理学应用在物理学研究中,热力学第一定律通常用于分析热力学过程中的能量转化。
例如,在热力学循环中,通过计算各个环节的能量转换情况,可以确定工作物质的热效率,从而评估系统的性能。
3.3 化学反应在化学反应中,热力学第一定律对于研究反应的能量变化和平衡状态具有重要意义。
通过计算反应过程中释放或吸收的热量,可以确定反应的放热性或吸热性,并预测反应的发生与否。