物理化学 03-03相变过程熵变
- 格式:ppt
- 大小:406.00 KB
- 文档页数:8







物理化学解析化学反应的熵变与自由能变化在物理化学领域中,解析化学反应的熵变与自由能变化是一项重要的研究内容。
熵变(ΔS)和自由能变化(ΔG)是描述化学反应中系统混乱程度和能量变化的重要物理量。
本文将对熵变和自由能变化的概念进行解析,并探讨它们与化学反应的关系。
1. 熵变的概念及含义熵(S)是描述系统无序程度的物理量,即系统的混乱程度。
熵变(ΔS)表示在化学反应中系统熵的增加或减少。
根据热力学第二定律,一个孤立系统的熵不断增加,因此熵变通常表示为正值。
熵变的计算可以通过以下公式求得:ΔS = S产物 - S反应物其中,S产物和S反应物分别表示反应产物和反应物的熵值。
2. 自由能变化的概念及计算自由能(G)是描述系统可逆过程中能量的物理量,是系统的稳定性指标。
自由能变化(ΔG)表示在化学反应中系统自由能的增加或减少。
自由能变化可以通过以下公式计算:ΔG = ΔH - TΔS其中,ΔH表示反应焓变,T表示绝对温度(Kelvin),ΔS表示熵变。
3. 熵变与自由能变化的关系熵变和自由能变化之间存在着密切的关系。
根据ΔG的计算公式,可以得知当ΔG<0时,化学反应是自发进行的;当ΔG>0时,化学反应是不可逆进行的;当ΔG=0时,化学反应处于平衡状态。
根据ΔG的公式,我们可以得出以下结论:- 当ΔH<0且ΔS>0时,自由能变化ΔG<0,反应是自发进行的。
- 当ΔH>0且ΔS<0时,自由能变化ΔG>0,反应是不可逆进行的。
- 当ΔH<0且ΔS<0时,自由能变化ΔG的正负取决于温度的影响。
4. 熵变与自由能变化在化学反应中的应用熵变和自由能变化是描述化学反应方向和速率的重要指标,具有广泛的应用:- 在工业生产中,通过熵变和自由能变化的计算,可以优化反应条件,提高反应产率和选择性。
- 在生物化学中,熵变和自由能变化对于描述酶催化反应的速率和选择性也具有重要作用。
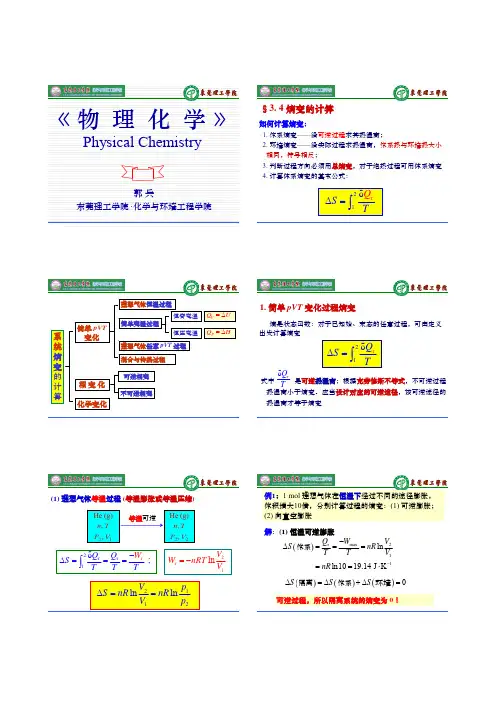
《物理化学》教学提要第五讲熵变的计算熵变是指热力学系统在定常过程中发生的熵的变化,即Δ
S=Sf-Si,其中Sf为终态熵,Si为初态熵。
2. 熵变的计算方法
(1) 对于理想气体的等温、等容和等压过程,熵变的计算公式分别为:
ΔS=q/T
ΔS=Cvln(Tf/Ti)
ΔS=Cpln(Tf/Ti)-Rln(Vf/Vi)
其中q为吸热量,T为热力学温度,Cv为定容热容,Cp为定压热容,R为气体常数,V为体积。
(2) 对于化学反应,熵变的计算公式为:
ΔS=∑nSf-∑mSi
其中n为生成物的系数,m为反应物的系数,S为标准熵。
(3) 对于固体和液体的物质状态变化,熵变的计算公式为:
ΔS=Cpln(Tf/Ti)
其中Cp为定压热容,T为热力学温度,f和i分别表示终态和初态。
3. 熵变的影响因素
熵变受到温度、压力、物质状态和化学反应等因素的影响。
一般来说,温度越高,熵变越大;压力越大,熵变越小;物质状态从固体到液体再到气体,熵变越大;而化学反应的熵变则与反应类型和反应
条件有关。
4. 熵定律
熵定律是指在孤立系统中,熵的增加是不可避免的。
这一定律对于热力学系统的稳定性和可逆性具有重要的理论和实际意义。