干燥空气的热物理参数
- 格式:doc
- 大小:124.00 KB
- 文档页数:2


空气的定压比热容(cp)什么是比热容?比热容是指单位质量物质在单位温度变化下所吸收(或释放)的热量。
它是一个物质的热力学性质,描述了物质在加热或冷却过程中的能力。
比热容通常用符号cp 来表示。
在理想情况下,比热容可以分为定压比热容(cp)和定容比热容(cv)。
本文将主要讨论空气的定压比热容(cp),即在恒定压力条件下空气吸收或释放的热量。
空气的定压比热容是多少?空气的定压比热容(cp)取决于空气的成分和条件。
一般来说,干燥空气的定压比热容大约为1.005 kJ/(kg·K)。
定压比热容是一个物质的重要热学参数,它在许多领域中都有广泛的应用。
在工程和科学领域中,人们常常需要计算空气的热力学特性,例如在燃烧、传热和空气动力学等过程中。
定压比热容的计算方法空气的定压比热容可以通过实验测量或根据空气成分来计算。
下面将介绍一种常用的计算空气定压比热容的方法。
1. 利用成分计算空气主要由氮气(N2)和氧气(O2)组成,其中氮气的体积分数约为78%,氧气的体积分数约为21%。
由于氮气和氧气的定压比热容不同,计算空气的定压比热容需要考虑它们的比例。
空气的定压比热容可以通过下面的公式计算:cp = (cp_N2 * x_N2) + (cp_O2 * x_O2)其中,cp_N2和cp_O2分别为氮气和氧气的定压比热容,x_N2和x_O2分别为空气中氮气和氧气的体积分数。
氮气的定压比热容约为1.040 kJ/(kg·K),氧气的定压比热容约为0.918kJ/(kg·K)。
2. 实验测量另一种计算定压比热容的方法是通过实验测量。
实验室可以使用热容计等仪器测量空气在不同温度下的定压比热容。
通过实验测量得到的数据可以用来验证上述计算方法的准确性,并为实际应用提供参考。
定压比热容的应用空气的定压比热容在工程和科学中有着广泛的应用。
下面介绍一些常见的应用领域:1. 燃烧过程在燃烧过程中,空气是常用的氧化剂。

实验二测定气体导热系数物理学为衡量物质传导热的性质设置了导热系数,导热系数代表该物质的导热性能。
导热系数大的物质为热的良导体;导热系数小的物质为热的不良导体。
水的导热性能好,气体的导热性能差。
在气体中不同的气体,导热性能相差悬殊。
比如氦和氢的导热系数比空气大6~7倍,说明氦的导热能力比空气大6~7倍。
在气相色谱分析中,气体导热系数这一热学性质被用来鉴别不同的气体。
“热线法”是测量气体导热系数的基本方法。
为了减少气体对流传热的影响,实验测量在低气压下进行,然后通过线性外推求算实验结果。
【实验目的】l.掌握用热线法测定气体导热系数的基本原理和正确方法。
2.掌握低真空系统的基本操作。
3.学习应用“线性回归”和“外推法”进行实验数据处理。
【实验原理】l.“热线法”测量气体导热系数的原理“热线法”是在样品(通常为大的块状样品)中插入一根热线。
测试时,在热线上施加一个恒定的加热功率,使其温度上升。
测量热线本身或平行于热线的一定距离上的温度随时间上升的关系。
由于被测材料的导热性能决定这一关系,由此可得到材料的导热系数。
本实验将待测气体盛于沿轴线方向装有一根钨丝的圆柱形容器内(如图1),该容器称为测量室。
并给钨丝提供一定的电流使其温度为,设容器内壁的温度近似为室温。
由于,容器中的待测气体必然形成一个沿径向分布的温度梯度,由于待测气体的热传导,将迫使钨丝温度下降,因而无法维持测量室中温度梯度的稳定状态。
只有设法维持钨丝的温度恒为,容器内待测气体的温度分布才能保持为稳定的径向分布的温度场。
图1本实验就是用热线恒温自动控制系统来维持钨丝温度恒为。
这样,每秒钟由于气体热传导所耗散的热量就等于维持钨丝的温度恒为时所消耗的电功率。
不同气体的导热性能(导热系数)不同,则维持钨丝温度恒为所消耗的电功率也不同,因而可以通过测量钨丝消耗的电功率来求算待测气体的导热系数。
图1是测量室的示意图,假设钨丝的半径为,测量室的内半径为,钨丝的温度为,长度为,室温为。

干燥[例1] 相对湿度φ值可以反映湿空气吸收水汽能力的大小,当φ值大时,表示该湿空气吸收水汽的能力;当φ=0时,表示该空气为。
[解题思路]相对湿度φ表示了空气中水汽含量的相对大小,φ=1,表示空气已经达到饱和状态,不能再吸收任何水汽;φ越小,表示空气尚可吸收更多的水汽。
这一概念必须熟练掌握,在有关于燥的计算中要多次涉及。
【答案】弱;绝干空气[例2] 已知某物料含水量为0.4千克/千克干料,从该物料干燥速率曲线可知:临界含水量为0.25千克/千克干料,平衡含水量为0.05千克/千克干料,则物料的非结合水分为,结合水分为,自由水分为,可除去的结合水分为。
[解题思路]结合水与非结合水、平衡水分与自由水分是物料中水分含量的两种不同的区分方式。
它们之间的关系可用下面的方程简单地表示:物料总含水量=非结合水量十结合水量=自由含水量十平衡含水量自由含水量=非结合水量十可除去的部分结合水量平衡含水量=不可除去的部分结合水量[答案] 0.15;0.25;0.35;0.2(单位:千克/千克干料)[例3] 在101.3kPa下,不饱和湿空气的湿度为298K,相对湿度为50%,当加热到373K时,该空气的下列状态参数将如何变化?(只填变化的趋势)湿度,相对湿度,湿球温度,露点,焓。
[解题思路] 此题主要判断湿空气的状态变化,可以从湿度、相对湿度等的定义出发获得结果,也可借助空气—水系统的焓—湿因得到答案。
需要注意的是,露点是一个与空气温度无关的参量。
【答案】不变;降低;升高;不变;增加[例4] 冬季将洗好的湿衣服晾在室外,室外温度在零度以上,衣服有无可能结冰?。
[解题思路] 这是一个活用概念的题。
在不饱和空气中,湿衣服的湿球温度t w<t,而当t w<0时可能结冰。
[答案] 有[例5] 当湿度和温度相同时,相对湿度φ与总压p的关系是( )。
A.成正比B成反比C.无关 D . φ与p s成正比[解题思路]在相同的H值和温度t(即相同的饱和蒸气压p s)下,当总压由p降低至p’,设其对应的相对湿度由φ变为φ’,其间变化可由下列关系表示为[答案] A[例6] 湿空气的湿球温度与其绝热饱和温度有何区别和联系?[解题思路] 对于水蒸气—空气系统,湿球温度t w和绝热饱和温度t as在数值上近似相等,且两者均为初始湿空气温度和湿度的函数。

干燥的原理
干燥的原理:
(1)基本原理:
在干燥过程中,水分从物料内部移向(扩散)表面,再由表面扩散到热空气中。
干燥过程得以进行的必要条件:是被干燥物料中的水分所产生的水蒸气分压大于热空气中水蒸气分压。
若二者相等,表示蒸发达到平衡,干燥停止;若热空气中水蒸气分压大,物料反而吸水。
所以为了使物料干燥,必须控制热空气的相对湿度RH(饱和空气RH=100﹪,未饱和空气RH﹤100﹪,绝干空气RH=0﹪)
(2)物料中水分的性质
1)平衡水分:指在一定空气状态下,物料表面产生的水蒸气压与空气中水蒸气分压相等时物料中所含的水分,该部分水是干燥所除不去的水分。
物料的平衡水分含量与空气相对湿度有关,随空气的RH上升而增大。
干燥器内空气相对湿度,应低于被干燥物自身的相对湿度。
2)自由水分:指物料中所含大于平衡水分的那部分水或称游离水。
自由水可在干燥过程中除去。
3)结合水分:指主要以物理方式结合的水分,结合水分与物料性质有关,具有结合水分的物料,称为吸水性物料。
4)非结合水分:主要指以机械方式结合的水分,与物料的结合力很弱,仅含非结合水的物料叫做非吸水性物料。

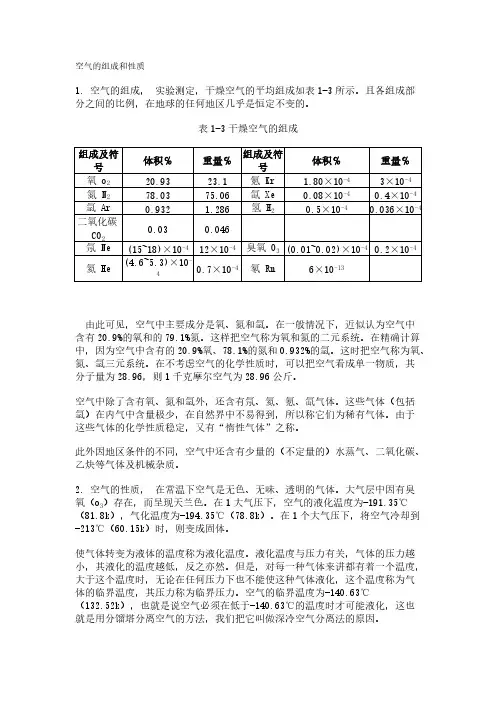
空气的组成和性质1. 空气的组成, 实验测定,干燥空气的平均组成如表1-3所示。
且各组成部分之间的比例,在地球的任何地区几乎是恒定不变的。
表1-3干燥空气的组成 由此可见,空气中主要成分是氧、氮和氩。
在一般情况下,近似认为空气中含有20.9%的氧和的79.1%氮。
这样把空气称为氧和氮的二元系统。
在精确计算中,因为空气中含有的20.9%氧、78.1%的氮和0.932%的氩。
这时把空气称为氧、氮、氩三元系统。
在不考虑空气的化学性质时,可以把空气看成单一物质,其分子量为28.96,则1千克摩尔空气为28.96公斤。
空气中除了含有氧、氮和氩外,还含有氖、氦、氪、氙气体。
这些气体(包括氩)在内气中含量极少,在自然界中不易得到,所以称它们为稀有气体。
由于这些气体的化学性质稳定,又有“惰性气体”之称。
此外因地区条件的不同,空气中还含有少量的(不定量的)水蒸气、二氧化碳、乙炔等气体及机械杂质。
2. 空气的性质, 在常温下空气是无色、无味、透明的气体。
大气层中因有臭氧(o 3)存在,而呈现天兰色。
在1大气压下,空气的液化温度为-191.35℃(81.8k ),气化温度为-194.35℃(78.8k )。
在1个大气压下,将空气冷却到-213℃(60.15k )时,则变成固体。
使气体转变为液体的温度称为液化温度。
液化温度与压力有关,气体的压力越小,其液化的温度越低,反之亦然。
但是,对每一种气体来讲都有着一个温度,大于这个温度时,无论在任何压力下也不能使这种气体液化,这个温度称为气体的临界温度,其压力称为临界压力。
空气的临界温度为-140.63℃(132.52k ),也就是说空气必须在低于-140.63℃的温度时才可能液化,这也就是用分馏塔分离空气的方法,我们把它叫做深冷空气分离法的原因。
组成及符号体积℅重量℅组成及符号体积℅重量℅氧 o 220.9323.1氪 Kr 1.80×10-43×10-4氮 N 278.0375.06氙 Xe 0.08×10-40.4×10-4氩 Ar 0.932 1.286氢 H 20.5×10-40.036×10-4二氧化碳CO 20.030.046氖 Ne (15~18)×10-412×10-4臭氧 O 3(0.01~0.02)×10-40.2×10-4氦 He (4.6~5.3)×10-40.7×10-4氡 Rn 6×10-13空气及各组分的主要物理参数见附表1。



一、热源的种类有以下几种:1、蒸汽2、热水3、电能4、煤炭5、燃油6、可燃气体二、空气换热器(一)热管换热器热管换热器是一种利用封闭在管内的工作物质反复进行物理相变或化学反应来传递热量的一种换热装置。
热管技术是一项新技术,自1964年每一支热管问世以来,到现在也仅有三十多年的历史。
由于它在回收余热、预热空气等方面显示出很多优点,热管技术得到飞速发展,种类和功能也很多,根据热管的工作原理,按工作方式,可以分为物理热管和化学热管。
物理热管是利用工作淮的物理相变传递热量。
化学热管是利用工作物质化合与分解应应传递热量。
在喷雾干燥系统中,利用热管换热器间接加热空气,已获得良好的经济效益。
热管的工作液根据可以选择不同的液体,但每种工作液都有它合适的工作温度范围。
(二)燃煤热风炉以煤为燃料的热空气炉,多数是以间接换热的方法加热空气。
在间接换热过程中,一般有两种情况,一种情况是炉内设有风管,冷空气走管层,烟道气走壳层。
煤燃烧产生的热量对管的外壁进行辐射,热量通过管壁传向内管,然后再与内管的冷空气进行加热。
炉的进口为冷空气,经加热后从另一口出来的为加热到一定温度的高温洁净空气。
另一种为燃煤式导热油炉,导热油被加热后流向别一个换热器,再与冷空气进行换热。
间接换热的特点是得到的热气体洁净度较高,在换热过程中空气无湿度变化,仍操持冷空气的湿含量。
燃煤热风炉结构比较简单,加煤方式也有多种,要据工艺需要或换热量的不同采取不同的加热方式。
由于火焰与换热管直接辐射,燃气内又有硫等腐蚀性较强的化学物质,对管的材料有一定要求。
(三)蒸汽换热器蒸汽换热器是间接换热设备,由多根散热管组成。
在换热时可根据需要一组工作,也可以多组串联使用。
排管用紫铜或钢质材料,为增加传热效果,管外套绕翅片,翅片管子有良好的接触。
用蒸汽做热介质时,管内通蒸汽,管处翅片间走空气。
(四)电加热器电加热器是电能转换成热能,向空气进行辐射传热的加热设备。
电加热器是多要管状电热元件组成。

第一章 绪论1、答:分为三类。
动量传递:流场中的速度分布不均匀(或速度梯度的存在); 热量传递:温度梯度的存在(或温度分布不均匀);质量传递:物体的浓度分布不均匀(或浓度梯度的存在)。
第二章 热质交换过程1、答:单位时间通过垂直与传质方向上单位面积的物质的量称为传质通量。
传质通量等于传质速度与浓度的乘积。
以绝对速度表示的质量通量:,,A A A B B B A A B B m u m u m e u e u ρρ===+ 以扩散速度表示的质量通量:(),(),A A A B B B B A B j u u j u u u j j j ρρ=-=-=+以主流速度表示的质量通量:1()()A A A AB B A A B e u e e u e u a m m e ⎡⎤=+=+⎢⎥⎣⎦()B B A B e u a m m =+2、答:碳粒在燃烧过程中的反应式为22C O CO +=,即为1摩尔的C 与1摩尔的2O 反应,生成1摩尔的2CO ,所以2O 与2CO 通过碳粒表面边界界层的质扩散为等摩尔互扩散。
3、答:当物系中存在速度、温度和浓度的梯度时,则分别发生动量、热量和质量的传递现象。
动量、热量和质量的传递,(既可以是由分子的微观运动引起的分子扩散,也可以是由旋涡混合造成的流体微团的宏观运动引起的湍流传递)动量传递、能量传递和质量传递三种分子传递和湍流质量传递的三个数学关系式都是类似的。
4、答:将雷诺类比律和柯尔本类比律推广应用于对流质交换可知,传递因子等于传质因子①2233r P 2m H D t t c G J J S S S ===⋅=⋅② 且可以把对流传热中有关的计算式用于对流传质,只要将对流传热计算式中的有关物理参数及准则数用对流传质中相对应的代换即可,如:r ,,,P ,,m c u h t t t c a D D S N S S S λ↔↔↔↔↔↔③当流体通过一物体表面,并与表面之间既有质量又有热量交换时,同样可用类比关系由传热系数h 计算传质系数m h 23m hh Le e φ-=⋅5:答:斯密特准则c i v S D =表示物性对对流传质的影响,速度边界层和浓度边界层的相对关系刘伊斯准则r P c v S D a Le v D a ===表示热量传递与质量传递能力相对大小 热边界层于浓度边界层厚度关系6、从分子运动论的观点可知:D ∽312p T -两种气体A 与B 之间的分子扩散系数可用吉利兰提出的半经验公式估算:3241133435.71110()ABA B TD p V V μμ-=+⨯+若在压强5001.01310,273PPa T K =⨯=时各种气体在空气中的扩散系数0D ,在其他P 、T 状态下的扩散系数可用该式计算32000P T D D P T ⎛⎫= ⎪⎝⎭ (1)氧气和氮气:2233025.610/()32o V m kg kmol μ-=⨯⋅=223331.110/()28N N V m kg kmol μ-=⨯⋅=3425211523311435.7298103228 1.5410/1.013210(25.631.1)D m s --⨯⨯+⨯==⨯⨯⨯+(2)氨气和空气:51.013210P Pa =⨯ 25273298T K =+=50 1.013210P Pa =⨯ 0273T K = 3221.0132980.2()0.228/1.0132273D c m s =⨯⨯=7、解:124230.610(160005300)()0.0259/()8.3142981010A A A D N P P kmol m s RT z --⨯⨯-=-==⋅∆⨯⨯⨯ 8、解:250C 时空气的物性:351.185/,1.83510,kg m Pa s ρμ-==⨯⋅6242015.5310/,0.2210/m s D m s υ--=⨯=⨯32420006640.2510/40.08Re 2060515.531015.53100.620.2510o c P T D D m s P T u d v v S D ----⎛⎫==⨯ ⎪⎝⎭⨯===⨯⨯===⨯ 用式子(2-153)进行计算0.830.440.830.4440.0230.023206050.6270.9570.950.25100.0222/0.08m e c m m sh R S sh D h m sd -==⨯⨯=⨯⨯===设传质速率为A G ,则21122000()()()44ln 4A A A m A s A A lA m A s AA s A m A s A dG d dx h d u d du d dx h du l h ρρππρρρρρρρρρρ⋅⋅⋅⋅=-==--=-⎰⎰9、解:200C 时的空气的物性:353352244200505541.205/, 1.8110,1.013102930.22100.2410/1.0132102730.053 1.205Re 99901.81101.81100.6261.2050.2410o c kg m Pa s P T D D m s P T u dv S D ρμρμρ------==⨯⋅⎛⎫⨯⎛⎫==⨯⨯⨯=⨯ ⎪ ⎪⨯⎝⎭⎝⎭⨯⨯===⨯⨯===⨯⨯(1)用式0.830.440.023me c sh R S =计算m h 0.830.4440.02399900.6260.24100.018750.05m m sh D h d -⨯⨯⨯⨯===(2)用式13340.0395e c sh R S =计算m h134340.0395(9990)(0.626)0.24100.01621/0.05m sh D h m sd -⨯⨯===10、解:氨在水中的扩散系数921.2410/D m s -=⨯,空气在标准状态下的物性为;353591.293/, 1.7210,Pr 0.708, 1.00510/()1.721010727.741.293 1.2410p c kg m Pa s c J kg k S D ρμμρ----==⨯⋅==⨯⋅⨯===⨯⨯由热质交换类比律可得231Pr m p c h h c S ρ⎛⎫= ⎪⎝⎭ 223351P r 560.7087.0410/1.293100110727.74m p c h m s h c S ρ-⎛⎫⎛⎫==⨯=⨯ ⎪ ⎪⨯⎝⎭⎝⎭11、解:定性温度为0252022.5,2g t C +==此时空气的 物性ρυ⨯23-6=1.195kg/m ,=15.29510m /s查表得:⨯-42o D =0.2210m /s,0C 25饱和水蒸汽的浓度30.02383/v kg m ρ=33224400 1.0132980.22100.2510/1.0132273O D P T D m sP T --⎛⎫⎛⎫==⨯⨯⨯=⨯ ⎪ ⎪⎝⎭⎝⎭02220209.48/3.140.0253600 1.195360044u m sd πρ===⨯⨯⨯⨯⨯0e 9.480.025R 15488u d υ⨯===⨯-615.29510 40.25100.61c D S υ-⨯⨯===-615.29510用式(2--153)计算0.830.440.830.440.0230.023154880.6155.66,m e c sh R S ==⨯⨯= 4255.660.2410 5.56610/0.025m m sh D h m sd --⨯⨯===⨯设传质速率为A G ,则20()()()4A m A s A A d G d d x h d ud ππρρρ⋅=-=21004A A lA m A s Adu d dx h ρρρρρ⋅=-⎰⎰1204e x p ()A s AA A smh du ρρρρ⋅⋅-=- 020C 时,饱和水蒸汽的浓度30.0179/A s kg m ρ⋅=11AAd ρρρ=- 1330.003 1.195 3.5710/110.003A d kg m d ρρ-⋅⨯∴===⨯++∴ 代入上面的式子得:230.01193/A kg m ρ= 112.23/AAd g k g ρρρ==-12、解:040,C 时空气的物性ρυ⨯23-6=1.128kg/m ,=16.9610m /s 60e 210R 1.1810u lυ⨯===⨯⨯-616.9610 转折点出现在56e 510101.1810e R , 4.24R c x l m μν⨯⨯⨯===因此,对此层流---湍流混合问题,应用式(2-157)30.8(0.037870)e c LR S Sh γ=-查表2—4得,定性温度为350C时,324000.26410O D P T D P T -⎛⎫==⨯ ⎪⎝⎭2m /s40.264100.64c DS υ-⨯⨯===-616.9610360.8[0.037(1.1810)870]0.641548.9LSh γ=⨯⨯-⨯=430.288101548.9 4.4610/10mL L D h Sh m sL --⨯⎛⎫==⨯=⨯ ⎪⎝⎭每2m 池水的蒸发速率为()m A A S A n h ρρ⋅∞=-300C 时,3030.03037/;40,0.05116/A S A S kg m C kg m ρρ⋅⋅'==时()354.4610(0.030370.50.05116) 2.1410m A A S A S n h ρϕρ--⋅⋅'=-=⨯⨯-⨯=⨯13、解:在稳定状态下,湿球表面上水蒸发所需的热量来自于空气对湿球表面的对流换热,即可得以下能量守衡方程式2()s fg H O h T T h n ∞-=其中fg h 为水的蒸发潜热222()H O H O H O m Sn h ρρ⋅⋅∞=- 22()H O H O ms fg S h T T h h ρρ∞⋅⋅∞=+- 23r P 1m p c h h c S ρ⎛⎫= ⎪⋅⎝⎭又 查附录2—1,当s T =035C 时,水蒸汽的饱和蒸汽压力5808S P=于是 325808180.0408/8314308H OS S s P M kg mRT ρ⨯===⨯ 0ρ∞=14、解:2()()s H O m S h T T r n r h ρρ∞∞-=⋅=⋅-其中0026,20S t C t C ∞== 查表2—1,当20S t C =时水蒸汽的饱和蒸汽压力2330S a P P = 于是22338180.017278314293H OS S sP M kgRT ρ⨯===⨯2454.3/r kJ kg =1V d d ρρρ∞⋅==+当026t C ∞=,时定性温度为023,2st t t C ∞+==31.193/ 1.005/()p kg m c kJ kg k ρ=⋅=⋅由奇科比拟知22334r P 110.749.59101.197 1.0050.6m p c h h c S ρ-⎛⎫⎛⎫===⨯ ⎪ ⎪⋅⨯⎝⎭⎝⎭()1S s m h d T T d rh ρρ∞⋅=--+ 41.19326200.0172712454700905910d d-⨯-=-+⨯⨯ d=12.5g/kg 15、解:325100.04036/8314(27325)i CO P C kmol mRT ===+22N CO C C =222220.5N N CO N CO C x x C C ===+32254410 1.776/8314298CO iCO M P kg m RT ρ⨯⨯===⨯22220.611COCO CO Na ρρρ==+32252810 1.13/8314298N iN M P kg m RTρ⨯⨯===⨯ 20.389N a =16、解:(a )已知A M ,B M ,A x ,B xA A A A AA AB A A B B A A B B M n M x M a M M n M n M x M x M ===+++ B B B B BB A B A A B B A A B B M n M x M a M M n M n M x M x M ===+++ 已知B a ,A a ,A M ,B M AA A A A A AB A B A B A B A B m a n M M x m m a a n n M M M M ===+++ B B BB BB AB A B A B A B A B m a n M M x m m a a n n M M M M ===+++(b )222222222320.3077322844O O O O O N N CO CO x M a x M x M x M ===++++ 20.2692N a =20.4231CO a =若质量分数相等,则2222222221320.3484111322844O O O O N CO O N CO a M x a a a M M M ===++++20.3982N x = 20.2534CO x =17、解;(a )2O ,2N 的浓度梯度沿垂直方向空气由上部向下部运动: (b )2O ,2N 的浓度梯度沿垂直方向空气由下部向上部运动,有传质过程。
空气比热容标准值全文共四篇示例,供读者参考第一篇示例:空气比热容是描述空气对热量的吸收和释放能力的物理性质。
在工程领域中,空气比热容的标准值是一个重要的参数,用于计算热力系统中的能量传递,并对系统的设计和运行进行优化。
本文将介绍空气比热容的概念、影响因素以及标准值的计算方法。
一、空气比热容的概念空气比热容是描述单位质量空气在温度变化过程中所吸收或释放的热量的物理量。
它是一个重要的热力学性质,标记为Cp,单位为J/(kg·K)。
当温度升高或降低时,空气分子的平均动能也会发生变化,从而影响空气的比热容。
1. 温度:空气比热容随温度的变化而变化,一般情况下,比热容随温度的升高而增大。
2. 湿度:水汽的含量会影响空气的比热容,湿度越大,空气的比热容越小。
3. 压力:在高压下,空气分子之间的相互作用增强,导致比热容的变化。
4. 成分:空气中其他气体的含量也会对空气的比热容产生影响。
在工程计算中,常用的空气比热容标准值为1000 J/(kg·K)。
这个数值是在标准大气压下(1 atm)和室温下(20℃或293K)得出的,适用于大多数常规情况。
如果需要计算在其他条件下的空气比热容值,可以根据下面的公式进行计算:\[ Cp = 1006 + 0.00104T \]Cp为空气比热容(J/(kg·K)),T为温度(摄氏度),1006为20摄氏度下的空气比热容值,0.00104为温度变化每1摄氏度对比热容的影响。
四、应用在热力系统设计和运行中,空气比热容值的准确计算对节能和系统性能至关重要。
在空调系统设计中,需要根据空气比热容值来确定制冷或加热的能量需求,从而选择合适的设备和控制方式。
在工业生产中,熔炼、干燥等过程中也需要考虑空气比热容值的影响,以提高生产效率和质量。
空气比热容是描述空气热力学特性的重要参数,其标准值的计算方法可以帮助工程师在设计和运行过程中准确地预测能量传递和系统性能。
热力学基本状态参数功和热量1-1 工质和热力系一、工质、热机、热源与冷源1、热机(热力发动机):实现热能转换为机械能的设备。
如:电厂中的汽轮机、燃气轮机和燃机、航空发动机等。
2、工质:实现热能转换为机械能的媒介物质。
对工质的要求:1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。
如电厂中的水蒸汽;制冷中的氨气等。
问题:为什么电厂采用水蒸汽作工质?3、高温热源:不断向工质提供热能的物体(热源)。
如电厂中的炉膛中的高温烟气4、低温热源:不断接收工质排放热的物体(冷源)如凝汽器中的冷却水二、热力系统1、热力系统和外界概念热力系:人为划分的热力学研究对象(简称热力系)。
外界:系统外与之相关的一切其他物质。
边界:分割系统与外界的界面。
在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。
边界可以是实际的、假想的、固定的,或活动的。
注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。
它可以是一个设备(物体),也可以是多个设备组成的系统。
如:可以取汽轮机的空间作为一个系统,也可取整个电厂的作为系统。
2、热力系统分类按系统与外界的能量交换情况分1)绝热系统:与外界无热量交换。
2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。
注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。
这种科学的抽象给热力学的研究带来很大的方便。
如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。
状态及基本状态参数状态参数特点u状态参数仅决定于状态,即对应某确定的状态,就有一组状态参数。
反之,一组确定的状态参数就可以确定一个状态。
状态参数的变化量仅决定于过程的初终状态,而与达到该状态的途径无关。
因此,状态参数的变化量可表示为(以压力p为例):二、基本状态参数1.表压与真空表压力:当气体的压力高于大气压力时(称为正压),压力表的读数(pg),如锅炉汽包、主蒸汽的压力等。