同位素地球化学复习题
- 格式:doc
- 大小:58.50 KB
- 文档页数:8

地球化学考试复习资料第一部分课后习题及答案绪论1. 简要说明地球化学研究的基本问题。
1)地球系统中元素及同位素的组成问题;2)地球系统中元素的组合和元素的赋存形式;3)地球系统各类自然过程中元素的行为(地球的化学作用)、迁移规律和机理;4)地球的化学演化,即地球历史中元素及同位素的演化历史。
2. 简述地球化学学科的研究思路和研究方法。
1)自然过程在形成宏观地质体的同时也留下了微观踪迹,其中包括了许多地球化学信息;2)自然界物质的运动和存在状态是环境和体系介质条件的函数;3)地球化学问题必须至于地球或其其子系统中进行分析,以系统的组成和状态来约束作用的特征和元素的行为。
地球化学研究方法:反序法和类比法第一章太阳系和地球系统的元素丰度1.简述太阳系元素丰度的基本特征.1)原子序数较低的范围内,元素丰度随原子序数增大呈指数递减,而在原子序数较大的范围内(Z>45)各元素丰度值很相近。
2)原子序数为偶数的元素其丰度大大高于相邻原子序数为奇数的元素。
具有偶数质子数(A)或偶数中子数(N)的核素丰度总是高于具有奇数A 或N的核素。
3)质量数为4的倍数的核类或同位素具有较高的丰度,原子序数或中子数为“约数”(2、8、20、50、83、126等)的核类或同位素分布最广、丰度最大。
4)锂、铍、硼元素丰度严重偏低,属于强亏损的元素。
5)氧和铁元素丰度显著偏高,它们是过剩元素。
6)含量最高的元素为H、He,这两种元素的原子几乎占了太阳中全部原子数目的98%。
2.简介地壳元素丰度特征.1)地壳元素丰度差异大:丰度值最大的元素(O)是最小元素(Rn)的1017倍;丰度值最大的三种元素之和达82.58%;丰度值最大的九种元素之和达98.13%;2)地壳元素丰度的分布规律与太阳系基本相同。
与太阳系或宇宙相比,地壳和地球都明显地贫H, He, Ne, N等气体元素;而地壳与整个地球相比,则明显贫Fe和Mg,同时富集Al, K 和Na。

地球化学复习题
1. 地球化学的定义是什么?
2. 地球化学研究的主要领域有哪些?
3. 描述地球化学循环的过程。
4. 地球化学元素在地壳中的分布规律是什么?
5. 什么是地球化学异常?它在地质勘探中的作用是什么?
6. 地球化学分析的主要方法有哪些?
7. 简述地球化学在环境科学中的应用。
8. 地球化学在矿产资源勘探中如何发挥作用?
9. 什么是同位素地球化学?它在研究地球历史中的作用是什么?
10. 描述地球化学在水文学中的应用。
11. 地球化学如何帮助我们理解地球内部结构?
12. 什么是地球化学的生物地球化学循环?
13. 地球化学在农业中的应用有哪些?
14. 简述地球化学在石油和天然气勘探中的作用。
15. 地球化学在海洋科学中如何应用?
16. 描述地球化学在大气科学中的应用。
17. 地球化学如何帮助我们理解地球的气候系统?
18. 地球化学在灾害地质学中的作用是什么?
19. 什么是地球化学的热液循环?
20. 地球化学在土壤科学中的应用有哪些?
21. 地球化学如何帮助我们评估和修复污染场地?
22. 简述地球化学在材料科学中的应用。
23. 地球化学在考古学中的应用有哪些?
24. 描述地球化学在生物医学研究中的作用。
25. 地球化学在宇宙化学中的应用是什么?。

恩《地球化学》练习题第一章太阳系和地球系统的元素丰度(答案)1.概说太阳成份的研究思路和研究方法。
2.简述太阳系元素丰度的基本特征。
3.说说陨石的分类及相成分的研究意义.4.月球的结构和化学成分与地球相比有何异同?5.讨论陨石的研究意义。
6.地球的结构对于研究和了解地球的总体成分有什么作用?7.阐述地球化学组成的研究方法论。
8.地球的化学组成的基本特征有哪些?9.讨论地壳元素丰度的研究方法。
10.简介地壳元素丰度特征。
11.地壳元素丰度特征与太阳系、地球对比说明什么问题?12.地壳元素丰度值(克拉克值)有何研究意义?13.概述区域地壳元素丰度的研究意义。
14.简要说明区域地壳元素丰度的研究方法。
15.岩浆岩中各岩类元素含量变化规律如何?16.简述沉积岩中不同岩类中元素含量变化规律。
第二章元素结合规律与赋存形式(答案)1.亲氧元素和亲硫元素地球化学性质的主要差异是什么?2.简述类质同像的基本规律。
3.阐述类质同像的地球化学意义。
4.简述地壳中元素的赋存形式及其研究方法。
5.举例说明元素存在形式研究对环境、找矿或农业问题的意义。
6.英国某村由于受开采ZnCO3矿的影响,造成土壤、房尘及饮食摄入Cd明显高于其国标,但与未受污染的邻村相比,在人体健康方面两村没有明显差异,为什么?第三章自然界体系中元素的地球化学迁移(答案)1.举例说明元素地球化学迁移的定义。
2.举例说明影响元素地球化学迁移过程的因素。
3.列举自然界元素迁移的标志。
4.元素地球化学迁移的研究方法。
5.水溶液中元素的迁移形式有那些?其中成矿元素的主要迁移形式又是什么?6.解释络离子的稳定性及其在地球化学迁移中的意义。
7.简述元素迁移形式的研究方法。
8.什么是共同离子效应?什么是盐效应?9.天然水的pH值范围是多少?对于研究元素在水介质中的迁移、沉淀有何意义?10.举例说明Eh、pH值对元素迁移的影响。
11.非标准电极电位E及环境的氧化还原电位Eh,在研究元素地球化学行为方面有什么作用?12.试述影响元素溶解与迁移的内部因素。

同位素地球化学复习题1.1同位素地球化学的基本任务1)研究自然界同位素的起源、演化和衰亡历史;2)研究同位素在宇宙体、地球和各地质体中的分布分配、不同地质体中的丰度及典型地质过程中活化与迁移、富集与亏损、衰变与增长的规律;阐明同位素组成变异的原因。
据此来探讨地质作用的演化历史及物质来源;3)利用放射性同位素的衰变定律建立一套行之有效的同位素计时方法,测定不同天体事件和地质事件的年龄,并作出合理的解释,为地球和太阳系的演化确定时标。
4 )研究同位素分馏与温度的关系,建立同位素温度计,为地质体的形成与演化研究提供温标。
1.2 同位素地球化学的一些基本概念核素同位素同量异位素稳定同位素放射性同位素重稳定同位素轻稳定同位素2.1 质谱仪的基本结构四个部分:进样系统离子源质量分析器离子接收器2.2 衡量质谱仪的技术标准有哪些质量数范围分辨率灵敏度精密度与准确度2.3 固体质谱分析为什么要进行化学分离具相同质量的原子和分子离子的干扰; 主要元素基体中微量元素的稀释; 低的离子化效率; 不稳定发射。
2.5 同位素稀释法是用于元素含量分析还是用于同位素比值分析?元素含量分析2.6 氢气的制取方法?(有哪些还原剂)U-还原法Zn -还原法Mg -还原法Cr -还原法2.7 氧同位素的制样方法有哪些?1. 大量水样氧同位素制样方法?2. 硅酸盐氧同位素的BrF5法制样原理?3. 碳酸盐样品的磷酸盐制样法(McCrea法)2.8 水中溶解碳的提取与制样McCrea法2.9 硫化物硫同位素直接制样法2.10硫酸盐的硫同位素制样法(直接还原法)把硫酸盐、氧化铜、石英粉按一定比例混合(置于石英管中)在真空条件下加热到1120 ℃左右时,硫酸盐被还原而转变成二氧化硫。
2.11 了解下列质谱仪1. 热电离质谱仪(MAT260,261,262,Triton,GV354)2. 气体质谱仪(MAT251,252,253,Delta Plus,GV Isoprime 等)3. 惰性气体质谱仪,如MM1200、MI1201-IG、GV54004. MC-ICP-MS (LA-MC-ICP-MS):如Neptune 、Nu Plasma5. SHRIMP :SHRIMP II离子探针质谱本章重点? 同位素分析结果的表达方式? 稳定同位素(C、H、O、S)的国际标准? 同位素分馏基本理论–热力学分馏–动力学分馏? 分馏系数α及其与δ值之间的关系? 同位素相对富集系数(△)及其加和性? 同位素地质温度计3.1 同位素分析结果的表达方式δ‰=(R样-R标)/R标×1000=(R样/R标-1) ×1000δ‰=(R样-R标)/R标×1000=(R样/R标-1) ×10003.3 分馏系数α及其与δ值之间的关系1. 定义:αA-B= RA/RB2. 1000lnα≈△A-B=δA-δB3.4 同位素相对富集系数(△)及其加和性? 某同位素在A-B-C三种矿物中有δA>δB>δC,则△A-C= △A-B + △B-C△B-C= △A-C -△A-B△A-B= △A-C - △B-C3.5 同位素地质温度计? 同位素分馏方程1000lnα=A×106/T2+B? 同位素馏分曲线注意:分馏方程中T 为绝对温度(OK)3.5 同位素地质温度计1000lnα石英-水=3.38×106/T2 - 3.401000lnα石英-方解石=0.6×106/T21000lnαPy-Gn=1.03×106/T21000 lnαPy-Sp=0.3×106/T24. 本章重点1. 氢-氧同位素的纬度效应、大陆效应、高度效应、季节效应2. 海水的氢-氧同位素组成是多少?引起海水的δ18O和δD微小变化的原因有哪些?3. 海底火山是怎样影响局部海水同位素组成的?4. 大气降水来源的热泉水的氢氧同位素组成特征?5. 岩浆水、初生水的概念与氢氧同位素组成特征6. 火成岩的氢氧同位素组成特征、演化规律及其与矿物序列的关系?7.影响火成岩氢氧同位素组成特征的因素有哪些?8.Z=2.048(δ13C+50)+0.498(δ18O+50)是利用碳氧同位素来判别碳酸盐岩的沉积环境的判别方程,临界值是120。

地球化学复习题答案
1. 地球化学是研究什么的学科?
地球化学是研究地球及其大气层的化学组成、化学过程和化学演化的科学。
2. 什么是地壳中的元素丰度?
地壳中的元素丰度是指地壳中各种元素的相对含量,通常以质量百分比或原子百分比表示。
3. 地球化学循环包括哪些主要过程?
地球化学循环包括风化作用、侵蚀作用、搬运作用、沉积作用、成岩作用、变质作用和岩浆作用等。
4. 什么是同位素地球化学?
同位素地球化学是利用同位素的丰度变化来研究地球物质的来源、过程和历史。
5. 地球化学中如何定义岩石的类型?
岩石的类型可以根据其矿物组成、结构、构造和形成环境等特征来定义。
6. 什么是地球化学异常?
地球化学异常是指地球化学元素或同位素的分布与背景值相比显著偏离的现象,通常与矿床、油气藏等地质体的存在有关。
7. 地球化学勘探的目的是什么?
地球化学勘探的目的是通过对地表或地下样品的化学分析,发现和评价矿产资源、环境问题和地质构造等。
8. 什么是地球化学示踪?
地球化学示踪是指利用地球化学元素或同位素的特定特征来追踪物质
的来源、迁移路径和过程。
9. 地球化学中的生物地球化学循环是什么?
生物地球化学循环是指生物体与地球环境之间元素的交换和循环过程,涉及生物吸收、转化、释放和沉积等环节。
10. 地球化学研究在环境科学中有哪些应用?
地球化学研究在环境科学中的应用包括污染物的来源识别、环境风险
评估、生态系统健康监测和环境修复技术的开发等。
一、概念题(每题5分,共50分) 1、元素的丰度值 2、类质同象混入物 3、载体矿物和富集矿物 4、地球化学障 5、八面体择位能 6、戈尔德斯密特相律 7、相容元素和不相容元素 8、δCe值(列出计算公式并说明) 9、同位素分馏系数 10、衰变定律二、问答题(每题8分,共40分):1、当以下每种物质形成时,其氧化电位是高还是低?(1) 陨石;(2)煤;(3)海底锰结核;(4)钒钾铀矿;(5)页岩中的黄铁矿;(6)鲕绿泥石。
2、为什么硅酸盐矿物中K的配位数经常比Na的配位数大? (离子半径:K+的为1.38A,Na+的为1.02A,O2-的1.40A)。
3、研究表明,岩浆岩和变质岩中的不同矿物具有不同的18O/16O比值,例如岩浆岩中石英一般比钾长石具有更高的18O/16O比值,试阐明控制矿物18O/16O比值大小的原因是什么?4、用Rb-Sr或Sm-Nd法对岩石定年时,为什么当岩石矿物中的87Rb/86Sr或143Sm/144Nd比值差别越大结果越好?5、试分析下图中稀土元素球粒陨石标准化模式中各个曲线可能代表的岩石类型及造成分配型式特征的原因。
三、论述题(任选1题,10分)1、试述稀土元素数据的处理步骤和表示方法。
2、要获得准确的同位素地质年龄必须满足的条件是什么?答案:一、1.每种化学元素在自然体中的质量,占自然体总质量(或自然体全部化学元素总质量)的相对份额(如百分数),称为该元素在该自然体中的丰度值.2. 某种物质在一定的外界条件下结晶时,晶体中的部分构造位置被介质的其它质点(原子、离子、络离子、分子)所占据,结果只引起晶格常数的微小变化,而使晶体构造类型、化学键类型等保持不变的现象。
由类质同像形式混入晶体中的物质称为类质同像混入物。
含有类质同像混入物的混合晶体称为固溶体。
3. 载体矿物是指岩石中所研究元素的主要量分配于其中的那种矿物。
但有时该元素在载体矿物中的含量并不很高,往往接近该元素在有时总体中的含量。
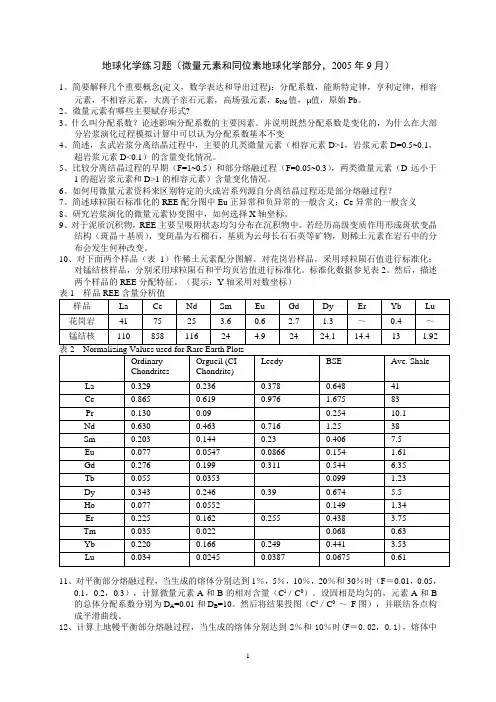
地球化学练习题(微量元素和同位素地球化学部分,2005年9月)1、简要解释几个重要概念(定义,数学表达和导出过程):分配系数,能斯特定律,亨利定律,相容元素,不相容元素,大离子亲石元素,高场强元素,εNd值,μ值,原始Pb。
2、微量元素有哪些主要赋存形式?3、什么叫分配系数?论述影响分配系数的主要因素。
并说明既然分配系数是变化的,为什么在大部分岩浆演化过程模拟计算中可以认为分配系数基本不变4、简述,玄武岩浆分离结晶过程中,主要的几类微量元素(相容元素D>1,岩浆元素D=0.5~0.1,超岩浆元素D<0.1)的含量变化情况。
5、比较分离结晶过程的早期(F=1~0.5)和部分熔融过程(F=0.05~0.3),两类微量元素(D远小于1的超岩浆元素和D>1的相容元素)含量变化情况。
6、如何用微量元素资料来区别特定的火成岩系列源自分离结晶过程还是部分熔融过程?7、简述球粒陨石标准化的REE配分图中Eu正异常和负异常的一般含义;Ce异常的一般含义8、研究岩浆演化的微量元素协变图中,如何选择X轴坐标。
9、对于泥质沉积物,REE主要呈吸附状态均匀分布在沉积物中。
若经历高级变质作用形成斑状变晶结构(斑晶+基质),变斑晶为石榴石,基质为云母长石石英等矿物,则稀土元素在岩石中的分布会发生何种改变。
10、对下面两个样品(表1)作稀土元素配分图解。
对花岗岩样品,采用球粒陨石值进行标准化:对锰结核样品,分别采用球粒陨石和平均页岩值进行标准化。
标准化数据参见表2。
然后,描述两个样品的REE分配特征。
(提示:Y轴采用对数坐标)11、对平衡部分熔融过程,当生成的熔体分别达到1%,5%,10%,20%和30%时(F=0.01,0.05,0.1,0.2,0.3),计算微量元素A和B的相对含量(C l/C0)。
设固相是均匀的,元素A和B的总体分配系数分别为D A=0.01和D B=10。
然后将结果投图(C l/C0 ~F图),并联结各点构成平滑曲线。


1、下列有关说法中正确的是()A.16O、17O、18O互为同位素B.金刚石和石墨互为同分异构体C.CH3CH2CH2CH3和CH3CH(CH3)CH2CH3互为同分异构体D.甲醇(CH3OH)、乙二醇()、丙三醇()互为同系物答案A2、下列说法正确的是()A.H2、D2、T2互称为同位素B.漂白粉、氯水是混合物,水银、明矾是纯净物C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质D.水能、风能、煤、石油、天然气都是可再生能源答案A.H2、D2、T2是氢元素形成的结构相同的单质,为同一物质,故A错误;B.漂白粉是氯化钙、次氯酸钙的混合物、氯水是氯气的水溶液是混合物,水银、明矾是纯净物,故B正确;C.HCl、BaSO4是电解质,CO2、NH3、CH3CH2OH是非电解质,Cl2既不是电解质又不是非电解质,故C错误;D.煤、石油、天然气是不可再生能源,故D错误.故选B.3、下列有关说法正确的是()A.和4互为同位素B.和是两种核素C.和4的中子数相等D.和的质量数相等答案B4、下列各组中属于同位素关系的是()A.与 B.T2O与H2OC.与 D.金刚石与石墨答案C5、下列各组的两种微粒间互为同位素的是()A.质子数12,中子数12与质子数12,中子数13 B.Mg2+与MgC.Cl-与ClD.质量数均为40的K与Ca答案A6、下列说法正确的是()A.二氧化硫、三氧化硫互为同素异形体B.氕、氘、氚互为氢元素的同位素C.碘晶体、碘蒸气是同素异形体D.H2O和D2O互为同位素答案B7、四组微粒或物质.互为同位素的是(填序号)______;互为同素异形体的是(填序号)______;有①和④的微粒可组成______种相对分子质量不同的三原子化合物.答案同位素指同一元素的不同原子,同分异构体指同一元素的不同单质;水分子是由1个氧原子和2个氢原子构成,从氢的三种同位素中选两个氢原子,两个氢原子可以相同也可不同,所以相对分子质量的和分别为2、3、4、5、6;氧原子相对分子质量分别为16、17、18,所以相对分子质量的种类数为7,故答案为:①④;③;7.8、下列互称为同位素的是()A.202Pt和198Pt B.CO和CO2C.O2和O3 D.H2O和D2O答案A9、下列说法正确的是()A.14C与14N互为同位素B.葡萄糖与果糖互为同分异构体C.H2与CH4互为同系物D.SO2与SO3互为同素异形体答案B。

地球化学复习题地球化学复习题绪论1、地球化学的定义。
答:地球化学是研究地球(包括部分天体)的化学组成、化学作用和化学演化的科学。
2、地球化学的任务。
答:1)地球及其子系统中元素及其同位素的组成,即元素的分布和分配问题;2)元素的共生组合和赋存形式;3)元素的迁移和循环;4)地球的历史和演化。
5)基础理论和应用的发展。
3、地球化学的研究思路和工作方法。
答:研究思路:以化学、物理化学等基本原理为基础,以研究原子(包括元素和同位素)的行为为手段,来认识地球的组成、历史和地球化学作用。
工作方法:野外:地质考察+样品采集(代表性、系统性、统计性、严格性)。
室内:--岩矿鉴定--分析测试:早期容量法、离子色谱法和比色法,现今X射线荧光光谱XRF、ICPAES、--ICPMS、固体质谱、AAS等。
--元素结合形式和赋存状态的研究:化学分析、晶体光学、X射线衍射、拉曼谱、微区分析(电子探针、离子探针)等。
--作用过程的物理化学条件的测定:温度(包裹体、矿物、同位素)、压力、pH、Eh、盐度等。
--自然作用的时间参数:同位素测年。
--模拟实验。
--多元统计计算和数学模型。
4、地球化学学科的特点。
答:1、基础科学成果的应用.2、地质科学的发展.3、更广泛的数字模拟。
第一章太阳系和地球系统的元素丰度1、对比元素在地壳、地球和太阳系中分布规律的异同点,并解释其原因。
答:相同点:元素的丰度均随原子系数增大而减小。
均符合奇偶定律。
不同点:与太阳系或宇宙相比,地壳和地球都明显地贫H, He, Ne, N等气体元素;而地壳与整个地球相比,则明显贫Fe和Mg,同时富集Al, K和N a。
原因:2、研究克拉克值有何地球化学意义。
答:可作为元素集中、分散的标尺。
控制元素的地球化学行为。
A)影响元素参加地壳中地球化学过程的浓度。
B)限定自然界的矿物种类及种属。
C) 限制了自然体系的状态。
3、地球各圈层化学组成的基本特征。
答:地壳:①地壳中元素的相对平均含量是极不均一的。

地球化学考试复习题目名词解释1.浓度克拉克值:概念系指某元素在某一地质体(矿床、岩体或矿物等)中的平均含量与克拉克值的比值,表示某种元素在一定的矿床、岩体或矿物内浓集的程度。
当浓度克拉克值大于1时,说明该元素在地质体中比在地壳中相对集中;小于1时,则意味着分散2.亲氧性元素:倾向于与氧形成高度离子键的元素称亲氧元素。
特征是:离子半径较小,有惰性气体的电子层结构,电负性较小。
如K、Na、Ca、Mg、Nb、Ta、Zr、Hf、REE等;易形成惰性气体型离子;3.元素的地球化学迁移:即元素从一种赋存状态转变为另一种赋存状态,并经常伴随着元素组合和分布上的变化及空间上的位移4.普通铅(或正常铅):普通铅(或正常铅):指产于U/Pb、Th/Pb比值低的矿物和岩石中任何形式的铅(如方铅矿、黄铁矿、钾长石等),在矿物形成以前,Pb以正常的比例与U、Th共生,接受U、Th衰变产物Pb 的不断叠加并均匀化。
5.不相容元素:趋向于在液相中富集的微量元素。
由于其浓度低,不能形成独立矿物相,并且因离子半径、电荷、晶场等性质与构成结晶矿物的主元素相差很大,而使其不能进入矿物相。
它们的固相/液相分配系数近于零。
6.同位素分馏系数:达到同位素交换平衡时共存相同位素相对丰度比值为常数,称分馏系数α,或者指两种物质(或物相)之间同位素比值之(α),即αA-B=RA / RB,式中A,B表示两种物质(或物相),R表示重同位素与轻同位素比值,如34S/32S,18O/16O。
α表示同位素的分馏程度,α值偏离1愈大,说明两相物质之间同位素分馏程度愈大;α=1时物质间没有同位素分馏7.K(不稳定常数):金属离子与配位体生成络合物的逆反应是络合物的解离反应,达成平衡时的常数,称为不稳定常数。
它与稳定常数互为倒数。
不稳定常数越大,络合物越不稳定。
8.δEu:反映Eu异常的强。
.9.稀土元素(REE):原子序数57-71的镧系元素以及与镧系相关密切的钪和钇共17种元素,包括:La,Ce,Pr,Nd,Pm,Sm,Eu,Gd,Tb,Dy,Ho,Er,Tm,Yb,Lu,Sc,Y10.高场强元素 (HFSE):指离子半径小、电荷高,难溶于水,地球化学性质稳定的元素,如Nb、Ta、Zr、Hf、P、Th、HREE等,它们可作为“原始”物质组成特征的指示。
1. 同位素地球化学在地学领域中的应用主要有哪些方面?(20分)同位素地球化学在解决地学领域问题的独到之处1)计时作用:每一对放射性同位素都是一只时钟,自地球形成以来它们时时刻刻地,不受干扰地走动着,这样可以测定各种地质体的年龄,尤其是对隐生宙的前寒武纪地层及复杂地质体。
2)示踪作用:同位素成分的变化受到作用环境和作用本身的影响,为此,可利用同位素成分的变异来指示地质体形成的环境条件、机制,并能示踪物质来源。
3)测温作用:由于某些矿物同位素成分变化与其形成的温度有关,为此可用来设计各种矿物对的同位素温度计,来测定成岩成矿温度。
另外亦可用来进行资源勘查、环境监测、地质灾害防治等同位素为研究地球或宇宙体的成因与演化提供了重要的有价值的信息,主要包括:地质时钟、地球热源、大气圈-海洋的相互作用、壳幔相互作用及壳幔演化、成岩成矿作用、构造作用及古气候和古环境记录等。
2. 自然界引起同位素成分变化的原因主要有哪些?(20分)自然界同位素组成经常呈现一定程度的变化。
引起同位素成分变化的主要过程有两类:一类是放射性同位素衰变,使母体同位素的数量随时间的推移逐渐减少,同时子体同位素的数量增加;另一类是由各种化学和物理过程引起的同位素分馏,氢、碳、硫、硅、氮等同位素组成变化主要是由同位素分馏引起的。
1、放射性衰变:放射性同位素经过自然衰变,转变为其它元素的同位素,结果母元素同位素不断减少,而子元素同位素不断增加,从而改变着母元素和子元素同位素的成分,它是放射性核素原子核的一种特性,不受外界物化条件的影响。
1)α—衰变: 放射性母核放出α粒子(α粒子由两个质子和两个中子组成,α粒子实际上是):2)β衰变自然界多数为β—衰变,即放射性母核中的一个中子分裂为1个质子和1个电子(即β—粒子),同时放出反中微子,通式为:衰变结果,核内减少1个中子,增加1个质子,新核的质量数不变,核电荷数加1,变成周期表上右侧相邻的新元素。
同位素、同系物、同素异形体、同分异构体的辨析判断1.某陨石中含有半衰期极短的镁的一种放射性同位素2812Mg,该同位素原子的核内中子数是( )A.4B.12C.16D.18答案 C解析中子数=质量数-质子数,2812Mg原子的核内中子数是28-12=16,C正确。
2.131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来监测核电站是否发生放射性物质泄漏。
下列有关131 53I的叙述中错误的是( )A.131 53I的化学性质与127 53I相同B.131 53I的原子序数为53C.131 53I的原子核外电子数为78D.131 53I的原子核内中子数多于质子数答案 C解析131 53I与127 53I质子数相同,中子数不同,互为同位素,化学性质几乎完全相同,物理性质有差别,A正确;原子符号A Z X左下角数字代表质子数,131 53I的质子数为53,原子序数为53,B正确;131 53I是电中性原子,质子数等于原子核外电子数,为53,C错误;131 53I的质子数为53,中子数=131-53=78,中子数多于质子数,D正确。
3.有以下六种原子:63Li、73Li、2311Na、2412Mg、14 6C、14 7N,下列相关说法不正确的是( )A.63Li和73Li在元素周期表中所处的位置相同B.14 6C和14 7N质量数相等,二者互为同位素C.2311Na和2412Mg的中子数相同但不属于同种元素D.73Li的质量数和14 7N的中子数相等答案 B解析63Li和73Li互为同位素,在元素周期表中所处的位置相同,A正确;14 6C和14 7N质量数相等,都是14,但属于两种元素,不是同位素,B错误;2311Na和2412Mg的中子数相同,都是12,属于两种元素,C正确;73Li的质量数为7,14 7N的中子数为14-7=7,二者相等,D正确。
4.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。
Sm-Nd同位素测年Nd和Sm属于轻稀土元素,其中Nd的不相容性大于Sm. Nd3+离子半径为0.108nm,Sm3+为0.104nm。
由于Sm和Nd的化学性质很相似,因此在地质过程中Sm和Nd不会发生明显的分离。
地球上岩石和矿物的Sm/Nd比值仅变化于0.1到0.5之间。
由地幔或地壳岩石部分熔融形成的硅酸盐熔体中,Nd相对于Sm发生富集,地壳起源熔体的Sm/Nd比值一般低于上地幔起源熔体的Sm/Nd比值。
在岩浆分离结晶过程中,残余岩浆中Nd相对于Sm也发生富集, 随岩浆分异程度增大,残余熔体中Sm和Nd含量升高,Sm/Nd比值有所下降。
一、钐-钕地球化学Sm和Nd是稀土元素,存在于许多造岩矿物中,如硅酸盐、磷酸盐和碳酸盐矿物中。
钐有七种天然同位素,它们的质量数和同位素丰度分别为:143Sm 3.16%,147Sm 15.07%, 148Sm 11.27%,149Sm 13.84%,150Sm 74.7%,152Sm 26.63%, 154Sm22.53%。
钕也有七种天然同位来,其质量数和同位素丰度分别为:142Nd 27.13%, 143Nd2.20% , 143Nd 23.87%, 145Nd 8.30%, 146Nd 17.18%, 148Nd5.72%, 150Nd 5.6%。
147Sm 通过 a 放射,衰变为143Nd,衰变常数为:6.54×10-12a-1,半衰期为: 1.06×1011a。
Sm-Nd等时线测年的基本公式为:(143Nd/144Nd)样品=(143Nd/144Nd)i +(147Sm/144Nd)样品(eλt-1)。
其中(147Sm/144Nd)样品(eλt-1)为直线的bX项,斜率b=eλt-1 ,t=1/λ·ln(b+1)。
Sm-Nd法适合于基性、超基性火成岩的定年,而Rb-Sr法更适合于酸性、中酸性火成岩的定年。
更重要的是REE在变质作用、热液作用和化学风化作用中比Rb、Sr稳定的多。
同位素知识点训练专题及详细解答1、由16O、17O 、18O 、11H 、21H 、31H 六种原子,可以构成双氧水分子,其种类有种。
2、有H、D、T 三种原子,它们之间的关系是,(1)在标况下,它们的单质的密度之比是,(2)1mol各单质中,它们的质子数之比是,中子数之比;(3)1g各单质中,它们的质子数之比是,中子数之比;(4)在标况下,1L各单质中,它们的电子数之比。
3、氯有两种同位素3517Cl 和3717Cl ,已知3517Cl 和3717Cl的原子个数比为3∶1,则氯气的相对分子质量分别为70、72、74的单质分子个数比为()A、6∶6∶1 B、3∶3∶1C、6∶3∶1D、9∶3∶14、某元素M所形成的气态分子M2有三种,其相对分子质量分别为70、72、74,它们的分子数之比9∶6∶1,下列判断正确的是()A、M元素有三种同位素B、M的一种同位素原子的质量数为36 C、质量数为35的同位素占的原子个数百分比为75% D、M2的平均相对分子质量为725、铜有两种天然同位素6329Cu 和6529Cu ,参考铜的相对原子质量(63.5),估算6329Cu的百分含量约是()A、20% B、25%C、50%D、75%6、硼元素的近似平均相对原子质量为10.8,则硼在自然界的两种同位素105B 和115B的原子个数比为()A、1∶1B、1∶2C、1∶3D、1∶47、溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数为35,相对原子质量为80,则溴的这两种同位素的中子数分别为()A、79、81 B、45、46C、44、46D、34、368、由2311Na分别跟3517Cl和3717Cl所构成的10g氯化钠中含3717Cl的质量为()A、1.14gB、1.58gC、1.52gD、1.49g9、已知3517Cl的相对原子质量是34.969,丰度为75.77% , 3717Cl的相对原子质量是36.966, 丰度为24.23% ,求:氯元素的平均相对原子质量及近似相对原子质量10、K35ClO 3与K37Cl 在酸性溶液中反应生成氯气,则该氯气的平均相对分子质量为 ( )A.70.7B.71.0C.72.0D.73.3解析部分: 1、[答案]36。
1. 同位素地球化学在地学领域中的应用主要有哪些方面?(20分)同位素地球化学在解决地学领域问题的独到之处1)计时作用:每一对放射性同位素都是一只时钟,自地球形成以来它们时时刻刻地,不受干扰地走动着,这样可以测定各种地质体的年龄,尤其是对隐生宙的前寒武纪地层及复杂地质体。
2)示踪作用:同位素成分的变化受到作用环境和作用本身的影响,为此,可利用同位素成分的变异来指示地质体形成的环境条件、机制,并能示踪物质来源。
3)测温作用:由于某些矿物同位素成分变化与其形成的温度有关,为此可用来设计各种矿物对的同位素温度计,来测定成岩成矿温度。
另外亦可用来进行资源勘查、环境监测、地质灾害防治等同位素为研究地球或宇宙体的成因与演化提供了重要的有价值的信息,主要包括:地质时钟、地球热源、大气圈-海洋的相互作用、壳幔相互作用及壳幔演化、成岩成矿作用、构造作用及古气候和古环境记录等。
2. 自然界引起同位素成分变化的原因主要有哪些?(20分)自然界同位素组成经常呈现一定程度的变化。
引起同位素成分变化的主要过程有两类:一类是放射性同位素衰变,使母体同位素的数量随时间的推移逐渐减少,同时子体同位素的数量增加;另一类是由各种化学和物理过程引起的同位素分馏,氢、碳、硫、硅、氮等同位素组成变化主要是由同位素分馏引起的。
1、放射性衰变:放射性同位素经过自然衰变,转变为其它元素的同位素,结果母元素同位素不断减少,而子元素同位素不断增加,从而改变着母元素和子元素同位素的成分,它是放射性核素原子核的一种特性,不受外界物化条件的影响。
1)α—衰变: 放射性母核放出α粒子(α粒子由两个质子和两个中子组成,α粒子实际上是):2)β衰变自然界多数为β—衰变,即放射性母核中的一个中子分裂为1个质子和1个电子(即β—粒子),同时放出反中微子,通式为:衰变结果,核内减少1个中子,增加1个质子,新核的质量数不变,核电荷数加1,变成周期表上右侧相邻的新元素。
同位素地球化学复习题1.1同位素地球化学的基本任务1)研究自然界同位素的起源、演化和衰亡历史;2)研究同位素在宇宙体、地球和各地质体中的分布分配、不同地质体中的丰度及典型地质过程中活化与迁移、富集与亏损、衰变与增长的规律;阐明同位素组成变异的原因。
据此来探讨地质作用的演化历史及物质来源;3)利用放射性同位素的衰变定律建立一套行之有效的同位素计时方法,测定不同天体事件和地质事件的年龄,并作出合理的解释,为地球和太阳系的演化确定时标。
4 )研究同位素分馏与温度的关系,建立同位素温度计,为地质体的形成与演化研究提供温标。
1.2 同位素地球化学的一些基本概念核素同位素同量异位素稳定同位素放射性同位素重稳定同位素轻稳定同位素2.1 质谱仪的基本结构四个部分:进样系统离子源质量分析器离子接收器2.2 衡量质谱仪的技术标准有哪些质量数范围分辨率灵敏度精密度与准确度2.3 固体质谱分析为什么要进行化学分离具相同质量的原子和分子离子的干扰; 主要元素基体中微量元素的稀释; 低的离子化效率; 不稳定发射。
2.5 同位素稀释法是用于元素含量分析还是用于同位素比值分析?元素含量分析2.6 氢气的制取方法?(有哪些还原剂)U-还原法Zn -还原法Mg -还原法Cr -还原法2.7 氧同位素的制样方法有哪些?1. 大量水样氧同位素制样方法?2. 硅酸盐氧同位素的BrF5法制样原理?3. 碳酸盐样品的磷酸盐制样法(McCrea法)2.8 水中溶解碳的提取与制样McCrea法2.9 硫化物硫同位素直接制样法2.10硫酸盐的硫同位素制样法(直接还原法)把硫酸盐、氧化铜、石英粉按一定比例混合(置于石英管中)在真空条件下加热到1120 ℃左右时,硫酸盐被还原而转变成二氧化硫。
2.11 了解下列质谱仪1. 热电离质谱仪(MAT260,261,262,Triton,GV354)2. 气体质谱仪(MAT251,252,253,Delta Plus,GV Isoprime 等)3. 惰性气体质谱仪,如MM1200、MI1201-IG、GV54004. MC-ICP-MS (LA-MC-ICP-MS):如Neptune 、Nu Plasma5. SHRIMP :SHRIMP II离子探针质谱本章重点? 同位素分析结果的表达方式? 稳定同位素(C、H、O、S)的国际标准? 同位素分馏基本理论–热力学分馏–动力学分馏? 分馏系数α及其与δ值之间的关系? 同位素相对富集系数(△)及其加和性? 同位素地质温度计3.1 同位素分析结果的表达方式δ‰=(R样-R标)/R标×1000=(R样/R标-1) ×1000δ‰=(R样-R标)/R标×1000=(R样/R标-1) ×10003.3 分馏系数α及其与δ值之间的关系1. 定义:αA-B= RA/RB2. 1000lnα≈△A-B=δA-δB3.4 同位素相对富集系数(△)及其加和性? 某同位素在A-B-C三种矿物中有δA>δB>δC,则△A-C= △A-B + △B-C△B-C= △A-C -△A-B△A-B= △A-C - △B-C3.5 同位素地质温度计? 同位素分馏方程1000lnα=A×106/T2+B? 同位素馏分曲线注意:分馏方程中T 为绝对温度(OK)3.5 同位素地质温度计1000lnα石英-水=3.38×106/T2 - 3.401000lnα石英-方解石=0.6×106/T21000lnαPy-Gn=1.03×106/T21000 lnαPy-Sp=0.3×106/T24. 本章重点1. 氢-氧同位素的纬度效应、大陆效应、高度效应、季节效应2. 海水的氢-氧同位素组成是多少?引起海水的δ18O和δD微小变化的原因有哪些?3. 海底火山是怎样影响局部海水同位素组成的?4. 大气降水来源的热泉水的氢氧同位素组成特征?5. 岩浆水、初生水的概念与氢氧同位素组成特征6. 火成岩的氢氧同位素组成特征、演化规律及其与矿物序列的关系?7.影响火成岩氢氧同位素组成特征的因素有哪些?8.Z=2.048(δ13C+50)+0.498(δ18O+50)是利用碳氧同位素来判别碳酸盐岩的沉积环境的判别方程,临界值是120。
你能判断Z>120是属于海相还是属于淡水相吗?4.9 成矿温度、成矿液体的氧同位素值已知1000lnα石英-水=3.38×106/T2-3.401000lnα方解石-水=2.78×106/T2-3.40计算成矿温度、成矿液体的氧同位素值。
4.10 如何获得成矿热液的氢-氧同位素组成流体包裹体直接测定法二、同位素平衡温度计算法即根据矿物-水的平衡分馏方程由矿物的氢氧同位素组成计算成矿溶液的氢氧同位素组成4.11 甲烷碳同位素组成与母岩成熟度的关系?由于有机母质上的CH2D官能团内C-C键的亲和力要比CH3官能团内C-C键的强,所以只有在热力增强的条件下才可使C-CH2D键断开,这使得甲烷在成熟度增加时氘的浓度也会相对富集4.12 在甲烷同系物烷类气中,热解成因的烃类气分子的δD值随其碳数的增加而变化的规律是什?在甲烷同系物烷类气中,热解成因的烃类气分子的δD值随其碳数的增加而增大,即:δDCH4<δDC2H6<δDC3H8< δDC4H105.1 稳定碳同位素的比值是哪两个同位素R=13C/12Cδ13C=(R样品/R标准-1)×1000 国际标准:PDB5. 3 是氧化型的碳富集13C还是还原型碳富集13C (氧化型的)5.4 大气中的CO2的δ13C平均值是多少,海相碳酸盐岩的δ13C大约是多少5.5 海相碳酸盐和淡水碳酸盐哪个更富集13C海相和非海相碳酸盐岩的碳同位素组成的这种差异要能主要是由沉积环境的不同所引起。
在非海相碳酸盐形成过程中,土壤中的有机质不断进入沉积盆地,使沉积盆地12C浓度相对增加。
5.6 变质作用会使碳酸盐岩的碳同位素组成更富集12C还是13C?在变质反应过程中,释放出的CO2优先富集13C,从而使形成的碳酸盐矿物相对富12C。
据估计,CO2中13C比方解石中高6‰左右。
5.7 解读“δ13C等值线以及方解石和石墨的稳定场与热液物理化学条件的关系” 图(即log f O2-pH 相图)5.8 控制海水碳同位素组成的主要因素是什么?说明理由。
? 有机碳库与无机碳库的相对比例:由于有机质优先富集12C,生物的大量绝灭将导致沉积物中有机质埋藏率的增加,从而使海洋沉积物中δ13C的值降低,相反,当生物出现复苏和大规模繁盛时,较轻的12C加入到有机质中,海洋沉积物中有机碳δ13C的值将会升高。
? 构造运动将深部贫13C的“毒化”水带至表层水,两种海水混合后以无机碳酸盐的形式沉淀下来? 海平面下降,导致陆地和大陆架大面积暴露,有机碳的氧化强度增加? 冰川作用,导致海平面升降,改变海洋和大陆架的生态环境,使生物发生集群绝灭5. 10 海相有机碳和陆相有机碳哪个更富集12C?? 海相沉积有机碳的δ13C值为-20‰左右,淡水沉积有机碳的平均δ13C值为-25 ‰左右,有的甚至低达-30‰。
5. 12 什么是原油碳同位素类型曲线?有什么意义?? 原油中所含的分子具有完全不同的结构,其中最重要的类型有饱和烃、芳烃、非烃和沥青质,它们的同位素组成差异明显。
由原油中这些组分的碳同位素组成按一定顺序排列构成的曲线叫原油类型曲线。
5. 14 在天然气中,甲烷及其同系物的同位素组成与成熟度的关系是什么?? 甲烷的δ13C值都随有机母质热成熟度的增加而增大。
5.1有机成因的甲烷同系物碳同位素变化规律是什么?无机成因的天然气又是什么规律?油型气:δ13C1<δ13C2<δ13C3<δ13C4煤型气:δ13C1<δ13C2<δ13C3<δ13C4无机成因:δ13C1>δ13C2>δ13C3>δ13C45. 16 油型气与煤型气中甲烷同系物的碳同位素的区别?(答案同上)6. 1 写出δ34S的表达式R=34S/32Sδ34S=(R样品/R标准-1)×1000 国际标准:CDT6. 2 硫同位素平衡分馏的价态规则与矿物序列。
矿物序列;34S富集系列形成主要取决矿物的晶体化学性质,化学键的特点,金属-硫的键合强度越大,矿物越富集34S。
Ü 对硫化物矿物δ34S:辉鉍矿(Bi2S3)<辉锑矿(Sb2S3)<辉铜矿(Cu2S)<方铅矿(PbS)<斑铜矿(Cu5FeS4)<黄铜矿(CuFeS2)<闪锌矿(ZnS)<黄铁矿(FeS2)<辉钼矿(MoS2)价态规则;氧化态富重硫,还原态富轻硫,同位素交换平衡时含硫化合物中34S的富集序列为:SO42->SO32->SO2>SCO>Sx≈H2S≈HS->S2-。
在平衡条件下,两种含硫化合物中硫的氧化态差别越大,它们的同位素分馏系数越大。
6. 3 细菌还原作用形成的硫的同位素组成有什么特征?有两个明显的特征:①还原形成的硫化氢或硫化物中32S的富集明显超过原始硫酸盐,δ34S通常为负值;②硫化氢或硫化物32S的富集随还原程度而变化,表现为δ34S具有大的波动范围6. 4 影响有机还原作用形成的H2S 的硫同位素组成的因素有哪些?①温度②反应速度③反应物消耗程度④酶的作用6. 5 影响岩浆岩中硫同位素组成的因素岩浆源区的物质成分;岩浆结晶分异作用;同化混染作用6. 6陨石、海水、地幔硫的同位素δ34S分别是多少?0左右20.0‰左右 0左右6. 7 沉积岩的硫同位素组成特征是什么?变化范围大;分布弥散;相对富集32S同位素;这是硫在自然界经历生物循环的重要标志。
6. 8试论述体系的开放性与还原作用形成的H2S的硫同位素组成的关系。
1. 对反应物与产物都是开放的;2. 对产物是开放的,对反应物是封闭的;3. 对产物和反应物都是封闭的6. 9 影响热液矿床中硫化物硫同位素组成的因素有哪些?f (δ34Si)=f (δ34SΣ, I, T, pH, f O2)6. 10解读闪锌矿-重晶石体系中log f O2-pH-δ34S图解6. 11热液系统中总硫同位素组成的确定1. 物理-化学平衡法(IgfO2-pH-δ34Si)2. 矿物共生组合比较法(这是根据矿物沉淀的化学环境来估计成矿溶液的总硫同位素组成的方法)3. 平克尼(pinckney)和拉芙特(Rafter)法6. 12 硫同位素温度计的应用已知1000lnα黄铁矿-闪锌矿=0.356×106/T2+0.021000lnα闪锌矿-方铅矿=0.963×106/T2-0.57写出黄铁矿-方铅矿的硫同位素分馏方程(1000lnα黄铁矿-方铅矿=??)7.1 主要放射性衰变形式α;β;电子捕获(K层捕获)7.2放射性衰变定律及年龄计算公式△N∝N?△tN/N0=e-λt或N=N0e-λt(4)Dr = N eλt –N=N(eλt-1) (7)7.3半衰期及计算公式(半衰期与衰变常数的换算关系)半衰期(Half-life) :母核衰变为其原核数的一半所经历的时间,用T1/2表示。