一次盐水中钙镁离子含量超标的影响因素
- 格式:pdf
- 大小:2.58 MB
- 文档页数:4

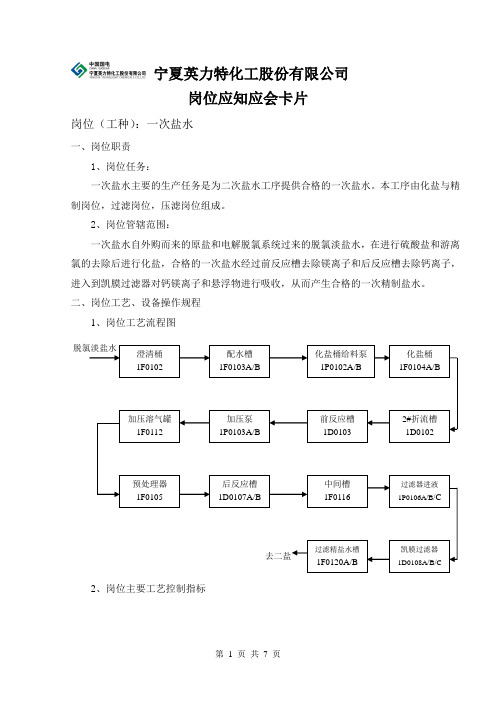
宁夏英力特化工股份有限公司岗位应知应会卡片岗位(工种):一次盐水一、岗位职责1、岗位任务:一次盐水主要的生产任务是为二次盐水工序提供合格的一次盐水。
本工序由化盐与精制岗位,过滤岗位,压滤岗位组成。
2、岗位管辖范围:一次盐水自外购而来的原盐和电解脱氯系统过来的脱氯淡盐水,在进行硫酸盐和游离氯的去除后进行化盐,合格的一次盐水经过前反应槽去除镁离子和后反应槽去除钙离子,进入到凯膜过滤器对钙镁离子和悬浮物进行吸收,从而产生合格的一次精制盐水。
二、岗位工艺、设备操作规程1、岗位工艺流程图2、岗位主要工艺控制指标澄清桶1F0102 配水槽1F0103A/B 化盐桶给料泵1P0102A/B 化盐桶1F0104A/B2#折流槽1D0102前反应槽1D0103 凯膜过滤器1D0108A/B/C 脱氯淡盐水 加压溶气罐1F0112 预处理器1F0105 后反应槽1D0107A/B 中间槽1F0116 过滤器进液1P0106A/B/C过滤精盐水槽1F0120A/B 加压泵1P0103A/B 去二盐一次盐水主要工艺控制指标一览表序号指标名称控制范围检测频次检测方法检测地点1 化盐池出口温度50-65℃随时温度计化盐池2 化盐桶出口NaCl浓度310土5g/L 1次/4小时滴定分析前反应槽3 化盐桶出口SO42-含量<5g/L 1次/4小时滴定分析前反应槽4 加压泵出口NaOH含量0.4-0.6g/L 1次/4小时滴定分析加压泵5 预处理器出口Mg2+含量<0.3mg/L 1次/4小时滴定分析预处理器6 后反应器出口Na2CO3含量0.4-0.6g/L 1次/4小时滴定分析后反应槽7 过滤器出口Ca2+ +Mg2+含量<7mg/L 1次/4小时滴定分析过滤器3、岗位主要设备操作规程:3.1膜过滤器操作规程3.1.1主要技术规格:型号:HVM-80- CS/R-TM3.1.2、设备参数:过滤面积80m2过滤压力≤0.15Mpa 最高工作温度<60℃设备容积5.6m3 设备自重4200 Kg 直径及高度 1.80*4.8m3.1.3、过滤系统工作原理:(1)结构:过滤器由罐体,反冲罐,管道,自动控制阀,过滤元件,自动控制系统,气动控制系统等组成。

水质分析化验方法之钙镁离子的测定方法在日常生活中,我们经常见到水壶用久后内壁会有水垢生成。
这是什么原因呢?原来在我们取用的水中含有不少无机盐类物质,如钙、镁盐等。
这些盐在常温下的水中肉眼无法发现,一旦它们加温煮沸,便有不少钙、镁盐以碳酸盐形成沉淀出来,它们紧贴壶壁就形成水垢。
我们通常把水中钙、镁离子的含量用“硬度”这个指标来表示。
为何要进行钙镁离子的测定?钙镁离子过多,对氟暴露人群血清碱性磷酸酶的人会造成影响。
但钙镁离子是人体每天必需的营养素,水垢就是钙镁化合物,通过饮水可以补充一定量的钙镁离子。
但如果是长期服用含钙.镁离子太高的水可能导致一些疾病.据科学家考证.在水硬度较高地区,人群心血管疾病发病率较低,但肾结石发病率却随水的硬度升高而升高。
我国南方多为软水,北方地区多为硬水。
我国饮用水规定的标准是不能超过25度,最适宜的饮用水的硬度为8—18度,属于轻度或中度硬水。
钙镁离子的测定方法一、钙离子的测定1、EDTA滴定法(1)原理溶液PH≥12时,水样中的镁离子沉淀为Mg(O H)2,这时用EDTA滴定,钙则被EDTA完全络合而镁离子则无干扰。
滴定所消耗EDTA的物质的量即为钙离子的物质的量。
(2)主要试剂①氢氧化钾溶液 20%;②EDTA标准溶液 C(EDTA)=0.01mol/L;③钙黄绿素-酚酞混合指示剂(3)测定步骤用移液管移取水样50ml(必要时过滤后再取样)于250ml锥形瓶中,加1+1盐酸数滴,混匀,加热至沸30s,冷却后加20%氢氧化钾溶液5ml,加少许混合指示剂,用EDTA标准溶液滴定至由黄绿色荧光突然消失并出现紫红色时即为终点,记下所消耗的EDTA标准溶液的体积。
钙离子的含量X为式中 C(EDTA)——EDTA 溶液的浓度,mol/L;V2——滴定时消耗EDTA溶液的体积,ml;V——所取水样的体积,ml;40.08——钙离子的摩尔质量,g/mol..二、镁离子的测定1、EDTA滴定法(1)原理由硬度测定时得到的钙离子和镁离子的总量,减去由本节中测得的钙离子的含量即得镁离子的含量。

原盐质量的影响因素及提高路径初探摘要:盐矿或天然盐湖中开采出来以及盐田晒制湖盐、岩盐等均被称为原盐,原盐没有经过人工处理,主要成分是氯化钠物质,有少量可溶性的镁盐、钙盐和不溶性的泥沙夹杂其中。
作为化工之母,原盐生产的质量优劣直接关系到化工工业的生产水平,因而在原盐生产制造中需要加强管理、不断改良工艺,提高生产质量。
本篇文章在此基础上,主要对原盐质量的影响因素以及提高原盐质量的方法和路径进行研究与分析。
关键词:原盐质量影响因素提高路径分析原盐是纯碱和烧碱主要原料之一,对于无机化工工业生产具有重要作用。
生产原盐的方法主要有四种,即地下开采或露天开采、盐湖开采、盐田晒制和人工提取等,其中岩盐地下开采应用的是溶浸法,人工提取原盐是从天然卤水中应用真空蒸法熬煮或制取。
生产原盐的过程中需要对其质量影响要素进行综合性分析,通过有效的改进措施不断改良原盐生产工艺与流程,提高原盐质量。
针对原盐质量的影响因素及提高路径需要从实际分析的角度展开研究与探讨。
一、影响原盐生产质量的主要因素(一)钙镁离子含量指标过高原盐的主要成分是氯化钠物质,因而主要的物质组成为氯离子和钠离子,但是部分原盐如岩盐中含有少量的钙盐和镁盐等矿物质盐,随着我国原盐开采和提取工艺技术水平的不断进步,原盐生产量加大,但是其中的质量问题也不断凸显,其中原盐钙镁离子含量超标问题相对较严重。
原盐中含有较高含量的杂质,不溶物含量较多主要是因为原盐制取中应用的池板不平或结晶性的池盐层较薄,或者是在收盐的过程中将地板上的泥沙机械性的扒起。
原盐中的洗盐机料中混入了大小不同的泥块也会导致其中掺入较多杂质,另外在洗盐工序中由于对洗盐水的沉淀不合格,盐水不清导致清水洗盐的标准不够,影响原盐质量。
[1]原盐中钙离子含量超标是因为缺乏饱和卤水,结晶池工艺落实不足,池中析出的硫酸钙物质较多;原盐中含有较多镁离子是因为老卤水在分晒过程中回头现象明显,饱和的洗盐卤水不是新赶制的,影响洗盐效果。

离子交换除盐系统出水水质超标原因分析与处理摘要:针对离子交换除盐系统混床出水电导率超标问题,对锅炉补给水处理系统进行全面分析,确定混床出水电导率超标的原因是原水中携带的有机物未被有效去除和阳床树脂被氧化分解产生的有机物污染了阴床树脂,在更换阳床树脂、复苏阴床树脂后,除盐水系统恢复正常。
同时就异常原因提出改进措施,为保障离子交换除盐系统的安全运行提供参考。
关键词:离子交换除盐系统;电导率;有机物污染;树脂氧化前言水汽系统中含有的杂质是引起热力设备腐蚀、结垢和积盐等故障的主要根源[1]。
锅炉补给水是水汽系统污染的主要源头,补给水质量的控制对水汽品质至关重要[2]。
《燃气-蒸汽联合循环发电厂化学监督技术导则》(DL/T 1717-2017)中对燃气-蒸汽联合循环机组运行中的给水和水汽质量提出了严格的要求。
我国工业水处理技术中关于除去水中离子杂质的研究成果较多,离子交换、反渗透、电渗析都是较常使用的方法,其中应用最广泛的是离子交换法[3]。
离子交换除盐系统在运行过程中经常会出现各种故障,造成出水水质变差,若故障未能够及时得到有效的解决,会造成极大的安全生产隐患。
因此,分析离子交换除盐系统的故障原因和处理措施具有重要意义[4]。
1 水处理系统概况锅炉补给水系统设计处理工艺为运河水→2×300t/h沉淀池混凝澄清→2×320t/h 空气擦洗滤池过滤→化学水池→4×75t/h多介质过滤器→3×110t/h阳离子交换器→除二氧化碳器→中间水箱→3×110t/h阴离子交换器→3×110t/h混合离子交换器→除盐水箱。
离子交换设备为2运1备,阳离子交换器使用001×7型强酸阳离子交换树脂,阴离子交换器使用D202-II型强碱阴离子交换树脂,混合离子交换器使用001×7MB型强酸阳离子交换树脂和201×7MB型强碱阴离子交换树脂。

盐卤制取精盐水过程中两碱法脱除钙镁的探讨发布时间:2023-03-03T06:37:18.686Z 来源:《中国科技信息》2022年10月19期作者:单士全[导读] 由于在盐卤制取精盐水过程中,钙镁离子含量对制取精盐水影响较大单士全中盐淮安鸿运盐化有限公司江苏淮安 223000摘要:由于在盐卤制取精盐水过程中,钙镁离子含量对制取精盐水影响较大,若不能对水中钙镁离子含量进行精确的检测,则无法对生产过程进行有效的调控。
尤其是当盐水中钙、镁离子含量高时,钙、镁离子进入电解槽内会形成碳酸钙、氢氧化镁等沉积物,造成薄膜的阻塞,导致槽液压力升高,为了保证生产的顺利进行,应对精制盐水中钙镁离子含量进行及时、精确的测定。
本文通过烧碱-纯碱技术来对盐卤制取精盐水中脱除以及进行了分析和研究,通过实验结果我们能够了解到,硫酸钠组分对的去除作用显著,低于30g/L时,的去除效率大于90%,而提高硫酸钠的浓度对的去除作用很小。
氯化钠组分对和的去除作用的作用不大,氯化钠含量越高,脱除效果较好,但是会使脱除率减少。
关键词:盐卤制取;精盐水;两碱法;脱除钙镁目前我国盐卤资源十分丰富,例如:日晒制盐卤水、井矿卤水、盐湖卤水,是一种以真空制盐为主的盐类产品。
不论是盐型卤水、芒硝卤水、石灰水,都含有一定的钙、镁、硫酸等杂质,它们不但会对盐类制品的质量和一次电解水的质量造成一定的不利,而且会使加热器列管的内部出现污物,从而造成换热和危害。
在使用膜法处理技术进行盐卤水时,由于钙、镁类等杂质的浓度太高,会导致膜表面产生污物,从而造成膜孔的阻塞。
所以,在使用盐卤工艺之前,通常需要经过纯化处理,现有的方法主要是通过化学沉淀法去除含钙、镁的方法,例如:石灰-纯碱法、烧碱—纯碱法、石灰—硫酸钠—烟道气等,而石灰-纯碱法很容易使体系中的新的可溶性或不溶性物质进入系统中。
“石灰-硫酸钠-烟气”与“石灰-纯碱”工艺相同,由于加入了大量的新的杂质,导致了大量的纯碱使用量、大量的钙镁泥沙,使得该工艺过程繁琐,投入高,但是生产费用低廉;采用“烧碱-纯碱”生产工艺简便易行,且生产费用低廉,且钙镁泥用量小,特别适合于含钙量比较小的盐型卤水的净化处理。
一次盐水钙镁离子的去除及指标优化控制(氯碱分厂作者:郭保平1 一次盐水工艺简介盐业公司采集的地下卤水(NaCl的质量浓度为300-310g/l)进入两个9600m3的卤水池,由离心泵输送至卤水换热器使其与电解返回的淡盐水换热,在换热器出口管道中加入NaOH和NaClO后进入卤水高位槽,由卤水高位槽溢流至氨吹除塔,用空气法除氨后进入化盐水储槽。
再由离心泵送到化盐水换热器将卤水温度调节到55-65℃后进入化盐池,化盐池自流进入2#折流槽(如果卤水NaCl浓度达到要求也可直接进入2#折流槽折流槽),在2#折流槽中加入NaOH和NaClO后进入粗盐水搅拌池,搅拌后由加压泵送至加压溶气罐,通过文丘里混合器(加入FeCl3溶液)后进入预处理器,经反应槽(加入Na2CO3溶液)除杂后经缓冲罐进入凯膜过滤器。
精制合格的盐水进入3#折流槽,并向折流槽中加入Na2SO3除去微量的游离氯后进入一次盐水储罐,再由一次盐水泵送至二次盐水及电解工序使用。
2 钙镁离子的去除2.1钙镁离子对后续工序的影响如果盐水中的Ca2+、Mg2+不除去,或者去除达不到指标要求则会增加二次盐水工序的树脂塔的工作负荷,使树脂塔的再生频率增加,并且如果Ca2+、Mg2+过多的话则不能通过树脂塔除尽,在电解过程中Ca2+、Mg2+将与阴极电解产物氢氧化钠发生化学反应,生成氢氧化镁及氢氧化钙沉淀,不仅消耗生成的碱,而且这些沉淀物会堵塞离子膜孔隙,降低离子膜的渗透性,导致电流效率下降,槽电压升高,破坏电解槽的正常运行。
2.2镁离子的去除Mg2+的去除是在2#折流槽中加入质量分数为32%液态NaOH碱,反应瞬间即可完成,为使Mg2+反应完全,常使液碱加入量大于理论反应所需量,离子方程式为Mg2++2OH-=Mg(OH)2 。
Mg(OH)2为絮状沉淀不易通过沉降除去,首先让粗盐水通过加压容器罐,罐内保持0.18~0.3MPa(一般0.22~0.24 MPa效果为最佳)的压力,在压力作用下使粗盐水溶解一定量的空气,当粗盐水进入预处理器后压力突然下降,粗盐水中的空气析出,产生大量细微气泡,气泡在絮凝剂(Fecl3与粗盐水中的过量NaOH反应生成的Fe(OH)3)作用下与盐水中的氢氧化镁形成假比重较低的颗粒一起上浮,在处理器盐水表面形成浮泥,通过上排泥口定期排放,过量NaOH在加压泵出口取样分析,指标控制在0.2-0.6 g/l。
高盐水中钙镁含量高的原因,及解决方法目前,高盐废水的处理方法有热法、膜法、离子交换法、水合物法、溶剂萃取法和冷冻法等几十种。
其中,热法和膜法是目前大规模应用的主要技术。
热法可分为多级闪蒸、多效蒸发和压汽蒸馏。
20世纪90年代,海水淡化技术主要是多级闪蒸,特别是在中东,但多效蒸发和膜技术对MSF的挑战很大。
以反渗透技术为代表的膜脱盐技术,由于不需要大量热能,适用于大、中、小规模的盐水脱盐,膜系统的产水可以回用,但是会产生更高浓度的盐水,需要结合其它设备实现整体工艺的完整性。
直接蒸发结晶法处理高盐废水可以达到“零排放”的目的,但需要耗费大量的能源和资源。
高盐废水可通过膜技术进一步浓缩成高盐废水,淡水可直接回用。
浓缩后的高盐废水可蒸发结晶,实现“零排放”,大大降低能耗,合理利用部分水资源。
树脂在高盐废水处理中的作用在高盐水进入膜系统或者蒸发器之前都会存在钙镁离子偏高的问题,导致膜系统产水率下降,蒸发器换热系统结构影响使用效果,可以采用螯合树脂去除硬度,树脂对钙镁离子具有极强的选择性,可以保证出水水质钙镁离子浓度小于0.02mg/l,对零排的实现具有极大的应用意义。
盐水除钙镁螯合树脂是包含氨甲膦酸基连接到聚苯乙烯共聚物的一种的大孔树脂。
是用于从含有一价阳离子的废水处理中选择性的除去二价金属阳离子。
使二价金属阳离子以及由其他二价阳离子可以像钙一样容易地从一价阳离子中分离出来。
是用于在氯碱工业中盐水洗涤溶液脱钙。
这种树脂的其它应用,如:电镀和金属酸洗,湿法冶金,电池制造的铅去除,电子工业等。
型式/Type:大孔弱酸性阳离子交换树脂主体结构/Matrixstructure:大孔交联聚苯乙烯官能基/Functionalgroup:氨甲基膦物理型式/Physicalform:含水球状离子型式/Ionicform:钠粒径分布/ScreensizeU.S.S(wet):16–50粒径大小/Particlesize (95%minm): 0.3to1.2mm总交换容量/T otalexchangecapacity(minm) : 2.0meq/ml(H+) 膨胀/SwellingH+ toNa+ :约 35%湿度/Moisturecontent :约55%±3%PH 范围/pHrange: 0–14溶解性/Solubility:不溶于所有常见溶剂反洗密度/Backwashsettleddensity:720–760g/l1、处理精度高,可以将废水中重金属离子去除到0.2ppm。
作者: 翁兴媛[1];马志军[1];郭昊[1];邵先成[1];宋英杰[1]
作者机构: [1]辽宁工程技术大学矿业学院,辽宁阜新123000
出版物刊名: 辽宁科技学院学报
页码: 58-60页
年卷期: 2018年 第6期
主题词: 滴定分析;终点变色;终点拖长;终点返红
摘要:分析化学是矿物加工工程专业的一门重要专业基础课,实验课目的是锻炼学生研究能力和实验操作技能。
针对不同水质分析中钙镁含量测定过程中出现的一些特殊现象进行分析讨论,对滴定分析中终点变色不敏锐,终点拖长,终点返红问题进行了理论分析,从理论上解释这些现象产生的原因,并提出不同水样在测定过程中应采用不同的方法处理,这样会消除干扰增加测定结果的准确性。
氯 碱 工 业Chlor - Alkali Industry第55卷第4期2019年4月Vol. 55 , No. 4Apr. , 2019—次盐水中钙鎂离子含量超标的影晌13素袁丽华*,高世军,张磊刚* [作者简介]袁丽华(1987-),女,工程师,2009年毕业于西安工业大学材料化学专业,现于陕西北元化工集团股份有 限公司科技研发中心负责分析检测工作。
[收稿日期]2017 -07 -21(陕西北元化工集团股份有限公司科技研发中心,陕西 榆林719319)[关键词]盐水精制;一次盐水;钙离子;镁离子;影响因素[摘要]分析了生产运行中阶段性出现的一次精盐水中钙离子和镁离子的总含量超标情况,根据一系列的 试验研究结果排查了钙镁离子含量超标的影响因素,并制定了相应的整改措施。
[中图分类号]TQ114.261[文献标志码]B [文章编号]1008-133X(2019)04 -0012 -04Factors causing excess calcium and magnesium ions in primary brineYUAN Lihua , GAO Shijun , ZHANG Leigang (Technology Research and Development Center ,Shaanxi Beiyuan Chemical Industry Group Co. , Ltd. , Yulin 719319 , China)Key words : brine refining ; primary brine ; calcium ion ; magnesium ion ; influence factorAbstract : The situation that the total content of calcium ion and magnesium ion in primarily refinedbrine is excess periodically in production operation is analyzed. A series of experiment were conducted and the factors causing excess calcium ion and magnesium ion were investigated. And corresponding corrective measures were formulated.陕西北元化工集团股份有限公司(以下简称“北元化工”)在生产运行过程中,一次精盐水阶段 性出现Ca 2\Mg 2t 质量浓度总和>1 mg/L 且Ca"、Mg"含量同时升高的情况。
北元化工针对这种情况进行工艺排查,并结合生产实际,对可能存在的影 响因素进行试验论证,查找Ca 2+、Mg2+含量超标的 原因。
1生产过程工艺排查1.1反应时间反应槽设计容积为233 n/,假设运行的最大流量为220 n?/h,则反应槽内盐水的反应时间约为1 h 。
1.2流量对比将未超标时期与超标时期的反应槽盐水流量进 行对比,虽然反应槽流量无规律变化,但两个阶段的单槽流量相近,平均流量也相近,无明显的流量变 化。
1.3进反应槽盐水钙离子含量对比将未超标时期与超标时期进反应槽盐水中Ca"含量进行对比,未超标时期进反应槽盐水中 Ca?+质量浓度平均约为670 mg/L,而超标时期相同取样地点的盐水中Ca 2+质量浓度平均约为560mg/L 。
两个时段的数据对比表明:一次精盐水中Ca?+含量超标时,进反应槽盐水Ca 2+含量未增加。
1.4不同品牌膜过滤器的运行情况对比针对北元化工现用4个品牌的膜进行单台过滤 器的运行数据跟踪对比,分别在膜再生后的不同时 间取样检测滤液中的Ca 2+、Mg2+含量,并以Ca"为 例,在各品牌膜的72 h 试验时间内进行了 12次取样分析,结果可得:在相同试验时间检测的各品牌膜过滤后的盐水中的Ca"含量相近。
12第4期袁丽华等:一次盐水中钙镁离子含量超标的影响因素1.5工艺排查结果从上述各方面进行排查,未发现导致Ca2+、Mg"超标的影响因素。
对此,北元化工结合生产过程中溶解原盐的水质进行测试,验证其对盐水Ca2\Mg2+含量超标的影响。
2试验部分2.1试验方法结合北元化工盐水系统的运行情况,针对可能存在的影响钙镁离子含量超标的因素,用自来水溶解原盐配制饱和盐水或预处理盐水为试验样品,模拟反应槽和膜过滤器运行状态进行试验,采用排查法确定钙镁离子含量超标的影响因素。
2.2试验仪器、试剂2.2.1仪器ICP、百特-100型激光粒度仪、真空抽滤装置、加热磁力搅拌器、滤膜(孔径为0.22am)。
2.2.2试剂质量分数为13%的Na2CO3溶液,有效氯质量分数为10%次氯酸钠(以下简称“次钠”)以及FeCl3溶液。
2.3试验内容2.3.1Na2CO3与Ca"反应时间的影响(1)试验方法。
量取1000mL预处理盐水,加入20mL Na2CO3溶液,56恒温搅拌,每间隔30min取样过滤,测定滤液中Ca2\Mg2+含量,并以Ca"为例进行分析说明。
(2)试验结果如图1所示。
时间/min-6 W S )仝图1不同反应时间滤液中的钙离子和镁离子的含量Fig.1Content of calcium ion and magnesium ion in filtrate after different reaction period由图1可见:反应时间分别为5min,30min J h、2h后滤液中Ca?+质量分数分别为4.9x10"、7.5x10-7、、6.9x10-7、6.5x10'7o反应5min与反应30min相比,Ca"质量分数减少值为4.15x 10";反应30min与反应2h相比,Ca2+质量分数减少值为1x10"。
(3)试验结果分析。
当Na2CO3过量约1.2g/L(以质量浓度计,下同),反应温度为56紀的条件下,Ca?+与Na2CO3在30min内可以完成大部分沉淀反应。
2.3.2盐水中加入次钠的影响(1)试验方法。
量取预处理后盐水各200mL,分别加入不同体积的次钠溶液,再分别加入4.0mL Na2CO3溶液,56乜恒温反应30min,用滤膜过滤,测定滤液中的Ca2+、Mg2+含量。
(2)试验结果如2所示。
9©i、£0)m443322100.10.20.30.40.5NaClO^积/mL1210.8=634孑20.6图2次钠对盐水中钙离子和镁离子含量的影响Fig.2Effect of sodium hypochlorite on content of calcium ion and magnesium ion in brine由图2可见:预处理盐水不加次钠时,滤液中Ca"、Mg"含量较高,当加入0.2mL次钠时,滤液中Ca2\Mg2+含量明显降低。
继续增大次钠加入量,滤液中Ca?*含量变化不明显,Mg?*含量变化较明显。
(3)试验结果分析。
盐水中加入次钠溶液有助于Ca2\Mg2+的去除,分析原因如下:次钠能分解卤水中的有机物,减少有机钙物质的存在,从而充分与Na2CO3反应,提升沉淀反应效果。
随着次钠加入量的增大,盐水中的Mg"含量呈下降趋势,分析原因如下:1X10"级浓度的次钠极易水解成次氯酸,其过程可用化学方程式表示如下:NaClO+H20一HC1O+NaOH。
水解产生的0H-与卤水中的Mg?*形成Mg(OH)2沉淀,从而降低滤液中的Mg?*含量。
但13氯碱工业2019年Ca2+、M『+含量的降低与次钠的加入量不成线性关系,次钠添加量应适当。
Mg2+的情况同理可见。
2.3.3盐水系统中加入的各种水的影响(1)试验方法。
各量取200mL用自来水溶解的原盐溶液于5个烧杯中,其中1个为空白对比样,其余每个样品各加入50mL A厂循环水、B厂循环浓水、B厂循环水、C厂洗煤水,加热至56七,分别加入4.0mLNa2CC)3;再恒温56乜、反应30min,采用滤膜过滤;分别测量滤液中的Ca2\Mg2\NaOH s Na2CO3含量。
(2)试验结果如表1所示。
表1不同化盐水的影响试验数据Table1Experimental data of effect ofdifferent water for salt dissolving序号试验对象w(Ca2+)/10,a(Mg2+)/10-6p(NaOH)/p(Na2CO3)/(g/L)(g/L)1空白样 1.4280.01330.150.652A厂循环水 1.4270.11550.100.673B厂循环浓水 2.8530.03670.150.454B厂循环水 1.6250.07030.150.475C厂洗煤水 1.4930.02050.190.65由表1可见:盐水系统加入的各种水与自来水按体积比1:4溶解原盐时,以B厂循环浓水为试验对象的滤液中Ca"含量较高,B厂循环水次之,其他水的试验结果相近。
(3)试验结果分析。
在相同条件下,B厂循环浓水对盐水中Ca2\ Mg"含量的增大有一定影响。
2.3.4循环水中药剂的影响(1)试验方法。
各量取400mL自来水溶解原盐水样品10个,以其中1个为空白样品,其余每个样品各加入不同量的试验对象,加热至56再加入4.0mL Na2CO3溶液,恒温56覽反应30min,采用滤膜过滤,分别测量滤液中Ca2\Mg2\NaOH,Na2CO3含量及pH值。
(2)试验结果如表2所示。
由表2可见:各种水与样品按一定比例混合试验,滤液中Ca2+都比空白样中的Ca?+含量高,B厂循环浓水的试验数值是空白样品的2倍,影响最明显,与2.3.3的试验结果保持一致。
(3)试验结果分析。
各种助剂与样品按1:400比例混合试验时,加入PAM的试验结果比空白样品的低,其余试验的14Ca2\Mg2+含量比空白值高4~27倍。
其中,B厂循环污泥试验中Ca2\Mg2+含量是空白样的25倍。
循环水阻垢剂和B厂循环系统污泥对反应槽盐水中CaC03沉淀的形成有很强的抑制作用。
表2循环水中药剂的影响试验数据Table2Experimental dataof effect of reagent in circulating water序号助剂名称加入量/w(Ca2+)/p(Mg2+)/p(NaOH)/p(Na2C03)/pH值mL10o io-°(四(g/L) 1空白样4000.61810.01270.33 1.2211.62 2预处理盐水100.60260.01860.32 1.2211.58 3B厂循环水100.77090.01570.31 1.3111.61 4B厂循环浓水10 1.22100.01150.38 1.1711.63 5B厂循环污泥115.62000.06070.33 1.2311.58 6阻垢剂114.34000.0791一一9.50 7PAC1 2.59800.01790.22 1.4111.52 8PAM10.45710.01480.35 1.2211.59 9PAM①0.515.25000.05740.15 1.3711.15 10PAM②0.517.24000.07270.18 1.3611.18©PAM+阻垢剂,用量各0.5mL;②PAM+阻垢剂+PAC,用量各0.5mL。