水中钙镁离子含量测定.doc
- 格式:doc
- 大小:611.50 KB
- 文档页数:8

火焰原子吸收光谱法对水中钙镁元素含量的测定
1.原理
火焰原子吸收光谱法是一种常用的元素分析方法,对添加了特定试剂
的水样进行烧结分析,利用火焰中形成的原子,以吸收光谱的方式测定其
中元素的含量。
本实验以石英环氧环热烧结炉,采用火焰原子吸收光谱法,以选择性感应火焰来谱测定水中钙镁元素的含量。
2.原理描述
水样经加热烧结,在火焰中产生原子,其中的钙镁原子能够进行光离
子化(Ca+、Mg+),此时吸收器面上的检测元素中所具有的特征谱线就会
发出一定波长的回声,光谱仪可以发出特定波长的光,使检测元素产生特
征谱线,吸收器能够收集检测元素在特定波长的光线的反射,从而准确的
称出水样中的检测元素的含量。
3.分析流程
(1)将白细胞悬浮液以标定溶液的稀释倍数将其稀释至确定浓度;
(2)将稀释后的样品放入烧杯内,加入一定的烧剂,加热烧结;
(3)将火焰喷吐管插入环氧环,连接吸收器,开启光谱仪;
(4)在设定波长下测定样品中Ca、Mg吸收强度,确定测定值;
(5)重复上述步骤,完成对样品中Ca、Mg的测定;
(6)统计多次测定的结果,求出平均值,计算所求的检测元素含量。



水的总硬度及钙镁含量的测定【定义】水的硬度最初是指钙、镁离子沉淀肥皂的能力。
水的总硬度指水中钙、镁离子的总浓度,其中包括碳酸盐硬度(即通过加热能以碳酸盐形式沉淀下来的钙、镁离子,故又叫暂时硬度)和非碳酸盐硬度(即加热后不能沉淀下来的那部分钙、镁离子,又称永久硬度)。
硬度的表示方法硬度的表示方法尚未统一,目前我国使用较多的表示方法有两种:一种是将所测得的钙、镁折算成CaO的质量,即每升水中含有CaO的毫克数表示,单位为mg·L—1;另一种以度(°)计:1硬度单位表示10万份水中含1份CaO(即每升水中含10mgCaO),1°=10ppm CaO。
这种硬度的表示方法称作德国度.【工业用水和生活饮用水对水的硬度的要求】我国生活饮用水卫生标准规定以CaCO3计的硬度不得超过450mg·L-1。
钙镁总量的测定方法在一份水样中加入pH=10。
0的氨性缓冲溶液和少许铬黑T指示剂,溶液呈红色;用EDTA标准溶液滴定时,EDTA先与游离的Ca2+配位,再与Mg2+配位;在计量点时,EDTA从MgIn-中夺取Mg2+,从而使指示剂游离出来,溶液的颜色由红变为纯蓝,即为终点。
注意:当水样中Mg2+极少时,由于CaIn-比MgIn—的显色灵敏度要差很多,往往得不到敏锐的终点。
为了提高终点变色的敏锐性,可在EDTA标准溶液中加入适量的Mg2+(在EDTA标定前加入,这样就不影响EDTA与被测离子之间的滴定定量关系),或在缓冲溶液中加入一定量的Mg—EDTA盐。
水的总硬度可由EDTA标准溶液的浓度cEDTA和消耗体积V1(ml)来计算。
以CaO计,单位为mg/L.ρCaO=cEDTA*V1*MCaO/Vs*1000水中钙含量的测定另取一份水样,用NaOH调至pH=12.0,此时Mg2+生成Mg(OH)2沉淀,不干扰Ca2+的测定。
加入少量钙指示剂,溶液呈红色;用EDTA标准溶液滴定至溶液由红色变为蓝色即为终点,所消耗的EDTA的体积为V2(EDTA),则Ca2+的质量浓度(mg·L—1 )可用下式计算:ρCaO=cEDTA*V2*MCaO/Vs*1000镁含量=总硬度—钙含量水中溶解氧的测定碘量法一、实验原理水中溶解氧的测定,一般用碘量法。

实验目的:测量水中钙、镁离子的总含量1.了解配位滴定法基本原理和方法。
2.了解水的硬度的概念及其表示方法。
实验原理含有钙、镁离子的水叫硬水。
测定水的总硬度就是测定水中钙、镁离子的总含量,可用EDTA配位滴定法测定:滴定前: M + EBT M-EBT(红色)主反应: M + Y MY终点时: M-EBT + Y MY + EBT(红色) (蓝色)滴定至溶液由红色变为蓝色时,即为终点。
滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg・L-1。
器材和药品1.器材天平(0.1g、0.1mg),容量瓶(100mL),移液管(20mL),酸式滴定管(50mL),锥形瓶(250mL)等。
2.药品 HC1(1∶1),乙二胺四乙酸二钠(Na2H2Y・2H2O,A.R.),碱式碳酸镁[Mg(OH)2・4MgCO3・6H2O,基准试剂],NH3-NH4Cl缓冲溶液(pH=10.0),三乙醇胺(1∶1),铬黑T指示剂(0.2%氨性乙醇溶液)等。
实验方法一、Mg2+标准溶液的配制(约0.02mol・L-1)准确称取碱式碳酸镁基准试剂0.2~0.25g,置于100mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1∶1 HC1使其溶解(约需3~4mL)。
加少量水将它稀释,定量地转移至100mL容量瓶中,用水稀释至刻度,摇匀。
其浓度计算:二、EDTA标准溶液的配制与标定1.EDTA标准溶液的配制(约0.02mol・L-1)称取2.0g乙二胺四乙酸二钠(Na2H2Y・2H2O)溶于250mL蒸馏水中,转入聚乙烯塑料瓶中保存。
2.EDTA标准溶液浓度的标定用20mL移液管移取Mg2+标准溶液于250mL锥形瓶中,加入10mL氨性缓冲溶液和3~4滴EBT指示剂,用0.02mol・L-1EDTA标准溶液滴定,至溶液由紫红色变为蓝色即为终点。

原子吸收方法测定自来水中钙镁的含量测定原子吸收法是一种常用的分析方法,主要用于测定溶液中的金属离子含量。
在自来水中,钙和镁是最常见的金属离子之一,测定其含量对于评估水质具有重要意义。
下面将详细介绍如何使用原子吸收法测定自来水中钙、镁的含量。
实验原理:原子吸收法是通过分析溶液中金属离子与特定分析物质之间的光谱吸收来测定金属离子的含量。
通常使用的分析物质是具有特征性吸收光谱的金属空心阴极灯。
实验步骤:1.采集自来水样品:从自来水龙头中取得一定量的自来水样品。
2.准备标准溶液:分别称取钙、镁标准品,加入稀盐酸溶解,并稀释至一定浓度范围内。
3.调节光谱仪参数:根据各个元素的谱线特征,设定原子吸收光谱仪的参数,如波长、燃烧气体流量等。
4.样品处理:将自来水样品通过滤纸过滤以除去杂质,并用稀盐酸调节pH值。
5.原子吸收测定:分别将准备好的标准溶液和样品溶液注入原子吸收光谱仪中进行测定,记录各个波长下的吸光度。
6.绘制标准曲线:根据标准溶液的吸光度数据,绘制钙、镁标准曲线。
7.测试样品:将经过处理的自来水样品进行原子吸收测定,读取吸光度,并利用标准曲线计算钙、镁的含量。
实验注意事项:1.实验过程中需要严格控制各个操作步骤下的污染源,以避免干扰实验结果。
2.在测定过程中,要同时测定更多的参比物质,以便校正光谱的漂移。
3.实验过程中需要注意控制温度,以避免因温度变化而影响光谱吸光度。
4.实验结束后及时清洗仪器设备,避免污染下一次使用。
实验结果分析:根据实验数据可以计算出自来水中钙和镁的含量。
这些数据可以与国家或地方的水质标准进行比较,以评估自来水的质量。
如果超出标准范围,可能需要进一步的处理或措施来改善水质。
总结:原子吸收法是一种常用的分析方法,可以用于测定自来水中钙和镁的含量。
通过此实验可以了解自来水中的金属离子含量,从而评估水质。
在实验中需要注意操作规范,控制污染源,以获得准确的测量结果。

化验室EDTA滴定法测定水质钙镁离子操作规程一、引用标准GB/T15452-2009工业循环冷却水中钙、镁离子的测定EDTA滴定法二、方法提要钙离子测定是在pH为12~13时,以钙—羧酸为指示剂,用EDTA标准滴定溶液测定水样中的钙离子含量。
滴定时EDTA与溶液中游离的钙离子仅应形成络合物,溶液颜色变化由紫红色变为亮蓝色时即为终点。
镁离子测定是在pH为10时,以铬黑T为指示剂,用EDTA标准滴定溶液测定钙、镁离子含量,溶液颜色由紫红色变为纯蓝色即为终点,由钙镁含量减去钙离子含量即为镁离子含量。
三、试剂和材料1、硫酸溶液:1+1。
2、过硫酸钾溶液:40g/L,存储于棕色瓶中(有效期1个月)。
3、三乙醇胺溶液:1+2。
4、氢氧化钾溶液:200g/L。
5、氨-氯化铵缓冲溶液(甲):pH=10;54gNH4Cl与350mL浓氨水,加少量水溶解,待温度在室温时,定容至1L棕色容量瓶中,上下颠倒混合均匀。
6、乙二胺四乙酸二钠标准溶液:c(EDTA)约0.01moL/L。
7、钙—羟酸指示剂:0.2g钙–羧酸指示剂[2-羟基-1-(2-羟基-4-磺基-1-萘偶氮)-3-萘甲酸]与100g氯化钾混合研磨均匀,存储于磨口瓶中。
8、铬黑T指示剂液:溶解0.50g铬黑T﹝1-(1-羟基-2-萘偶氨-6-硝基-萘酚-4-磺酸钠)﹞于85mL三乙醇胺中,再加入15mL乙醇。
四、分析步骤1、钙离子的测定用移液管移取50mL过滤后的水样于250mL锥形瓶中,加入1mL硫酸溶液和5mL过硫酸钾溶液,加热煮沸至近干,取下冷却至室温向其中加入50mL 水、3mL三乙醇胺溶液、7mL氢氧化钾溶液和约0.2g钙—羧酸指示剂,用EDTA标准滴定液滴定,近终点时速度要缓慢,当溶液颜色由紫红色变为亮蓝色时即为终点。
2、镁离子的测定用移液管移取50mL过滤后的水样于250mL锥形瓶中,加入1mL硫酸溶液和5mL过硫酸钾溶液,加热煮沸至近干,取下冷却至室温加50mL水、3mL 三乙醇胺溶液。

水中钙镁离子含量及总硬度旳测定目旳1、理解水旳硬度旳测定意义和水硬度常用表达措施。
2、掌握EDTA法测定水中Ca2+、Mg2+含量旳原理和措施。
原理工业中将具有较多钙、镁盐类旳水称为硬水,水旳硬度是将水中Ca2+、Mg2+旳总量折合成CaO或CaCO3来计算。
每升水中含1mg CaO定为1度,每升水含10mgCaO称为一种德国度(°)。
水旳硬度用德国度(°)作为原则来划分时,一般把不不小于4°旳水称为很软水,4°~8°旳水称为软水,8°~16°旳水称为中硬水,16°~32°旳水称为硬水,不小于32°旳水称为很硬水。
用EDTA进行水旳总硬度及Ca2+、Mg2+含量旳测定期可先测定Ca2+、Mg2+旳总量,再测定Ca2+量,由总量与Ca2+量旳差求得Mg2+旳含量,并由Ca2+、Mg2+总量求总硬度。
Ca2+、Mg2+总量旳测定:用NH3-NH4Cl缓冲溶液调节溶液旳PH =10,在此条件下,Ca2+、Mg2+均可被EDTA精确滴定。
加入铬黑T批示剂,用EDTA原则溶液滴定。
在滴定旳过程中,将有四种配合物生成即CaY、MgY、MgIn、CaIn,它们旳稳定性顺序为:CaY ﹥MgY﹥MgIn﹥CaIn(略去电荷)由此可见,当加入铬黑T后,它一方面与Mg2+结合,生成红色旳配合物MgIn,当滴入EDTA时,一方面与之结合旳是Ca2+,另一方面是游离态旳Mg2+,最后,EDTA夺取与铬黑T结合旳Mg2+,使批示剂游离出来,溶液旳颜色由红色变为蓝色,达到批示终点。
设消耗EDTA 旳体积为V1。
Ca2+含量旳测定:用氢氧化钠溶液调节待测水样旳PH=12,将Mg2+转化为Mg(OH)2沉淀,使其不干扰Ca2+旳测定。
滴加少量旳钙批示剂,溶液中旳部分Ca2+立即与之反映生成红色配合物,使溶液呈红色。
当滴定开始后,随着EDTA旳不断加入,溶液中旳Ca2+逐渐被滴定,接近计量点时,游离旳Ca2+被滴定完后,EDTA则夺取与批示剂结合旳Ca2+使批示剂游离出来,溶液旳颜色由红色变为蓝色,达到批示终点。

实验十四水硬度的测定一实验目的1、了解硬度的常用表示方法;2、学会用配位滴定法测定水中钙镁含量,钙含量的原理和方法3、掌握铬黑T,钙指示剂的使用条件和终点变化。
二、实验原理1、总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L水中含的碳酸钙的mg数,即mg/L.钙硬度即每1L水中含的钙离子的mg数,mg/L.镁硬度即每1L水中含的镁离子的mg数,mg/L2 总硬度的测定条件与原理测定条件:以NH3-NH4Cl 缓冲溶液控制溶液pH=10,以铬黑T为指示剂,用EDTA滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA的滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA的体积即可换算出水样的总硬度。
3 钙硬度的测定条件与原理;测定条件:用NaOH溶液调节待测水样的pH为13,并加入钙指示剂,然后用EDTA滴定。
原理:调节溶液呈强碱性以掩蔽镁离子,使镁离子生成氢氧化物沉淀,然后加入指示剂用EDTA滴定其中的钙离子,至酒红色变为纯蓝色即为终点,由滴定所用的EDTA的体积即可算出水样中钙离子的含量,从而求出钙硬度。
4、相关的计算公式总硬度=(CV1)EDTAMCaCO3/0.1 钙硬度=(CV2)EDTAMCa/0.1 镁硬度=C(V1-V2)MMg/0.1三实验步骤四实验数据记录与处理总硬度的测定钙硬度的测定镁硬度=C(V1-V2)MMg/0.1五、思考题1、水硬度的测定包括哪些内容?如何测定?〈1〉水硬度的测定包括总硬度与钙硬度的测定,镁硬度则根据实验结果计算得到;〈2〉可在一份溶液中进行,也可平行取两份溶液进行;①.在一份溶液中进行;先在pH=12 时滴定Ca2+ ,再将溶液调至pH=10 (先调至pH=3,再调至pH=10,以防止Mg(OH)2或MgCO3等形式存在而溶解不完全),滴定Mg2+。

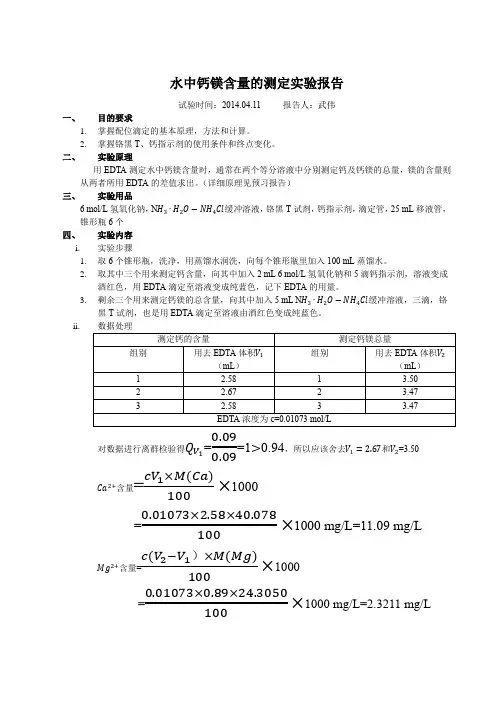
水中钙镁离子含量的测定
水中钙镁离子含量的测定可以通过以下步骤进行:
1. 采集水样:在需要测试的地方采集水样,将其放入干净的容器中。
2. 准备试剂:准备一定量的硝酸铵(NH4NO3)、乙二胺四乙酸(EDTA)和卡钠(Calcein Na)试剂。
3. 样品前处理:将采集到的水样用玻璃棒充分搅拌,以保证样品均匀。
根据所需样品量,取少量水样置于锥形瓶中。
4. 钙镁离子络合反应:分别取两个锥形瓶,其中一个加入所需量的硝酸铵溶液,另一个加入乙二胺四乙酸(EDTA)溶液。
然后将两个瓶中溶液混合均匀。
5. 添加指示剂:将卡钠试剂溶解于适量去离子水中,然后滴加到混合溶液中。
搅拌均匀,使溶液发生橙黄色变化。
6. 加标法测定:取一定量的钙标准溶液,加入到产生橙黄色的溶液中。
继续滴加卡钠试剂,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
7. 测定样品:将步骤6中记录的钙标准溶液体积作为参考,再分别对未加标样品和标准样品进行滴定,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
8. 计算钙镁离子含量:根据滴定过程中钙标准溶液的使用量,以及水样中的滴定用量,通过计算可以得到水样中钙镁离子的含量。
9. 结果分析:根据计算结果,可以得出水中钙镁离子含量的浓度。
任务操作工单(EDTA测定水中钙镁离子含量)一、课前任务巩固课堂所学知识,预习实验,回答以下问题:2.本实验所需的玻璃仪器及测试仪器有哪些?熟悉仪器的操作规程。
3.根据实验步骤,简要画出操作流程图。
二、操作过程与原始记录(一)EDTA的标定:1.0.02mol/lEDTA标准溶液的制备:称取8gEDTA置于250ml烧杯中,加微热溶解后,稀释到1L,转入聚乙烯塑料瓶中保存。
2 0.02mol/lCaCO3 标准溶液制备:准确称取CaCO3 0.5~0.6g,置于250ml烧杯中,加少量水润湿,盖好表面皿,从杯嘴沿玻璃棒滴加10mlHCl溶液(1:1),使之完全溶解,加热煮沸,冷却后定量转入250ml的容量瓶中,加水稀释到刻度,充分摇匀。
3.EDTA标准溶液浓度的标定:移液管移取25ml上述Ca2+标准溶液于250ml锥形瓶中,加入70~80ml水,加5ml20%NaOH溶液,并加少量钙指示剂,用EDTA溶液滴定至溶液由酒红色恰变为纯蓝色,记下消耗EDTA溶液体积,计算EDTA浓度。
表一、标定记录表计算公式:(二)水中钙镁离子含量的测定m (CaCO3)C EDTA=10V EDTA M (CaCO3)1.用移液管吸取水样50.00ml于250ml锥形瓶中,加三乙醇胺溶液(1:2)3ml,摇匀后再加5ml PH=10的NH3-NH4Cl缓冲溶液,再加少许(约0.1g)铬黑T混合指示剂,用EDTA标准溶液滴定至酒红色变为纯蓝色。
记录EDTA用量V1(ml)。
2.另取50.00ml水样于250ml锥形瓶中,加入5ml10%NaOH溶液摇匀,加入少许(约0.1g)钙指示剂,用EDTA标准溶液滴定至酒红色变为纯蓝色。
记录EDTA 用量V2(ml)。
表二、测定记录表测定记录表按下式计算钙镁离子浓度:(EDTA)×V2×M(Ca)×1000CρCa(mg/L)= --------------------------50.00(EDTA)×(V1-V)2×M(Mg)×1000CρMg(mg/L)= -------------------------------50.00式中C(EDTA)--- EDTA标准溶液的浓度(mol/L)V1-------------- 铬黑T终点EDTA的用量(mL)V2-------------- 钙指示剂终点EDTA的用量(mL)M(Ca)------- Ca的摩尔质量(g/mol)M(Mg)------- Mg的摩尔质量(g/mol)M(CaO)------- CaO的摩尔质量(g/mol)三、实验报告测定结果:水中钙镁离子含量分别为mg/l 问题:(1)测定水中钙镁含量时,溶液的pH应控制在多少? 为什么?(2)水中的Fe 3+、Al3+ 等离子应如何消除?(3)加入10%NaOH的作用是什么?EDTA测定水中钙镁离子含量评分表。
测量水中钙镁离子总含量水是人类的必需品,它在工业和家庭领域都有着广泛的应用。
然而,水中含有的钙镁离子虽然对人体有益,但是高含量的钙镁离子会导致水垢、污染和对设备的损害。
因此,测量水中钙镁离子总含量对于水的质量控制和治理具有重要意义。
本文将介绍如何测量水中钙镁离子总含量。
1. 理论分析当水中含有钙镁离子时,会形成难溶性的钙镁碳酸盐沉淀。
因此,钙镁离子总含量可以通过反应生成的沉淀的质量来间接测量。
钙镁离子化学计量比为1:1,因此反应方程式为:Ca2+ + Mg2+ + 2HCO3- → CaMg(CO3)2↓ + 2H2O + 2CO2↑其中,Ca2+和Mg2+是钙镁离子,HCO3-是碳酸氢根离子,CaMg(CO3)2是钙镁碳酸盐沉淀。
反应生成的钙镁碳酸盐沉淀可以通过滤纸过滤和干燥来得到。
然后,通过称重并计算沉淀的质量来测量水中钙镁离子总含量。
2. 实验步骤2.1 准备试剂和仪器(1)0.025 mol/L的乙酸钠溶液(2)0.05 mol/L的硝酸钙溶液(3)0.05 mol/L的硝酸镁溶液(4)千分秤、滤纸和滤漏器2.3 测量钙镁离子总含量(1)将干燥的钙镁碳酸盐沉淀称重,记录其质量。
(2)通过化学计量法,计算出水中钙镁离子总含量。
3.实验注意事项(1)试样应该保持清洁,避免有杂质或者污染物进入样品中。
(2)实验室操作应该规范,严格遵守安全操作规程,保证人身安全和实验结果的准确性。
(3)实验室应该保持干燥和无风的环境,以免风干钙镁碳酸盐沉淀。
(4)实验过程中使用的试剂和仪器应该经过正确的标准化和校准,以保证实验结果的可靠性。
4. 结论通过化学计量法测量水中钙镁离子总含量是一种简单、准确的方法。
本实验通过反应生成的钙镁碳酸盐沉淀来测量水中钙镁离子总含量,同时介绍了该实验的操作步骤和注意事项。
该方法适用于水质检测和水处理行业,有助于保障公众健康和环境保护。
标准号:D511-93(1998重新批准)水中钙镁离子的测定方法11.适用范围1.1本方法包括了络合滴定法和原子吸光光度法测定水中钙镁离子含量。
两种测定方法章节分布如下:章节测定方法A-络合滴定法7-14测定方法B-原子吸收分光光度法15-231.2本标准并不为了介绍所有的安全事项,如果本标准中存在一些,那是与应用过程相关的安全注意事项。
标准的使用人在使用前应建立合适的健康安全规程和常规适用范围。
专门的危害性描述请见注2和注7。
2.参考文献2.1 ASTM标准:D1129 关于水的专业术语2;D1193 试剂水的规范2;D2777 D-19会议确定的关于水分析的精密度和偏差确定的操作方法2;D3370 密闭管中取水样操作规程2;D4691 火焰原子吸收分光光度法测水中元素2;D4841 水样中有机和无机质含量组成稳定的保存时间的估计方法2。
3.专业术语3.1 定义-本方法中采用的术语的定义,参见术语D1129。
4.重要性和用途4.1 钙镁离子是水的硬度的主要组成部分,也是油管和集输管道结垢的主要原因。
5.试剂纯度5.1 所有的实验都应用试剂纯级的化学药剂。
除非特别说明,否则所有的试剂都必须符合美国化学协会分析试剂委员会3的要求。
倘若预先确认试剂纯度足够高,应用的试剂不会降低测定的精度的条件下,可以使用其它纯度的试剂。
5.2 水的纯度-除非特别说明,水的参考物应理解为单纯试剂水,符合D1193规范的Ⅰ型、Ⅱ型和Ⅲ型水。
Ⅰ型水较常用,推荐使用Ⅰ型水。
Ⅱ型水为作round-robin测定时指定用水。
注1-使用者必须确认这种试剂水是不含任何干扰物质的。
试剂水应经本方法分析过。
6.取样6.1 按照D3370规程收集样品。
6.2 如果测定总的钙镁浓度,收样时立即用HNO3(sp gr 1.42)调节pH值到2或更低。
一般浓度要求为大约2mL/L。
样品保存时间按照D4841 规范执行。
6.3 如果测定溶解钙镁浓度,用0.45μm的微孔滤膜过滤水样,并立即用HNO3(sp gr 1.42)调节水溶液pH值到2或更低。
【知识点】配位滴定法测定水中钙镁离子含量 [1]水硬度测定方法原理水的硬度是水质的重要指标之一,对工业及生活影响很大,因此测定水的硬度有很重要的实际意义。
自来水常形成锅垢,这是由于水中钙、镁的碳酸盐、酸式碳酸盐、硫酸盐、氯化物等所致。
水中钙、镁盐等的含量用“硬度”表示,其中Ca 2+、Mg 2+含量是计算硬度的主要指标。
钙盐和镁盐含量多的水称为硬水,含量较少的则称为软水。
常用水(自来水、河水、井水等)都是硬水。
水的总硬度包括暂时硬度和永久硬度。
在水中以碳酸盐及酸式碳酸盐形式存在的钙盐、镁盐,加热能被分解、析出沉淀而除去,这类盐所形成的硬度称为暂时硬度,而钙、镁的硫酸盐或氯化物等所形成的硬度称为永久硬度。
总硬度是指水中Ca 2+、Mg 2+的总含量,其单位用每升水中含有CaO 或CaCO 3的质量(mg )来表示,可写成CaOmg/L 或CaCO 3mg/。
水中钙硬度是指Ca 2+的含量,镁硬度则是指Mg 2+含量。
(1)总硬度的测定 用EDTA 配位滴定法测定水的硬度是一个准确而快速的方法,它是在pH=10的氨性缓冲溶液中,以铬黑T 为指示剂,用EDTA 标准溶液直接测定水中的Ca 2+和Mg 2+。
pH=10时,Ca 2+、Mg 2+与EDTA 生成无色配合物,铬黑T 则与Ca 2+、Mg 2+生成红色配合物。
由于MgIn CaInK K '<'lg lg ,当溶液中加入铬黑T 先与Mg 2+配位生成MgIn -,溶液呈红色,反应如下: Mg 2+ +HIn 2- = MgIn - + H + 用EDTA 滴定时,由于MgYCaY K K '>lg lg ,EDTA 首先和溶液中Ca 2+配位,然后再与Mg 2+配位,反应如下: Ca 2+ + H 2Y 2- = CaY 2- + 2H + Mg 2+ + H 2Y 2- = MgY 2- + 2H +到达化学计量点时,由于MgIn MgYK K '<'lg lg ,稍过量的EDTA 夺取MgIn -中的Mg 2+,使指示剂释放出来,显示指示剂的纯蓝色,从而指示终点,反应如下: MgIn - + H 2Y 2- = MgY 2- + HIn 2- +2H + 红色 蓝色根据所消耗的EDTA 标准滴定溶液的体积,计算水的总硬度。
水中钙镁离子含量的测定方法检测试剂1 盐酸2 硝酸3 盐酸溶液:1+14 盐酸溶液:1+995 氯化镧溶液:含镧20g/L。
称取24.0g氧化镧,置于200mL烧杯中,加人20mL水,加人盐酸50mL溶解,转移至1000mL容量瓶中,用水稀释至刻度。
6 氯化锶溶液:含锶50g/L。
称取152.0g氯化锶,置于200mL烧杯中,加人20mL水,加人盐酸20mL溶解,转移至1000mL容量瓶中,用水稀释至刻度。
7 氯化铯溶液:含钝20g/L。
称取25.0g氯化绝,置于100mL烧杯中,加人盐酸溶液(1+99)50mL 溶解,转移至1000mL容量瓶中,并用盐酸溶液(1+99)稀释至刻度。
8 钙标准贮备溶液:1mg/mL。
称取预先于105℃-110℃烘至恒重的高纯碳酸钙2.4970g,精确至0.2mg。
置于100mL烧杯中,加入50mL水、10mL盐酸溶液(1+1),溶解后移入1000mL容量瓶中,用水稀释至刻度,摇匀。
9 钙标准溶液:0.05mg/mL。
移取钙标准贮备溶液5.0mL,置于100mL容量瓶中,用水稀释至刻度,摇匀。
10 镁标准贮备溶液:0.1mg/mL11 镁标准溶液:5mg/L。
移取镁标准贮备溶液5.0mL,置于100mL容量瓶中,用水稀释至刻度,摇匀。
该溶液现用现配。
检测所需仪器1 原子吸收光谱仪:配有钙空心阴极灯、镁空心阴极灯,空气-乙炔预混合燃烧器与氧化亚氮预混合燃烧器,打印机或记录仪。
2 乙炔钢瓶:压力不得低于500 kPa。
3 空压机。
仪器调试按照仪器说明书调节仪器至最佳状态,调整钙测定波长为422.7nm、镁测定波长为285.2nm。
仪器开机点火,稳定5min-10min后再进行测定。
水样采集水样采集容器应为聚乙烯瓶或聚丙烯瓶。
水样收集后,应立即加入盐酸酸化,防止碳酸钙沉淀。
通常每升水样加入8mL盐酸可以满足。
当水样中悬浮物较多时,可以用中速定量滤纸过滤,滤液贮存于聚乙烯瓶内(试样可放置2周)。
水中钙镁含量的测定(PPS)水是生命之源,水中含有大量的矿物质,其中包括钙和镁。
钙和镁是身体所必需的微量元素,缺乏这些元素会影响人体的健康。
为了保证饮用水的安全性和健康性,需要对水中的钙镁含量进行测定。
本文将介绍测定水中钙镁含量的一种方法——PPS。
一、实验材料(1)水样(2)PPS试剂盒(3)分析天平(4)量筒(5)滴管(6)加热板(7)锥形瓶二、实验原理PPS(Phenolphthalein Disulfonate Sodium Salt)试剂可以与钙离子和镁离子形成可溶性络合物,在试剂的存在下,钙离子和镁离子与指示剂(碳酸指示剂)反应,会使pH值降低,从而导致指示剂颜色的改变。
钙离子和镁离子的含量可以通过从溶液中转化的指示剂用量来确定。
三、实验过程(1)取适量待测水样,放入锥形瓶中。
(2)取一定量的PPS试剂(如试剂盒说明书所示),使用滴管加入待测水样中。
(3)使用碳酸指示剂3滴,观察其颜色变化,颜色的改变是由于指示剂受到了钙离子和镁离子的干扰,使pH值降低或升高,从而导致颜色的改变。
如果出现红色,请用10%的硝酸将其变为黄色。
(4)使用滴管加入盐酸直至溶液变为颜色发生改变的淡粉色。
(5)用氨水逐滴加至溶液颜色变为蓝色,记录加入的氨水体积。
(6)重复上述步骤2-5,不加PPS试剂为样品对照组。
四、计算方法(1)计算空白组和样品组的差值,得出对应的PPS黏度的值(3)计算出毫克/升的含量五、实验注意事项(1)使用无菌滴管取液,避免污染。
(2)PPS试剂和碳酸指示剂应保存在阴凉干燥的地方,避免日光直射和潮湿。
(3)水样取样应当保证代表性,并避免与外界环境污染。
(4)实验过程中应当注意安全,避免化学品溅到皮肤或者进入口腔,手术过程中应当佩戴手套。
六、实验结果分析(1)得出的水样钙镁含量是否符合国家饮用水卫生标准。
(2)有无异常数据或者误差过大的数据,需要进行数据处理和分析。
(3)实验过程中的误差和不确定性分析,以及改进方法探讨。
实验十四水硬度的测定
一实验目的
1、了解硬度的常用表示方法;
2、学会用配位滴定法测定水中钙镁含量,钙含量的原理和方法
3、掌握铬黑T,钙指示剂的使用条件和终点变化。
二、实验原理
1、总硬度、钙硬度、镁硬度的概念及表示方法;
水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L 水中含的碳酸钙的mg数,即mg/L.
钙硬度即每1L 水中含的钙离子的m g数,mg/L.
镁硬度即每1L 水中含的镁离子的m g数,mg/L
2 总硬度的测定条件与原理
测定条件:以N H3-NH4Cl 缓冲溶液控制溶液pH=10,以铬黑T 为指示剂,用EDTA
滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA的滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA的体积即可换算出水样的总硬度。
3 钙硬度的测定条件与原理;
测定条件:用NaOH溶液调节待测水样的pH为13,并加入钙指示剂,然后用EDTA 滴定。
原理:调节溶液呈强碱性以掩蔽镁离子,使镁离子生成氢氧化物沉淀,然后加入指示剂用EDTA滴定其中的钙离子,至酒红色变为纯蓝色即为终点,由滴定所用
的EDTA的体积即可算出水样中钙离子的含量,从而求出钙硬度。
4、相关的计算公式
总硬度=(CV1) EDTA M CaCO3/0.1 钙硬度=(CV2) EDTA M Ca/0.1 镁硬度=
C(V1-V2)M Mg/0.1
三实验步骤
实验步骤思考题
总硬度的测定
1、水硬度的测定包括哪些内容?如何
用100mL吸管移取三份水
测定?
样,分别加5mL NH3-NH4Cl 缓冲
2、我国如何表示水的总硬度,怎样换溶液,2~3 滴铬黑T 指示剂,用
EDTA标准溶液滴定,溶液由酒红
算成德国硬度?
色变为纯蓝色即为终点。
3、用Zn2+标准溶液标定EDTA标准溶液
有二种方法,水硬度的测定实验中所用EDTA应
用哪种方法标定?
4、怎样移取100mL水样?
5、为什么测定钙、镁总量时,要控制
pH=10?叙述它的测定条件。
6、测定总硬度时,溶液中发生了哪些
反应,它们如何竞争
7、如果待测液中只含有Ca2+,能否用铬黑T
为指示剂进行测定?
钙硬度测定
8、测定钙硬度时,为什么加2mL6mol· L-1NaOH
用100mL吸管移取三份水样,分别加2mL 6mol· L
-1 NaOH
-1 NaOH 溶液使溶液的pH=12~13?叙述它的测定条件。
9、为什么钙指示剂能在pH=12~13 的条件下指
溶液,5~6 滴钙指示剂,用EDTA
示终点?
标准溶液滴定,溶液由酒红色变
为纯蓝色即为终点。
10、怎样减少测定钙硬度时的返红现象?
11、怎样做空白实验,为什么要做空白实验,
实验中为什么不做?
12、怎样表示实验结果?
13、如水样中含有Al3+、Fe3+、Cu2+,能否用
铬黑T 为指示剂进行测定,如可以,实验应该
如何做?
四实验数据记录与处理
总硬度的测定
序号 1 2 3 自来水体积V水/mL
V初/mL
V终/mL
V总/mL
平均体积V1/mL
总硬度/mg/L
平均值/mg/L( 舍前)
S
T
平均值/mg/L( 舍后)
钙硬度的测定
序号 1 2 3 自来水体积V水/mL
V初/mL
V终/mL
V总/mL
平均体积V2/mL
钙硬度/mg/L
平均钙硬度/mg/L( 舍前)
S
T
平均钙硬度/mg/L( 舍后)
镁硬度=C(V1-V2) M Mg/0.1
五、思考题
1、水硬度的测定包括哪些内容?如何测定?
〈1〉水硬度的测定包括总硬度与钙硬度的测定,镁硬度则根据实验结果计算得
到;
〈2〉可在一份溶液中进行,也可平行取两份溶液进行;
2+ ,再将溶液调至pH=10(先
①.在一份溶液中进行;先在pH=12 时滴定Ca
调至pH=3,再调至pH=10,以防止Mg(OH)2 或MgCO3等形式存在而溶解不完全),
2+。
滴定Mg
②.平行取两份溶液进行:一份试液在pH=10时测定Ca,Mg总量,另一份在pH=12
时测定C a,由两者所用EDTA体积之差求出Mg的含量。
本实验采用第二种方法。
2、我国如何表示水的总硬度,怎样换算成德国硬度?
我国通常以1×10 3 表示水的总硬度,德国以10×10
-3 g· L-1 CaCO -3g· L-1 CaO表示水
的硬度,因此,如以我国1×10
-3g· L-1 CaCO
3 表示的总硬度换算成德国度时,需乘以系数0.056。
德国度
o DH(10×10-3 g· L-1 CaO) = 总硬度(g· L-1
CaCO3) ×56.08/(100.09 ×10) = 总硬度(g· L -1 CaCO3) ×
0.056
3) ×0.056
3、怎样移取100mL水样?
⑴由于移取的水样体积大,因此移取时盛水样的烧杯为400mL;
⑵吸取水样用水泵、真空泵,而不是洗耳球;
⑶将真空泵上的橡皮管微接(不是全部套住)100mL吸管的管口,使水以适中
的速度进入吸管。
若全部套住,进水速度快,会带入大量小气泡(水呈浑浊样),使移取的体积不准。
⑷注意右手食指的操作,因100mL吸管的上口管径大,溶液下流快,故调节液
面至刻度线时,应微松食指使液面缓缓下降,以控制液面的最低点恰与刻度线相切,同时紧按食指,使液面不再下降,使移取水样的体积准确。
⑸每个实验室公用三支100mL无分度吸管,以及相配套的400mL烧杯及表面皿。
5、为什么测定钙、镁总量时,要控制pH=10?叙述它的测定条件。
⑴因稳定常数CaY
2-> MgY2-,滴定C a2+的最低pH=8,滴定Mg2+的最低pH=10,指示
剂铬黑T 使用的最适宜pH范围为9~10.5, 因此测定时pH=10。
⑵测定总量的条件为,在pH=10的氨性缓冲溶液中,以铬黑T 为指示剂。
6、测定总硬度时,溶液中发生了哪些反应,它们如何竞争
2+
在pH=10的缓冲溶液中,加入铬黑T 指示剂后,指示剂先与Mg
配位(为什么?)- 2+ 2+ -
为MgIn ,当滴加EDTA后,EDTA先与游离的Ca 、Mg 配位,最后夺取MgIn
中的2+ :
Mg
MgIn- + H
- + H
2-
2Y
=MgY2-
+ HIn
2- + HIn
2- + H
+
溶液的颜色由酒红色变为纯蓝色。
2+,能否用铬黑T为指示剂进行测定?
7、如果待测液中只含有Ca
若按本实验条件用直接滴定法测定总硬度,则不能。
经计算可知,在pH=10的氨性溶液中,以铬黑T 为指示剂,用0.02mol· L
-1EDTA滴定0.02mol· L-1Ca2+
溶液,终点误差为-1.5%;若滴定的是0.02mol· L 溶液,终点误差为0.11%。
此结
-1 Mg2+
果表明,采用铬黑T 为指示剂时,尽管CaY比MgY稳定,但测定钙的终点误差较
2+显色不灵敏所致。
大,这是由于铬黑T 与Ca
若按照置换滴定法进行实验,则可以。
只要在溶液中加入少量MgY,在pH=10
的条件下,用铬黑T 为指示剂就能进行测定
8 测定钙硬度时,为什么加2mL 6mol· L-1NaOH溶液使溶液的pH=12~13?叙述
它的测定条件。
2+形成Mg(OH) <1>
在pH=12~13 的条件,Mg
2 沉淀,不干扰钙的测定。
<2>钙硬度的测定条件:pH=12~13,以钙指示剂为指示剂。
9 为什么钙指示剂能在pH=12~13 的条件下指示终点?
在溶液中,钙指示剂存在下列平衡:
H2In
p K a2=7.4 p K a3=13.5
- HIn2- In
3-
酒红色蓝色酒红色
由于MIn 为酒红色,要使终点的变色敏锐,从平衡式看
2+
7.4 < pH < 13.5 就能满足。
为了排除Mg 的干扰,因此在pH=12~13 的条件下,滴定钙,终点呈蓝色。
10、怎样减少测定钙硬度时的返红现象?。