2012年高考化学二轮精品复习资料 专题十 电化学原理(同步课件)
- 格式:ppt
- 大小:4.61 MB
- 文档页数:2

2012高考化学二轮模拟新题分类汇编--专题十电化学原理1.(2012.郑州.第一次质量预测)综合下图判断,下列正确的说法是A. 装置I和装置II中负极反应均是B. 装置I和装置II中正极反应均是C. 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动D. 放电过程中,装置I左侧烧杯和装置II右侧烧杯中溶液的pH均增大1.【答案】D【解析】装置I为吸氧腐蚀,负极是锌:Zn-2e-=Zn2+,正极反应为:,溶液的pH增大,盐桥中阳离子向左侧烧杯移动;装置II铁为负极:Fe-2e-=Fe2+,正极反应为:2H++2e-=H2↑,溶液的pH增大,盐桥中阳离子向右侧移动。
综上所述,A、B、C项不正确,D 项正确。
2.(2012.山西大同.调研)Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的电极反应式为: 2Li++FeS+2e—=Li2S+Fe,有关该电池的下列说法正确的是()A.Li-Al在电池中作为负极材料,该材料中Li的化合价是+1价B.充电时,阴极发生的电极反应式为:Li2S+Fe—2e—=2Li++FeSC.放电时,负极的电极反应式:Al—3e—=Al3+D.该电池的电池反应式为:2Li+FeS=Li2S+Fe2.【答案】D【解析】A项Li的化合价是0价;充电时,阴极发生还原反应,电极反应式为:Li++e—=Li ,B错;放电时,负极的电极反应式:Li-e—=Li+,C错。
3.(2012.福州.期末)铁镍蓄电池放电时的总反应为:Fe+Ni2O3+3 H2OFe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确...的是A.电池的电解液为碱性溶液B.电池的正极为Ni2O3、负极为FeC.电池放电时,负极反应为Fe+20H一一2e一Fe(OH)2D.电池充电时,阳极附近溶液的pH升高3.【答案】D【解析】由放电时的总反应知生成物均为氢氧化物,所以电池的电解液应为碱性溶液;由化合价的变化知Fe 失去电子应作负极,Ni 2O 3作正极;充电时阳极为Ni (OH )2失电子,其电极反应式为2Ni (OH )2+2OH --2e -=Ni 2O 3+3H 2O ,所以阳极附近溶液的pH 降低,D 项错误。




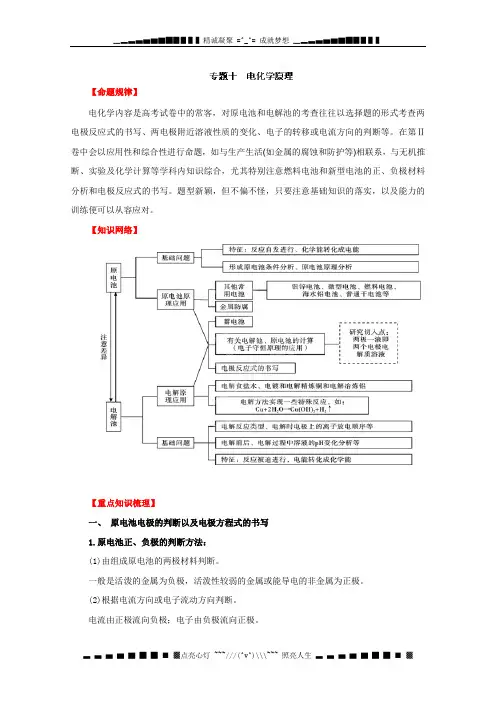
【命题规律】电化学内容是高考试卷中的常客,对原电池和电解池的考查往往以选择题的形式考查两电极反应式的书写、两电极附近溶液性质的变化、电子的转移或电流方向的判断等。
在第Ⅱ卷中会以应用性和综合性进行命题,如与生产生活(如金属的腐蚀和防护等)相联系,与无机推断、实验及化学计算等学科内知识综合,尤其特别注意燃料电池和新型电池的正、负极材料分析和电极反应式的书写。
题型新颖,但不偏不怪,只要注意基础知识的落实,以及能力的训练便可以从容应对。
【知识网络】【重点知识梳理】一、原电池电极的判断以及电极方程式的书写1.原电池正、负极的判断方法:(1)由组成原电池的两极材料判断。
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断。
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)电极增重或减轻。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)有气泡冒出。
电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
2.原电池电极反应式和总反应式的书写(1)题目给定原电池的装置图,未给总反应式:①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合介质判断出还原产物和氧化产物。
③写出电极反应式(注意两极得失电子数相等),将两电极反应式相加可得总反应式。
(2)题目中给出原电池的总反应式:①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂参加的反应即为负极反应。
②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应注意介质的反应。

专题十 电化学基础 1.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是 A.液滴中的Cl由a区向b区迁移 B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH- C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈 D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-Cu2+ 液滴边缘O2多,在粒上发生正极反应O2+2H2O+4e-4OH-。
液滴下的Fe发生负极反应,Fe-2e-Fe2+,为腐蚀区(a)。
A.错误。
Cl-由b区向a区迁移 B.正确。
C.错误。
液滴下的Fe因发生氧化反应而被腐蚀。
D.错误。
Cu更稳定,作正极,反应为O2+2H2O+4e-4OH-。
【评析】本题考察电化学内容中金属吸氧腐蚀的原理的分析。
老知识换新面孔,高考试题,万变不离其宗,关键的知识内容一定要让学生自己想懂,而不是死记硬背。
学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能回答。
5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是: A.正极反应式:Ag+Cl--e-=AgCl B.每生成1 mol Na2Mn5O10转移2 mol电子 C.Na+不断向“水”电池的负极移动 D. AgCl是还原产物 解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,C错误;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B正确。


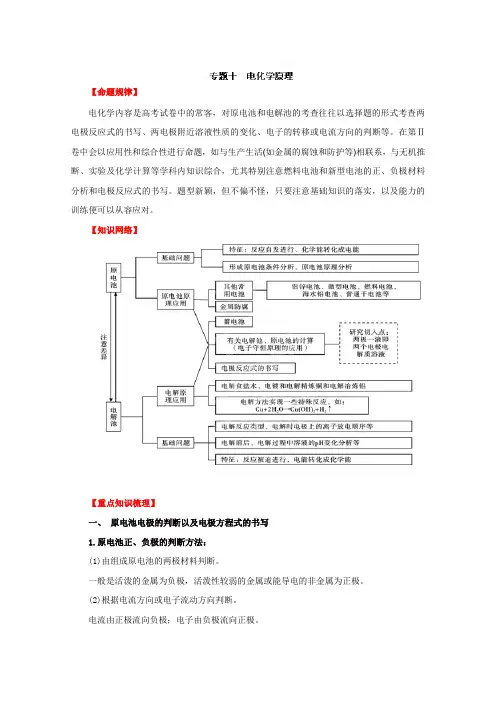
【命题规律】电化学内容是高考试卷中的常客,对原电池和电解池的考查往往以选择题的形式考查两电极反应式的书写、两电极附近溶液性质的变化、电子的转移或电流方向的判断等。
在第Ⅱ卷中会以应用性和综合性进行命题,如与生产生活(如金属的腐蚀和防护等)相联系,与无机推断、实验及化学计算等学科内知识综合,尤其特别注意燃料电池和新型电池的正、负极材料分析和电极反应式的书写。
题型新颖,但不偏不怪,只要注意基础知识的落实,以及能力的训练便可以从容应对。
【知识网络】【重点知识梳理】一、原电池电极的判断以及电极方程式的书写1.原电池正、负极的判断方法:(1)由组成原电池的两极材料判断。
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断。
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)电极增重或减轻。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)有气泡冒出。
电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
2.原电池电极反应式和总反应式的书写(1)题目给定原电池的装置图,未给总反应式:①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合介质判断出还原产物和氧化产物。
③写出电极反应式(注意两极得失电子数相等),将两电极反应式相加可得总反应式。
(2)题目中给出原电池的总反应式:①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂参加的反应即为负极反应。
②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应注意介质的反应。

电化学原理及其应用一、选择题1.中央电视台报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。
向排毒盆内倒入了纯净的温水,双脚放入盆中,启动电源开关,加入了适量精盐。
过一段时间,盆中开始出现绿色、红褐色的絮状物。
下列说法正确的是 ( ) A.绿色、红褐色的絮状物就是从脚底排出的体内毒素B.加一些精盐的目的是起到消炎杀菌的作用C.此“排毒基强离子排毒仪”一定是用惰性电极制成的D.绿色、红褐色的絮状物分别是氢氧化亚铁和氢氧化铁2.中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。
下列关于这三个工业生产的描述正确的是 ( ) A.电解法制金属钠时,负极反应式为:Na++e-===NaB.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子3.(2010·全国理综Ⅰ,10)下图是一种染料敏化太阳能电池的示意图。
电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:TiO2/S TiO2/S*(激发态)TiO2/S*―→TiO2/S++e-+2e-―→3I-I-32TiO2/S++3I-―→2TiO2/S+I-3下列关于该电池叙述错误的是 ( ) A.电池工作时,I-在镀铂导电玻璃电极上放电B.电池工作时,是将太阳能转化为电能C.电池的电解质溶液中I-和I-3的浓度不会减少D.电池中镀铂导电玻璃为正极4.(2010·安徽理综,11)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是 ( )A.电子通过外电路从b极流向a极B.b极上的电极反应式为:O2+2H2O+4e-===4OH-C.每转移0.1 mol电子,消耗1.12 L的H2D .H +由a 极通过固体酸电解质传递到b 极5.(2010·浙江理综,9)Li Al/FeS 电池是一种正在开发的车载电池,该电池中正极的电极反应式为: 2Li ++FeS +2e -===Li 2S +Fe ,有关该电池的下列说法中,正确的是 ( )A .Li Al 在电池中作为负极材料,该材料中Li 的化合价为+1价B .该电池的电池反应式为:2Li +FeS===Li 2S +FeC .负极的电极反应式为:Al -3e -===Al 3+D .充电时,阴极发生的电极反应式为:Li 2S +Fe -2e -===2Li ++FeS6.下列关于金属腐蚀叙述正确的是 ( )A .金属在潮湿空气中腐蚀的实质是:M +nH 2O===M(OH)n +n 2H 2↑ B .金属的化学腐蚀的实质是M -ne -===M n +,电子直接转移给氧化剂C .金属的化学腐蚀必须在酸性条件下进行D .在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀7.下列叙述正确的是 ( )A .在原电池的负极和电解池的阴极上都发生失电子的氧化反应B .用惰性电极电解Na 2SO 4溶液,阴、阳两极产物的物质的量之比为1∶2C .用惰性电极电解饱和NaCl 溶液,若有1 mol 电子转移,则生成1 mol NaOHD .镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀8.以惰性电极电解CuSO 4溶液。
高三二轮专题复习:电化学原理及应用[考大纲求 ] 1.认识原电池和电解池的工作原理,能写出电极反响和电池反响方程式。
2.认识常有化学电源及其工作原理。
3.理解金属发生电化学腐化的原由;认识金属腐化的危害和防止金属腐化的举措。
考点一一座“盐桥”连结“两池”形成回路1.电化学装置中都有两个电极,分别发生氧化反响与复原反响。
若两个电极插在同一电解质溶液的容器内,则因为阴阳离子的挪动速率不一样而致使两极之间出现浓度差,以及因电极本身直接与离子反响而致使两极之间电势差变小,影响了电流的稳固。
为解决这个问题,人们使用了盐桥。
盐桥主要出此刻原电池中,有时也可在电解池中出现,其主要作用就是建立闭合的内电路,但不影响反响的本质。
盐桥内常为饱和氯化钾、硝酸钾等溶液。
2.盐桥是新课改教材中出现的新名词,因此环绕盐桥的电化学知识已成为新课改地域命题的一个热门,所以有必需分析研究盐桥问题的考察思路。
往常从以下四个方面命题。
(1)考察盐桥的作用。
(2)考察含盐桥的电化学总反响式的书写。
(3)考察盐桥内溶液离子的挪动方向。
(4)考察含盐桥的电化学装置的设计。
(5)考察盐桥的作用与均衡挪动。
题组一明确原理,设计装置1. [2013 ·东理综,广 33(2)(3)](2) 能量之间可互相转变:电解食盐水制备Cl 2是将电能转变为化学能,而原电池可将化学能转变为电能。
设计两种种类的原电池,研究其能量转变效率。
限选资料: ZnSO 4(aq), FeSO4(aq), CuSO4(aq);铜片,铁片,锌片和导线。
①达成原电池甲的装置表示图 (见上图 ),并作相应标明,要求:在同一烧杯中,电极与溶液含同样的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可察看到负极 __________。
③甲乙两种原电池可更有效地将化学能转变为电能的是________,其原由是________________________________________________________________________ 。