冻干粉工艺流程图
- 格式:doc
- 大小:85.50 KB
- 文档页数:3
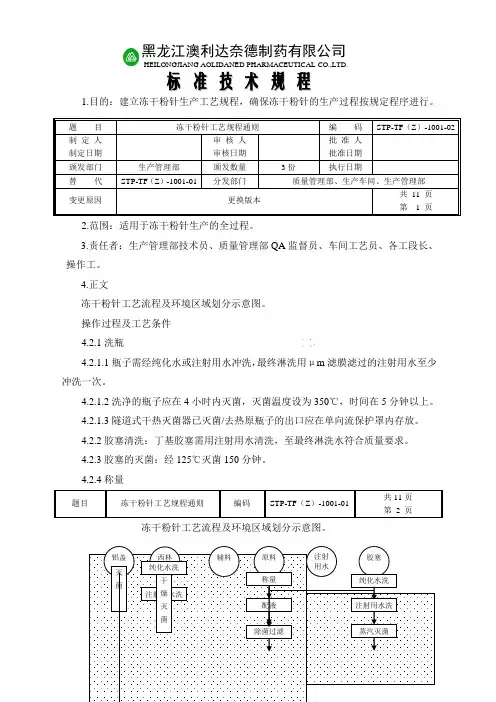
1.目的:建立冻干粉针生产工艺规程,确保冻干粉针的生产过程按规定程序进行。
2.范围:适用于冻干粉针生产的全过程。
3.责任者:生产管理部技术员、质量管理部QA 监督员、车间工艺员、各工段长、操作工。
4.正文冻干粉针工艺流程及环境区域划分示意图。
操作过程及工艺条件 4.2.1洗瓶4.2.1.1瓶子需经纯化水或注射用水冲洗,最终淋洗用μm 滤膜滤过的注射用水至少冲洗一次。
4.2.1.2洗净的瓶子应在4小时内灭菌,灭菌温度设为350℃,时间在5分钟以上。
4.2.1.3隧道式干热灭菌器已灭菌/去热原瓶子的出口应在单向流保护罩内存放。
4.2.2胶塞清洗:丁基胶塞需用注射用水清洗,至最终淋洗水符合质量要求。
4.2.3胶塞的灭菌:经125℃灭菌150分钟。
4.2.4称量冻干粉针工艺流程及环境区域划分示意图。
题 目 冻干粉针工艺规程通则编 码 STP-TF (Z )-1001-02 制 定 人 制定日期审 核 人 审核日期批 准 人 批准日期 颁发部门 生产管理部 颁发数量 3份执行日期替 代 STP-TF (Z )-1001-01分发部门质量管理部、生产车间、生产管理部变更原因更换版本共 11 页 第 1 页题目冻干粉针工艺规程通则编码STP-TF (Z )-1001-01共11页 第 2 页黑龙江澳利达奈德制药有限公司HEILONGJIANG AOLIDANED PHARMACEUTICAL CO.,LTD .标 准 技 术 规 程注射用水洗蒸汽灭菌图例﹡4.2.4.1按处方及SOP 要求配料,记录原辅料代号、品名、批号并做好称量记录。
4.2.4.2称量及计算必须复核,操作人、复核人应在记录上签名。
4.2.4.3剩余的原辅料应封口贮存。
4.2.4.4天平及其他称重设备每次使用前应校正,并定期由计量部门专人校验,校验结果应予记录。
4.2.5配液4.2.5.1配制药液用的注射用水必须符合要求。
4.2.5.2按品种进行在线控制。


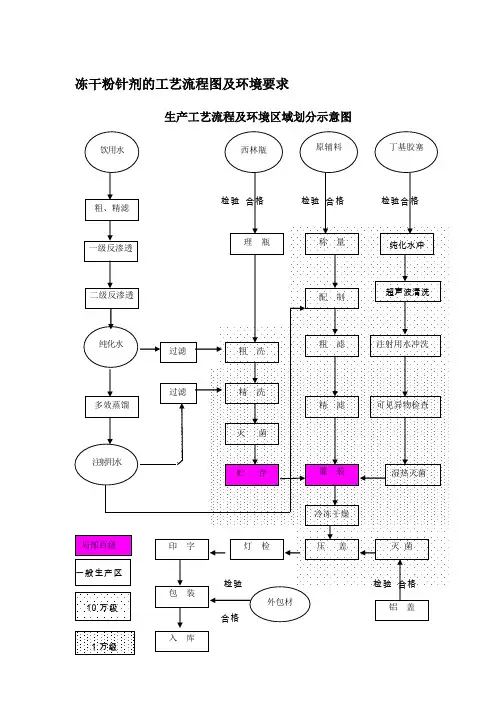
冻干粉针剂的工艺流程图及环境要求生产工艺流程及环境区域划分示意图入 库冻干粉针剂认证检查的要点冻干粉针剂指在低温真空的环境下先将配制好的药液预冻然后升华干燥成粉末状态的一种制剂。
根据药品新版GMP原则要求,结合冻干粉针剂生产影响药品质量的关键环节,提出冻干粉针剂GMP检查要点,旨在督查药品生产企业质量保证体系和实际运行状态。
检查组须对如下内容按照药品GMP要求,逐一核实。
1、机构与人员a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点a)洁净区:我国《药品生产质量管理规范》对最终灭菌的无菌药品生产厂房洁净度级别的要求是:浓配或采用密闭系统的稀配应在100000级洁净区内进行;稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区内进行;物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施这些气体因与产品直接接触,不得对产品带来污染。

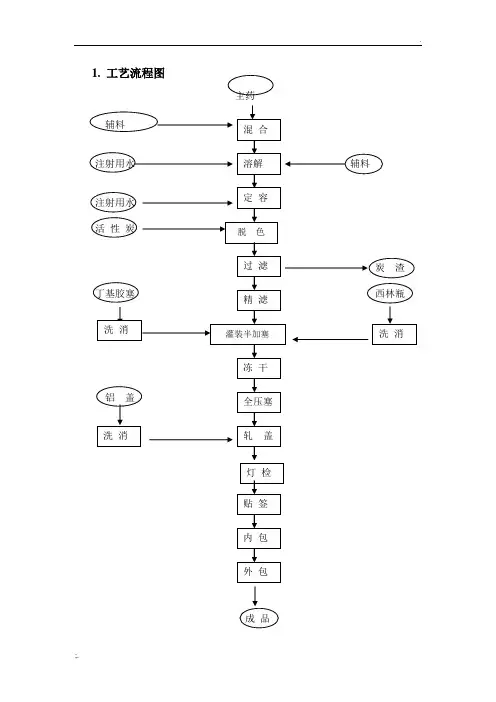
冻干粉生产工艺流程
嘿,朋友!今天咱来聊聊冻干粉这神奇玩意儿的生产工艺流程。
你知道吗?冻干粉的生产就像是一场精心策划的魔法之旅。
首先是原料的挑选,这可不能马虎,得像挑宝贝似的,精挑细选。
要找到那些品质上乘、纯净无杂质的原材料,这就好比是为一场盛宴
准备最鲜美的食材。
然后是配料环节,这就像是大厨在调配独家秘方,各种成分的比例
得拿捏得恰到好处。
多一点少一点都不行,不然这“魔法药水”可就出
不来效果啦!
接下来是混合搅拌,这可不像在家里搅鸡蛋那么简单。
得用专业的
设备,让各种成分充分融合,就像一群小伙伴手拉手,紧紧团结在一起。
然后就是过滤除菌啦,把那些捣乱的小细菌统统赶跑,留下干干净
净的精华。
这一步可重要了,要是有细菌混进去,那可就糟糕啦!
再然后是冷冻干燥。
这一步就像是把时间冻结,把水分抽走,留下
最精华的部分。
想象一下,水分就像调皮的孩子,被一下子抓住带走,只留下乖乖的有用成分。
经过一系列复杂的操作,冻干粉终于成型啦。
这时候还得进行严格的检测,确保每一批冻干粉都达到高品质的标准。
这就好比是给学生考试,只有成绩优秀的才能毕业。
在整个生产过程中,每一个环节都像是环环相扣的链条,哪一个环节出了问题,这整个“魔法”都可能失败。
所以说,冻干粉的生产工艺流程可不简单,需要高度的专业技术和严格的质量控制。
只有这样,才能生产出让我们放心使用的冻干粉。
怎么样,朋友,是不是对冻干粉的生产有了新的认识?。

冻干粉针剂的工艺流程图及环境要求生产工艺流程及环境区域划分示意图入 库冻干粉针剂认证检查的要点冻干粉针剂指在低温真空的环境下先将配制好的药液预冻然后升华干燥成粉末状态的一种制剂。
根据药品新版GMP原则要求,结合冻干粉针剂生产影响药品质量的关键环节,提出冻干粉针剂GMP检查要点,旨在督查药品生产企业质量保证体系和实际运行状态。
检查组须对如下内容按照药品GMP要求,逐一核实。
1、机构与人员a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点a)洁净区:我国《药品生产质量管理规范》对最终灭菌的无菌药品生产厂房洁净度级别的要求是:浓配或采用密闭系统的稀配应在100000级洁净区内进行;稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区内进行;物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施这些气体因与产品直接接触,不得对产品带来污染。


制作蜂王浆冻干粉及生产工艺
制作蜂王浆冻干粉及生产工艺
蜂王浆冻干粉的生产工艺方法,采用原浆过滤→加蒸馏水稀释→冷冻干燥→灭菌分装→产品的工艺路线,加水稀释后的物料以-24℃/小时的降温速率由室温降至-25~-30℃,并保持0.5~1小时,然后按冷冻升温工艺曲线分为Ⅰ、Ⅱ两个工艺阶段完成干燥操作,冻干机真空分别抽至为30~60Pa和10~30Pa(均为绝压)。
在第Ⅰ阶段,真空抽至30~60Pa(绝压),按曲线升温,在此阶段随着水分的驱除,物料液面下降,为使干燥过程均匀进行,控制热媒质流量,使液面下降速率控制在0.8~0.95mm/小时。
2~3小时后,物料升温至11~15℃;此时再进一步调高热媒质的温度10~12度,使物料温度升至42~44℃,此时全部蜂王浆干燥产品呈状网络。
通过以上的操作,90%以上的水分已被驱除,剩余水分为吸附在物料毛细管壁和极性基团上的分子水,为驱除这一部分水分,进入Ⅱ阶段升温操作干燥室真空抽至10-30Pa(绝压),原则上按升温曲线操作,其升温时间约为第II阶段时间的0.4~0.5倍,约在4~6小时使物料温度升达49~53℃。
最后,干燥物料呈海绵状,出柜水分在0.5~2%。
得到3.22kg蜂王浆冻干粉,经灭菌分装填充硬胶囊,装盒并装入硅胶袋,经60co-r辐射灭菌后,成品质检入库。
通过冻干技术加工的蜂王浆冻干粉,与常规的干燥方法相比,所得的冻干粉较优地保持了蜂王浆冻干粉的有效成分,具有良好的贮藏性能,延长了终产品蜂王浆胶囊的保质期,达到了增质降本的目的。

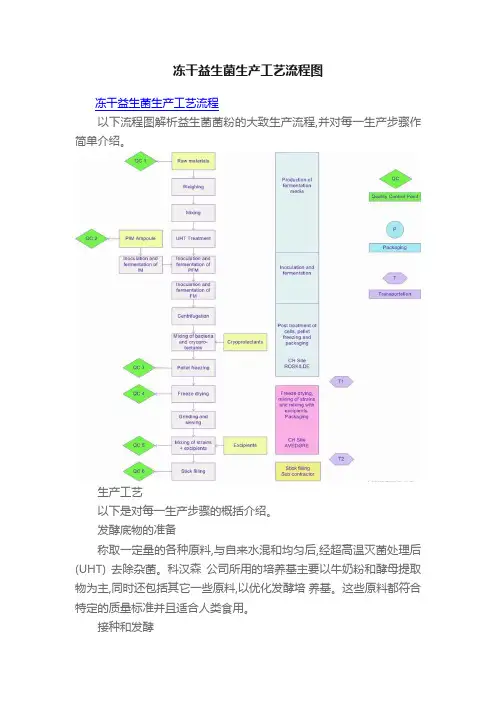
冻干益生菌生产工艺流程图冻干益生菌生产工艺流程以下流程图解析益生菌菌粉的大致生产流程,并对每一生产步骤作简单介绍。
生产工艺以下是对每一生产步骤的概括介绍。
发酵底物的准备称取一定量的各种原料,与自来水混和均匀后,经超高温灭菌处理后(UHT) 去除杂菌。
科汉森公司所用的培养基主要以牛奶粉和酵母提取物为主,同时还包括其它一些原料,以优化发酵培养基。
这些原料都符合特定的质量标准并且适合人类食用。
接种和发酵牛奶酵母培养基接种PIM (预接种)物料后孵育,然后转移到装有牛奶酵母培养基的预发酵罐中,并在厌氧条件下发酵。
其后,将预发酵罐中的物料转移到装有牛奶酵母培养基的发酵罐中,继续在厌氧条件下发酵。
浓缩和冻干分离益生菌菌体,并通过离心方法浓缩。
获得的菌丝体与抗冻剂混和后,液氮中冷冻后成小球,再通过冻干机设备真空冷冻干燥,直至较低的水分活度,以确保菌体的稳定性。
标准化利用经认可的电子工作表,来计算生产某一批号的产品所需的浓缩菌体量,以浓缩菌体的活菌数为基础,当浓缩菌体的重量比例确定下来后,就可以计算所需要的辅料的量。
磨细与混匀浓缩冻干菌体磨细后过筛,加入一定量的辅料以获得标准化的益生菌冻干菌粉,并赋予冻干菌粉所需要的加工特性。
标准化的菌粉用铝箔包装,5公斤一袋,-20°C以下冷冻储存。
经质检合格后,放行以备充填 sticks。
充填Stick铝箔袋中的大包装菌粉,在加工前先放置室温。
需在氮气流中将菌粉充填入铝箔袋中,室温控制在25°C以下,相对湿度控制在30% 以下。
充填好的sticks 装入纸板箱中,以备货运。