大输液生产工艺质量控制要点
- 格式:doc
- 大小:73.50 KB
- 文档页数:7

年产万瓶大输液车间工艺设计引言传统的输液车间是医药企业中非常重要的生产环节,其工艺设计对于药品质量的稳定性和有效性有着重要的影响。
随着技术的发展和生产需求的增加,年产万瓶大输液车间的工艺设计变得越来越重要。
本文将介绍一个年产万瓶大输液车间工艺设计的方案。
设计目标目标是设计一个高效、安全、稳定的年产万瓶大输液车间工艺,满足药品生产的需求,并确保产品质量的稳定性。
主要考虑以下几个方面:1.安全性:确保操作员和环境的安全,防止交叉污染和药品失控。
2.效率:提高生产效率,缩短生产周期,满足市场需求。
3.质量控制:确保药品质量符合相关标准,遵循GMP(GoodManufacturing Practice)规范。
4.节能环保:减少能源消耗,降低环境污染。
工艺流程以下是年产万瓶大输液车间的工艺流程设计:1.原料准备:准备所需的药品原料和辅料,确保原料的质量符合标准。
2.原料检验:对进厂的原料进行检验,包括质量、安全性和有效性等方面的检测。
3.原料称量:按照配方要求,对原料进行精确的称量。
4.水制备:准备纯净水或注射用水,确保水质符合相关标准。
5.溶剂配制:将所需的溶剂按照一定比例加入到容器中。
6.混合与溶解:将称量好的原料加入到混合容器中,进行混合和溶解。
7.过滤:对混合溶液进行过滤,去除杂质和微生物。
8.灌装和封口:将过滤后的溶液进行灌装到输液容器中,并进行封口。
9.清洗和消毒:对生产设备和容器进行定期的清洗和消毒,确保设备和容器的卫生。
10.包装和入库:对灌装好的输液产品进行包装,并入库保存。
设备布局年产万瓶大输液车间的设备布局应考虑以下几点:1.区域划分:将车间划分为原料准备区、原料检验区、生产操作区、过滤区、灌装区等区域,确保不同工艺步骤的作业分开进行。
2.设备选用:选择高效、稳定、符合GMP标准的生产设备,例如自动称量设备、混合溶解设备、过滤设备、灌装设备等。
3.环境控制:对车间的温度、湿度和洁净度进行控制,确保生产环境符合药品生产的要求。


浅谈大容量注射剂中间产品的质量控制郑光辉刘记妹(广东怡翔制药有限公司,广东广州511325)摘要:针对大容量注射剂中间产品的各个生产环节,通过原辅料的质量控制、纯化水与注射用水的质量控制、与药液接触的内包材的质量控制、中间产品的质量检验控制、活性炭的合理使用、灭菌温度与时间的控制等措施,以确保最终的注射剂成品质量满足临床使用要求,保证患者的用药安全。
关键词:大输液;中间产品;质量控制;原辅料;内包材0引言大容量注射剂又称大输液,它是一种一次性将大量的药液以一定速度的静脉滴注等方式直接进入患者体内的一种注射剂,具有疗效确切可靠、起效迅速、吸收过程短、无首过效应、生物利用率高等特点。
同时,大输液也可以作为各种注射剂载体,通过静脉滴注等方式,使药物快速、持续地发挥有效作用。
但是,由于它直接一次性将大量药液输入患者体内,避开了人体的正常生理屏障,因此会给患者带来极大的安全隐患,一旦用药不当或产品质量有异常,就会对患者的用药安全造成严重的后果。
GMP要求药品质量管理应贯穿于产品的整个生命周期。
要想确保产品合格和患者用药安全,就必须对大输液生产的各个环节进行严格的质量控制。
基于大输液的一些特点,结合笔者多年来的生产经验和GMP要求,本文将重点阐述如何控制大输液生产中的产品质量。
1原辅料的质量控制1.1原辅料的选择原辅料质量对大输液产品质量影响较大[1]。
大输液生产企业用到的原辅料必须通过合法合规渠道购进,并且经过国家药监部门批准,要求对方提供诸如《营业执照》、GMP/GSP证书、产品质检报告、质量标准等证照和资料信息,尽量选择市场口碑好、规模大的一些供应商,建立长期稳定的供应关系,必要时对生产厂家进行现场质量审计。
市场有变化或产品质量出现异常时,对需要更换的供应商进行质量评估和风险评估,同时做好使用变更后的原辅料生产出的产品稳定性考察工作,并到国家药监部门对变更的供应商进行备案。
1.2原辅料的使用为保证产品质量,制剂生产企业应对每批进厂的原辅料进行检验,尤其要严格控制原料的含量、水分、重金属、颜色、酸碱度等指标,要求各质量指标不得低于《中国药典》(2015版)的检验要求,必要时制剂生产企业可制定高于法定标准或物料质量标准的企业内控标准。

大输液生产过程影响澄明度的因素及控制措施大输液是指由静脉大剂量输入体内的灭菌注射制剂。
它的质量好坏直接关系到病人的身体健康和生命安全。
在大输液生产中,澄明度是一个突出的问题。
澄明度不合格输液中的不溶性微粒进入人体后,通过血液循环可引起肺肉芽肿、肺动脉瓣闭锁不全、脑血栓,或粘附在组织中形成病变,甚至造成死亡。
《中国药典》1985年起对大输液澄明度检查合格后进行不溶性微粒检查,并对微粒的大小及数量进行严格控制,以策安全。
而且随着医药改革的不断推进,对药品质量要求更加严格,标准越来越高。
《中国药典》2005年版对输液中可见异物有了新的规定,这对我们如何控制输液中的可见异物提出了更高的要求。
通过研究实验认为应对以下六方面进行控制和解决。
1生产工艺用水注射用水是用来溶解原料的物质,其品质优劣直接影响着产品质量和澄明度的好坏,它是影响输液澄明度的最基本因素。
如果水质不符合药典要求,如混有颗粒杂质,pH值不合格等,那么其它方面做得再好再合格,也无济于事,故水是影响大输液澄明度的最基本因素。
控制办法:依据《中国药典》,对注射用水进行全项检查,合格后方可使用。
2原、辅物料原料是形成成品的物质,辅料是帮助成品形成的物质,如果原料、辅料、材料不符合规定,如发霉、潮解变质、其他杂质超标,质量不符合规定,那也将严重影响着输液的澄明度。
因而认真选择原辅材料是控制输液中可见异物的又一要素。
例如葡萄糖是用玉米淀粉水解糖化而制得,原料中带有淀粉的某些杂质,如蛋白质类、脂肪类,也可能含有未完全糖化的糊精,或在制备过程中,原料或器械上混杂的无机杂质,由于盐析作用灭菌后,可析出肢体絮状沉淀,而影响溶液的澄明度。
在弱碱性溶液中,葡萄糖易脱水形成5一羟甲基糠醛,造成溶液颜色发黄,并继续分解为蚁酸、乙酸、丙酸和有色物质而影响澄明度。
所以原料的有些项目必须重点控制,如葡萄糖中的糊精和铵盐;氯化钠原料中的有机杂质及铁、钙、镁等阳离子和硫酸根阴离子;注射用水中的铵盐检查应为阴性,pH值应为 5.0~7.0之间。


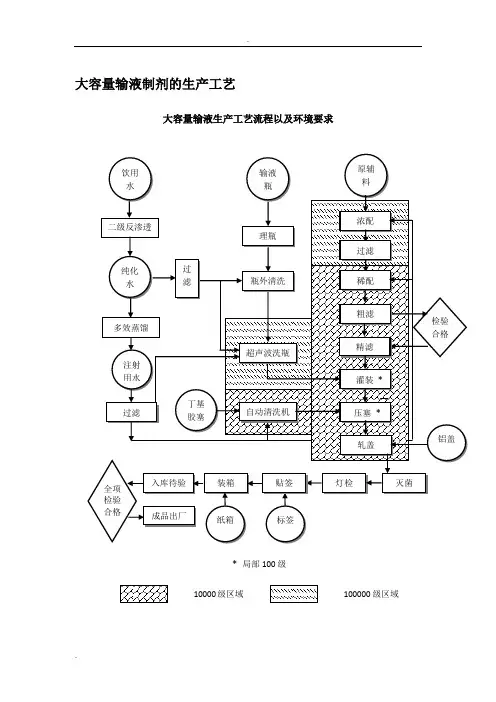
大容量输液制剂的生产工艺大容量输液生产工艺流程以及环境要求大容量输液认证检查要点大输液又名可灭菌大容量注射剂,是指将配制好的药液灌入大于50 ml的输液瓶或袋内,加塞、加盖、密封后用蒸汽热压灭菌而制备的灭菌注射剂。
1、机构与人员a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点a)洁净区:我国《药品生产质量管理规范》对最终灭菌的无菌药品生产厂房洁净度级别的要求是:浓配或采用密闭系统的稀配应在100000级洁净区内进行;稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区内进行;物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施这些气体因与产品直接接触,不得对产品带来污染。
应对系统进行验证。
PQ测试项目包括洁净度级别、含水量、含油量等。
d)注射用水(WFI)系统以纯化水为原水,经多效蒸馏制得。

输液车间培训资料——药品基础知识及大容量注射液(大输液)生产工艺药品的定义:它是用于预防(疫苗)、治疗(对症下药)、诊断人体疾病(诊断试剂辅助疾病的诊断),有目的地调节人体机能(平时补充的微量元素)并规定有适应症(对症下药)、用法和用量的物质(举例说明:镇痛药物杜冷丁,吗啡)。
它是一种特殊商品,正因为它的特殊性,所以它的生产、销售、使用都有特殊的要求。
cGMP Good Manufacturing Practice(药品生产质量管理规范)就是药品行业的生产规范。
输液生产线的生产工艺流程:公用系统(司炉岗位,空压系统,空调系统,水处理系统)-配制岗位(产品内在质量的核心所在)-灌封岗位(产品外观质量的核心,同时也会影响产品内在质量-灌装部分的暴露)-装车岗位(复核产品外观质量)-灭菌岗位(最终灭菌药品,保险措施-药品在配制和灌装过程中的污染)-包装岗位(产品外观质量和内在质量)-翻箱岗位(最后一个岗位)一、概述注射剂:通过,肌肉注射,静脉滴注或静脉推注直接直接进入人体血液系统,不经过肝脏的代谢,分为大容量注射剂(大于50ml)和小容量注射剂(小于50ml)。
大容量注射剂(大输液)的定义是指由静脉滴注输入体内的大剂量注射液,是注射剂的一个分支。
(一)输液种类1、电解质输液补充体内水分、电解质、纠正体内酸碱平衡(N.S,COM-NS,乳酸钠林格注射液)2、营养输液糖类输液、氨基酸输液、脂肪乳剂输液(GS)3、胶体输液胶体输液有多糖、明胶类、高分子聚合物等(右旋20或右旋40)4、治疗性输液:抗生素,抗病毒(乳酸左氧氟沙星,替硝唑注射液,甲硝唑注射液和利巴韦林注射液等)(二)输液的质量要求由于输液是经静脉直接输入人体内部,因此必须确保输液质量,其质量要求有:1.安全性:不能引起对组织刺激或发生毒性反应,必须经过必要的动物实验,确保使用安全。
2.稳定性;输液系水溶液,从制造到使用要经过一段时间,故要求具有必要的物理稳定性和化学稳定性,确保产品在贮存期内安全有效。

一、大容量注射剂的剂型特点和其他无菌制剂相比,大容量注射剂的特点在于体积大,导致:(1)发生微生物污染、内毒素污染和微粒污染后对使用者的后果更严重;(2)降低微生物、内毒素和微粒污染的技术复杂性较高;(3)厂房面积大且高,维持厂房洁净度的难度大、成本高 ;(4)生产设备体积大且固定,需要在线清洁和消毒灭菌 ;(5)工艺管路和在线清洁消毒管路并存,连接复杂,发生污染和交叉污染的风险大;(6)大规模地处理物料和包装材料,生产周期较长,发生微生物污染并在生产过程中繁殖的概率增加。
GMP 的不少基本要求,以及对无菌制剂的特殊要求,对本剂型而言需要特殊关注并从严掌握。
二、生产工艺流程大容量注射剂的生产工艺流程图(略)(一)原料称重在 D 级区进行。
应设计有足够大的待称重原料和己称重原料的存放场地。
称量器具的量程应合用。
同一批产品使用的多种原料应集中存放。
应由中间控制人员对称好的物料及分量进行双重复核。
技术先进的企业已采用计算机化的自动物料识别一分量控制系统代替人工复核。
(二)配制1.浓配和稀配我国大部份企业采用浓配一稀配两步。
通过加入活性炭粉末于热的浓溶液中, 以吸附份子量较大的杂质,如细菌内毒素。
但该工艺有明显的缺点:①活性炭中的可溶性杂质将进入药液而无法除去 ;②容易污染洁净区和空调净化系统。
从风险一利益角度,更合理的配制工艺是一步配制。
2.一步配制法目前工业发达国家已普遍取销了加活性炭浓配一过滤一稀配的传统工艺,而采用不加活性炭的一步配制工艺。
一步配制法避免了传统工艺的风险。
采用一步配制法的前提是原料生产企业采用可靠的去除细菌内毒素污染的工艺,如粗品溶解后加活性炭处理后结晶,使活性炭带入的可溶性杂质留在母液中。
原料生产企业还应采取防止微生物污染的措施,能稳定可靠地供应微生物和细菌内毒素污染受控的原料。
配制投料过程中应通过采集核对物料标签等措施进行投料复核,保证原辅料按要求加入。
(三)过滤大容量注射剂通常采用孔径为 O.22 微米的弹筒式终端过滤器,并配合使用适当的预过滤器,截留溶液中的微粒和微生物。

大输液生产工艺质量控制要点大输液生产工艺质量控制要点........ 制备注射用水一.用于蒸憾器1)水源:去离子水2)冷却水:洁净的软水(即生活用水)二.蒸憾水质量检査1)生产时:每台每隔2小时检査氯化物,酸碱度,易氧化物的钱盐2)贮藏时:每星期全项检査一次三.蒸馅水贮藏条件1)容器:不锈钢罐或搪瓷罐2)温度:80摄氏度以下3)时间:不超过12小时-------- 洗输液瓶一•常水冲洗1)温度:60摄氏度〜70摄氏度2)压力:不低于9.81 X 10Pa3)时间:不低于三秒4)次数:2~3次二精洗1)次数:2-3次2)压力:不低于9.81 X Pa3)时间:不少于3秒4)末道滤材:0.8-1.2um微孔滤膜5)蒸馅水澄明度:200ml容量瓶不得有可见异物一.浓配1)活性炭用量:0.02%(g/ml)2)煮沸时间:10-15min3)药液浓度不低于50%二.稀配1)活性炭用量0.01%(g/ml)2)药液温度:40~60摄氏度质量检査:1)含量:97・5%~102.5%2) PH:应符合规定三.滤材1)炭脱:砂棒或钛合金制成的滤棒2)初滤:垂熔玻璃滤器3)精滤:0.8-1.2um微孔滤膜四.微孔滤膜1)磨砂棒灯检:均无亮点2)起泡点试验:合格五.无菌要求配料间空气菌落数:9cm培养皿,暴露空间30minih小于15个六•药液温度控制:含盐品种:40~50摄氏度七•药液温度控制:含糖品种:50~60摄氏度........ 洗涤纶薄膜质量要求1)乙醇浓度:95%2)浸泡时间:大于8小时3)加盐煮沸:100摄氏度.30min,消除静电效应4)漂洗水澄明度:200ml容量瓶仅允许有微量白点洗涤橡皮塞一.NaOH1)浓度:l%(g/ml)2)温度:100摄氏度3)时间:30分钟二HC11)浓度:l%(g/ml)2)室内温度15~25摄氏度浸泡3)时间30分钟三•洗胶塞水澄明度检查:200ml容量瓶检査允许微量白点灌装一•药液澄明度:200ml容屋瓶检査应无异物二容量l)500ml: 500〜510ml2)250ml: 250-255ml三•药渡稀释到灌装时间:不超过4小时四.空气菌落数:9cm培养皿,暴露空间30min<10个质量检査:不松动,不缩皮,不切皮. 灭菌一•从灌装到灭菌的时间:不超过45分钟二.温度:不低于112715摄氏度三•压力:不低于 6.34X10000Pa四.时间:不低于30分钟五.灭菌升温时间:10~15分钟六.测温点:不低于2个•灯检一•视力检査:1)次数2次/年二结果:远近视力大于0.9三.被检药液温度室温四.时间不低于4秒/瓶输液生产工艺质量控制要点。

可灭菌大容量注射剂(大输液)可灭菌大容量注射剂又名大输液、输液剂。
是指将配制好的药液灌入大于50ml的输液瓶或袋内,加塞、加盖、密封后用蒸汽热压灭菌而制备的灭菌注射剂。
常用的输液瓶的玻璃瓶和塑料瓶两种。
重点介绍玻璃瓶装的大容量注射剂的实施要求。
制剂管理要点1. 配制:本工序包括称量、浓配、稀配及半成品检验、过滤等过程。
(1) 称量1)配料前核对原辅料品名、规格、批号、生产厂及数量,并应具有原辅料检验报告单。
调换原辅料生产厂及特殊品种需有小样试制合格报告。
2)原辅料投料量的计算、称量及投料必须复核,操作人、复核人均应在原始记录上签名。
3)剩余的原辅料应封口贮存,在容器外标明品名、批号、日期、剩余量及使用人签名。
4)天平、磅秤每次使用前应校正,并定期由法定部门专人校验、做好记录。
(2) 配制及过滤1) 每个配制罐须标明配制液的全名、规格和批号。
2)板柜过滤机应每次过滤完毕,立即清洗,按清洁操作规程处理。
药液终端用孔径为0.45~0.65μm的滤膜过滤。
3)接触药液的一切容器具,使用前后都必须用注射用水清洗。
更换品种或停用一天以上时必须以清洁剂处理,再以注射用水洗涤至清洁。
4)使用微孔滤膜时先用注射用水漂洗至无异物脱落,并在使用前后作起泡点试验。
5)药液经含量、pH值半成品检验合格后方可精滤。
调整含量须重新测定。
精滤药液经澄明度检查合格后才能灌装。
6)使用的注射用水在80℃以上保温下其贮存时间不宜超过12h。
7)直接与药液接触的惰性气体,用前需经净化处理,其所含微粒量要符合规定的洁净度要求。
2. 洗瓶(1) 瓶子在准备室除去外包装后送至粗洗室。
(2) 选用适当的去污剂,用饮用水精洗,用纯水洗涤内外壁,再用澄明的纯水精洗,最后用孔径为0.45μm滤膜滤过的注射用水洗净。
(3) 定时检查洗瓶质量。
3. 灌装灌装机上盛装药液的容器、管道和管件使用前应以注射用水洗净,更换产品需用清洁剂处理。
软管应选用不落微粒者,特殊产品专用。
软袋大输液生产中常见问题和解决办法国内现有非PVC 膜软袋大输液生产线约一百多条,在使用过程中出现了这样那样的问题,影响了正常生产,我就生产过程中常遇到的一些问题及解决方法与大家共同研究并将方法与大家一起讨论:一.软袋试生产时微粒超标及澄明度问题。
1.所有影响均不超过五种因素,人,机,料,法,环。
1.1人的影响。
由于新员工自身及洁净服清洁消毒不彻底带来影响。
由于人员数量多带来影响,由于操作幅度大带来影响,操作动作不标准带来影响。
解决方法:严格遵循相关清洁SOP ,严格按GMP 文件控制进入洁净区人员,严格按操作规程及相关文件操作。
1.2机。
由于设备磨合产生金属以及其他微粒,产生影响,由于设备运行不正常造成卡阻,产生微粒尘埃。
由于处理故障,维修造成的污染,设备正常运行产生一定的影响和污染。
解决方法:按设备清洁维修相关文件操作,设备运行时间严格控制,不过度延长设备运行时间,不让设备带病运行,出现问题查找原因,及时处理。
1.3物料的污染。
进入洁净区的物料,经外清(传递窗)脱外包,进行酒精消毒进入,不储存过多的物料。
1.4法。
工艺及操作法严格验证,确定其污染程度,并采取相关设施措施和方法。
1.5环。
环境空调的净化。
浮游菌,沉降菌,尘埃粒子,测试验证确保其效果,静态动态测试比较。
总之,各个因素都有一定的影响,只有将各种因素地影响都降低到最低程度,才能保证最终效果。
二.软袋生产中的塑屑问题。
1. 产生的原因。
包材本身所带有的,设备运行中产生的,(分膜刀,夹子,取袋杆,灌装头,去接口,盖处)。
2.方法。
包材减少装卸次数,包装最好为真空包装,纸箱有强度有支撑力,内部双层包装。
调整送盖轨道接口轨道,振荡筛,同步带卡子位置,胫热合位置。
取盖头,灌装头各部位位置对正,借触面圆滑,表面光洁,无倒角。
在上接口位置及定位停顿位置加离子风吹,真空吸收。
三.软袋生产渗漏问题。
接口与膜焊接处出现渗漏现象。
主要原因及解决方法如下:1.包材影响。
软袋大输液的生产工艺软袋大输液是一种常用的医疗器械,用于将药物或营养液输送到人体血液中。
它的生产工艺是一个复杂而精细的过程,需要严格的质量控制和高度的生产技术。
本文将从原料准备、药物配制、包装灭菌等方面介绍软袋大输液的生产工艺。
软袋大输液的生产工艺需要准备一系列的原料。
其中,主要原料包括药品、溶剂、滤器、软袋等。
药品是输液的主要成分,需要根据不同的药物和剂量进行准确配制。
溶剂用于溶解药物,并确保药液的稳定性。
滤器用于过滤药液,去除杂质和微生物。
软袋是输液的容器,需要符合一系列的标准,如无毒、无菌、耐压等。
药物配制是软袋大输液生产工艺的关键步骤。
药物配制需要在无菌条件下进行,以确保药液的纯净性和安全性。
首先,将准备好的药品和溶剂按照一定的比例加入到配制容器中。
然后,通过搅拌、混合等方式使药物充分溶解和均匀分布。
在整个过程中,需要严格控制温度、pH值等参数,以确保药物的质量和稳定性。
接下来是软袋的制备和包装。
软袋的制备需要使用特殊的材料和设备。
首先,将药物配制好的溶液通过一系列的管道输送到软袋中。
软袋具有一定的弹性和耐压性,可以容纳一定的药液容量。
然后,使用高温高压的方法将软袋进行密封,确保药液的无菌性和安全性。
最后,对软袋进行外观检查和质量检测,确保软袋的完整性和符合标准。
最后是灭菌和包装。
灭菌是软袋大输液生产工艺中非常重要的一步。
灭菌的目的是杀灭软袋和药液中可能存在的微生物,确保药液的无菌性。
常用的灭菌方法包括高温高压灭菌、辐射灭菌等。
在灭菌之后,软袋需要经过一系列的包装流程,如贴标、装箱等,最终成品可以出厂。
软袋大输液的生产工艺需要严格控制每个环节,确保药液的质量和安全性。
在整个生产过程中,需要严格遵守相关的法律法规和标准要求,如GMP、ISO等。
此外,注重员工的培训和技术支持,提高生产效率和质量。
软袋大输液的生产工艺是一个复杂而精细的过程,需要严格的质量控制和高度的生产技术。
通过合理的原料准备、药物配制、包装灭菌等步骤,可以生产出质量稳定、安全可靠的软袋大输液产品,为医疗事业提供良好的支持。
大容量注射剂生产过程中不溶性微粒的控制0 引言大容量注射剂也称大输液,属于临床上很常见的药物制剂,药物利用静脉滴注进入患者血液,因为过程中没有吸收作用,因此具有显著的效果。
然而假如静脉输液中夹杂了不溶性微粒等其他一些杂质,这对于患者的生命安全而言,会产生巨大的影响。
微粒的控制是输液质量控制的关键构成要素,在大输液的生产过程中必须被特别的注意[1] 。
1不溶性微粒的构成以及危害性大多数的不溶性微粒通常是一些无法代谢物质,一旦其直径在60um 之下,肉眼很难发现,即便是一些合格的产品中或多或少都会被微粒污染。
微粒的主要是由碳酸钙,氧化锌,以及玻璃屑等其他一些类似的物质构成。
因此其对于输液会产生一些不利反应,譬如热原反应,过敏反应以及其他静脉炎等相关的病症。
2输液生产中导致微粒污染的因素具体来看,其污染的主要因素可以从以下方面进行入手分析:首先是不合适的过滤装置以及操作措施,滤膜比较薄的情况,一旦滤膜两边的压力出现巨变的话,很容易使得滤膜出现破裂,降低过滤的成功率;其次是容器的因素,使用一些老旧的输液瓶以及容器没有清洗干净的话,都会出现一定程度的微粒污染。
另外胶塞的质量对于输液微粒的质量也有显著的影响。
尽管目前塑料输液袋主要由聚氯乙烯膜制作的,但是其中含有大量的增塑剂以及稳定剂,同时塑料具有透水性的特点,因此过程中也会产生较多的不利因素;最后是生产环境,灌装机上同药液相接触的容器,关键不干净,灌装间空气蕴含大量的尘粒,在一定程度对产品的质量造成影响[2] 。
3大输液中微粒的控制措施和手段具体可以以下方面入手进行控制:首先选择优良的原材料同时经过科学的处理,输液瓶在使用之前,必须使用一定的洗涤剂进行清洗,同时使用过滤膜将过滤的水对其进行清洗。
胶塞对于输液的微粒影响也比较大,因此在胶塞的选择上,应该选择一些化学稳定性强的卤化丁基胶塞。
现多为氯化或溴化丁基胶塞,在使用之前进行相关的处理。
一般用注射用水漂洗,在漂洗时防止过度清洗。
摘要:大输液是大容量注射剂的别称,其属于现阶段医院开展临床急救中的必需药品,利用滴注的方法达成进入人体内部的目的。
用量较大以及用药途径相对特殊是大输液临床用药的基本特征,现阶段医学领域主要谈论的大输液质量问题包含微粒问题、热源反应以及细菌污染等。
下面本文以大输液生产质量要求为切入点展开论述,通过质量要求梳理结果得出有效的质量控制措施,希望可切实提升大输液的生产质量水平,确保其在临床治疗中应用的有效性。
关键词:大输液生产质量质量控制大输液是对最终灭菌大容量注射剂产品的别称,其属于临床治疗和抢救过程中应用的必需药品,用途广以及用量大是其临床应用的主要特征。
众所周知,输液是通过静脉途径以滴注方式进入人体血液循环的一种治疗方法,其不仅起效快,而且具有治疗效果显著的优势,由此可见大输液于临床治疗和抢救过程中应用的重要意义。
但是其也具有较大的潜在危险性,一旦产品质量未得到有效控制便会对患者的生命安危造成直接影响,因此需要给予大输液生产过程及质量控制相应的关注和重视。
一、大输液概述就大输液而言,依照其临床功用进行大致分类,主要为体液平衡用输液、血容量扩张用输液、营养用输液、治疗用药物输液、透析造影剂输液。
最近几年随着我国医疗水平的提升输液产品也得到快速发展,已经逐渐发展为现阶段我国医药行业的主要制剂之一。
由输液产品的生产角度展开思考,其包装容器先后经历了几个时期的变化,当前阶段我国输液市场上主要就玻璃、塑料瓶、非PVC软袋、直立式软袋等几种包装容器的应用。
其中直立式软袋包装技术具有更加安全有效实用的优势,与药用、环保方面的要求相符,所以其是大输液包装技术后续的主要发展方向。
二、梳理大输液生产质量要求上述讲到大输液乃是临床救治过程中应用的一种必需药品,其利用静脉滴注方式进入人体内部的血管系统,治疗效果显著且见效较快是其临床应用的主要优势。
将国家规定的药品生产质量要求作为基本依据,对大输液生产过程中的质量控制问题,比如:细菌毒素检查、输液微粒物检测等提出了全新要求。
大输液生产工艺规程目的:建立一个大容量注射液(大输液)生产的通用工艺规程,为车间提供一个通用技术标准大输液生产工艺规程大输液生产工艺规程部门:生产部题目:大输液生产工艺规程 3/15 文件编号:STP-PC-99000 (01) 新订: 替代: 起草: 部门审阅:质里审核:批准:执行日:灯检贴签 注:洁净级别万级 万级灭菌岀厂I入库 ____________ 包装100 级 ----------------- 厂大输液生产工艺规程的:修订人:批准执行日:工作区域及清洁消毒方法岗位 区域洁净度级别清洁消毒方法制水 一般生产区A每日用自来水冲洗、抹净,管道、罐体蒸镏水清洗后用纯蒸汽火菌。
洗瓶理瓶 一般生产区B每日用0.1%新洁尔灭对设备、墙壁、 门窗抹净,地面用水拖净。
粗洗 一般控制区 >10 万级 C 每日用0.1%新洁尔灭对设备、墙壁、 门窗抹净,拖净地面。
精洗洁净控制区1万级D每日用0.1%新洁尔灭对设备、墙壁门 窗抹净,拖净地面,并紫外灯或臭氧 灭菌30分钟。
漂洗薄膜 洁净控制区 1 万级 每日用0.1%新洁尔灭对设备、墙壁、 门窗抹净,拖净地面,并紫外灯或 臭氧火菌 30分钟。
洗胶塞粗洗 一般控制区 >10 万级 每日用0.1%新洁尔灭对设备、墙壁、 门窗抹净,拖净地面。
精洗洁净控制区1万级每日用0.1%新洁尔灭对设备、墙壁、 门窗抹净,拖净地面,并紫外灯或臭 氧火菌 30分钟。
配液 洁净控制区 1 万级 每日用0.1%新洁尔灭对设备、墙壁、门 窗、抹净,拖净地面,并紫外灯或臭氧 灭菌30分钟。
罐体及管道、滤器清洗后 蒸汽火菌30分钟。
灌装 洁净区 1万一100级 每日用0.1%新洁尔灭对设备、墙壁、门窗 抹净,拖净地面,并紫外灯对照 30分钟,臭氧灭菌30分钟。
轧盖 火菌 灯检一般控制区 一般生产区 一般生产区>10 万级 每日用0.1%新洁尔灭对设备、墙壁、门窗 抹净,拖净地面。
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点
-------------制备注射用水
一.用于蒸馏器
1)水源:去离子水
2)冷却水:洁净的软水(即生活用水)
二.蒸馏水质量检查
1)生产时:每台每隔2小时检查氯化物,酸碱度,易氧化物的铵盐2)贮藏时:每星期全项检查一次
三.蒸馏水贮藏条件
1)容器:不锈钢罐或搪瓷罐
2)温度:80摄氏度以下
3)时间: 不超过12小时
-------------洗输液瓶
一.常水冲洗
1)温度: 60摄氏度~70摄氏度
2)压力: 不低于9.81×10Pa
3)时间: 不低于三秒
4)次数: 2~3次
二.精洗
1)次数: 2~3 次
2)压力: 不低于9.81×Pa
3)时间: 不少于3秒
4)末道滤材: 0.8~1.2um微孔滤膜
5)蒸馏水澄明度: 200ml容量瓶不得有可见异物
-------------配液
一.浓配
1)活性炭用量: 0.02%(g/ml)
2)煮沸时间: 10~15min
3)药液浓度不低于50%
二.稀配
1)活性炭用量0.01%(g/ml)
2)药液温度: 40~60摄氏度
质量检查:
1)含量:97.5%~102.5%
2)PH: 应符合规定
三.滤材
1)炭脱: 砂棒或钛合金制成的滤棒
2)初滤: 垂熔玻璃滤器
3)精滤: 0.8~1.2um 微孔滤膜
四.微孔滤膜
1)磨砂棒灯检: 均无亮点
2)起泡点试验: 合格
五.无菌要求
配料间空气菌落数: 9cm培养皿,暴露空间30minih 小于15个
六.药液温度控制: 含盐品种: 40~50摄氏度
七.药液温度控制: 含糖品种: 50~60摄氏度
-------------洗涤纶薄膜
质量要求
1)乙醇浓度: 95%
2)浸泡时间: 大于8小时
3)加盐煮沸: 100摄氏度. 30min,消除静电效应
4)漂洗水澄明度: 200ml容量瓶仅允许有微量白点
-------------洗涤橡皮塞
一.NaOH
1)浓度: 1%(g/ml)
2)温度: 100摄氏度
3)时间: 30分钟
二.HCl
1)浓度: 1%(g/ml)
2)室内温度15~25摄氏度浸泡
3)时间30分钟
三.洗胶塞水澄明度检查: 200ml容量瓶检查允许微量白点
-------------灌装
一.药液澄明度: 200ml容量瓶检查应无异物
二.容量
1)500ml : 500~510ml
2)250ml : 250~255ml
三.药渡稀释到灌装时间: 不超过4小时
四.空气菌落数: 9cm培养皿,暴露空间30min<10个
-------------轧盖
质量检查: 不松动, 不缩皮, 不切皮. -------------灭菌
一.从灌装到灭菌的时间: 不超过45分钟
二.温度: 不低于112~115摄氏度
三.压力: 不低于6.34×10000Pa
四.时间: 不低于30分钟
五.灭菌升温时间: 10~15分钟
六.测温点: 不低于2 个
-------------灯检
一.视力检查: 1)次数2次/年
二.结果: 远近视力大于0.9
三.被检药液温度室温
四.时间不低于4秒/瓶
输液生产工艺质量控制要点
工艺
项目控制要点类别。