免疫沉淀试验
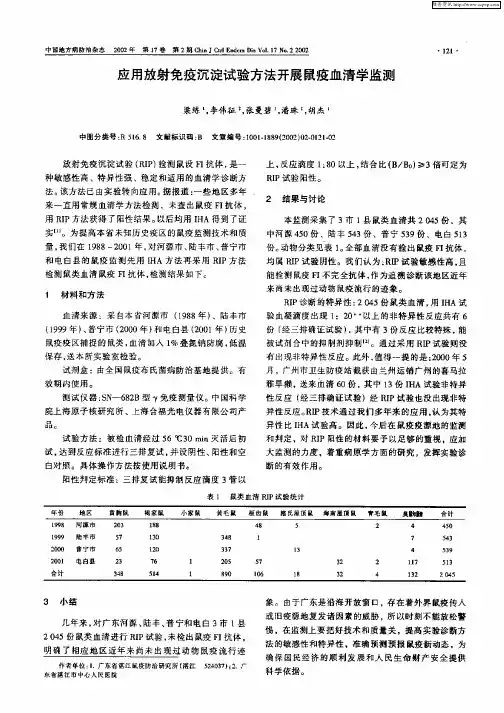
- 格式:ppt
- 大小:2.87 MB
- 文档页数:25

临床医学检验临床免疫技术:沉淀反应测试题(题库版)1、单选在琼脂板上打两排孔,左侧孔加入待测抗原,右侧孔加入已知抗体,抗原在阴极,抗体在阳极。
通电后,抗原泳向阳极,抗体流向阴极,观察在两者之间或抗体侧形成沉淀线。
本试(江南博哥)验采用的是OA.免疫电泳B.免疫固定电泳C.蛋白电泳D.火箭电泳E.对流免疫电泳正确答案:E参考解析:对流免疫电泳原理是将双向扩散试验与电泳相结合的定向加速免疫扩散技术。
2、单选不是免疫比浊试验中伪浊度形成的原因()A.高血脂标本B.标本反复冻融C高效价抗体(>1:200)D低效价抗体(<1:20)E.试剂污染正确答案:C3、单选沉淀反应的钩状效应现象指的是OA.抗原过量B.抗体过量C.沉淀物显著D.凝集明显E.抗原和抗体的比例正确答案:A4、单选对流免疫电泳中,抗体向阴极移动原因是OA.抗体带正电B.抗体带负电C.电渗作用D.电泳作用E.抗原带正电正确答案:C参考解析:对流免疫电泳的原理是将双向扩散试验与电泳相结合的定向加速的免疫扩散技术。
通电后,在pH8.4缓冲液中带负电荷的蛋白质抗原流向阳极抗体侧,而抗体借电渗作用流向阴极侧,在两者之间或抗体侧形成沉淀线。
5、单选下列有关沉淀反应第二阶段的说法,错误的是OA.形成可见的免疫复合物B.出现肉眼可见的沉淀线或沉淀环C.可用散射比浊测定反直结果D.几秒钟至几分钟内即完成E.可用透射比浊测定反应结果正确答案:D6、单选环状沉淀试验中要求OA.抗原澄清B.抗体澄清C.抗原和抗体都必须澄清D.对抗原和抗体没有特别要求E.抗原比重大于抗血清正确答案:C参考解析:环状沉淀试验:在一定内径(1.5→.Omm)的玻璃管中先加入抗血清,再沿管壁加入抗原溶液,因抗血清比重大于抗原,故在两者交界处形成清晰界面,此处抗原抗体生成物在一定时间内形成白色环为阳性。
要求:抗原抗体溶液澄清。
适用于微量抗原测定。
考点:环状沉淀试验7、单选下列关于光学检测原理的叙述何者正确OA.荧光检测时,激发光与发射光处于同一直线上B.反射比色检测时,入射光与反射光处于同一直线上C.透射比浊检测时,入射光与透射光处于同一直线上D.散射比浊检测时,入射光与散射光处于同一直线上E.磷光计检测时,入射光与发射光处于同一直线上正确答案:C参考解析:透射比浊法的基本原理是测定一定体积的溶液通过的光线量,当光线通过时,由于溶液中存在的抗原抗体复合物粒子对光线的反射和吸收,引起透射光的减少,测定的光通量和抗原抗体复合物的量成反比。




第章免疫沉淀试验1. 概述免疫沉淀试验(Immunoprecipitation,IP)是一种利用抗体识别并沉淀目标分子的方法,常用于生化研究中分离和富集特定蛋白质复合物或蛋白质与其结合的DNA或RNA。
该技术基于免疫学原理,利用抗体具有特异性结合的特点来选择性地富集目标蛋白质,进行蛋白质荷瘤、互作和定量分析等研究。
该方法在蛋白质组学、信号通路分析、基因表达调控等领域得到广泛应用。
2. 实验原理IP技术主要包括两个步骤:先配制抗体与其结合的固相载体,再将条件适宜的样品与载体中的抗体结合。
2.1. 抗体的选择抗体的选择是IP技术成功的关键。
其中最为关键的是抗体的特异性。
在选择时,需对要纯化的物质进行充分的了解,选出特异性良好的抗体。
同时,需考虑到其他相关蛋白质的影响以及抗体与其它宿主组织中的蛋白质的结合。
在实验中,一些常用抗体如抗Flag、acetylated lysine、His-Tag等,被广泛的用于IP实验。
2.2. 实验步骤步骤1配制包含抗体的固定相将抗体加到含有固定相的缓冲液中,可形成抗体定向固定相。
多数情况下,固定相都是用时反转半胱氨酸(Protein A)或静脉曲张病毒蛋白(Protein G)制备的。
这两种蛋白质都具有特异性,可结合某些种类的免疫球蛋白底部部分。
同种类的免疫球蛋白的Fc部分的结构是特异性的,因此结合蛋白可以选择性地紧密结合免疫球蛋白。
步骤2预清洗样品将样品加入预清洗液,使它们在悬浮状态下并分散其中。
缓冲液中必须包含适当的离子强度、pH值和抑制剂,以防止目标蛋白的脱落或结合于特定的固定相。
步骤3将样品与固相中的抗体结合将固相中的抗体加入预处理和静止的样品。
它们之间的相互作用确保了蛋白质与抗体的结合。
样品被置于洗涤步骤之前的固相中,以便抗体可以识别它的目标蛋白,并在固相上固定它。
步骤4洗涤将样品从固相中分离出来并进行洗涤。
此过程涉及多次缓冲液的加入和去除,以除去非特异性结合和非特异性背景噪音,同时保持目标分子的完整性。

血清学试验方法。
以血清学试验方法血清学试验是一种常用的诊断和研究疾病的方法,通过检测血液中的抗体或抗原来判断机体免疫状态以及感染情况。
本文将介绍血清学试验的基本原理、常用的血清学试验方法以及其在临床和科学研究中的应用。
一、血清学试验的基本原理血清学试验基于机体免疫系统的特性,通过检测血液中的抗体和抗原来判断机体的免疫状态。
抗体是机体对抗原产生的一种特异性免疫应答物质,可以与抗原结合形成可见的免疫复合物。
血清学试验利用这种抗原与抗体的特异性结合关系,通过不同的方法来检测和测定血液中的抗体或抗原,从而获得有关机体免疫状态和感染情况的信息。
二、常用的血清学试验方法1. 免疫沉淀法:该方法利用抗原与抗体结合后形成的可见免疫复合物在溶液中的沉淀性质,通过观察沉淀现象来判断抗体和抗原的存在与否。
常见的应用包括免疫沉淀反应和双向免疫沉淀反应。
2. 酶联免疫吸附试验(ELISA):ELISA是一种高灵敏度、高特异性的血清学试验方法,常用于检测血液中的抗体或抗原。
该方法通过抗体与抗原结合形成复合物,再利用酶标记的二抗与复合物结合,最后通过底物的反应产生可见的颜色或荧光信号来定量检测。
3. 病毒中和试验:该试验主要用于检测抗体对病毒的中和作用。
通过将病毒与抗体混合后,观察病毒的感染和复制能力来判断抗体的中和效果。
病毒中和试验常用于病毒感染的诊断和疫苗效果的评估。
4. 血凝试验:该试验利用抗体与抗原结合后形成凝集反应,通过观察凝集现象来判断抗体和抗原的存在与否。
血凝试验常用于血型鉴定和某些感染性疾病的诊断。
三、血清学试验在临床应用中的意义血清学试验在临床应用中具有重要的意义。
首先,血清学试验可以用于疾病的早期诊断和筛查,如乙肝病毒感染的血清学检测可以早期发现感染者。
其次,血清学试验可以用于疾病的鉴别诊断,如通过检测自身抗体来判断自身免疫性疾病的类型。
此外,血清学试验还可以用于评估疫苗的效果、监测疾病的进展和判断治疗效果。

免疫共沉淀实验原理及方法-CAL-FENGHAI.-(YICAI)-Company One1免疫共沉淀实验原理及方法免疫共沉淀(CoIP)概述及原理免疫共沉淀(Co-Immunoprecipitation,CoIP)是研究蛋白-蛋白间相互作用的经典方法,属于免疫沉淀技术的一类,常被用于鉴定特定蛋白复合物的中未知蛋白组分。
免疫共沉淀的设计理念是,假设一种已知蛋白是某个大的蛋白复合物的组成成员,那么利用这种蛋白的特异性抗体,就可能将整个蛋白复合物从溶液中“拉”下来(常说的“pull-down”),进而可以用于鉴定这个蛋白复合物中的其他未知成员。
免疫共沉淀的特点可以概括为两点,第一是天然状态,第二是蛋白复合物。
免疫共沉淀的优势:与其他研究蛋白质相互作用技术(如GST-Pull down、酵母双杂交等)相比,免疫共沉淀鉴定的相互作用蛋白是在细胞内与目的蛋白发生的天然结合,避免了人为的影响,因此符合体内实际情况,得到的蛋白可信度更高。
免疫共沉淀的局限性和注意事项:1. 免疫共沉淀是建立在蛋白复合物成员间彼此紧密结合的基础上,意味着松散结合的蛋白组分很可能检测不到;2. 由于蛋白质形成复合物以后,某些表位就会被掩盖,因此可能导致使用某一种pull-down抗体,无论怎么增加抗体浓度,也极少能将不到一半的目标蛋白复合物沉淀出来,如有必要最好使用多种不同抗体分别进行CoIP;3. 由于检测的是天然状态,因此在不同的时间和不同的处理下,CoIP拉下来的蛋白复合物都可能是不同的,当然随着实验次数的增加,得到的蛋白复合物成员也会越来越庞大;4. 如果使用Western Blot的方法检测的蛋白复合物中的目标蛋白,则需要在试验前进行预测,具有一定的冒险性;当然如果将蛋白复合物直接进行质谱分析就不存在上述问题,但需要得到较高纯度和浓度的蛋白复合物样品也非易事,并且成本较高;5. CoIP鉴定得到的蛋白间相互作用可能是直接作用也可能是间接作用,进一步区分还需要进行GST-Pull down等实验检测;6. 为了保证CoIP实验的可靠性和严谨性,需要使用复合物的不同成员分别独立进行CoIP实验,并且结果应该能够彼此验证,因为原则上使用复合物的任一成员进行CoIP都会得到其他所有成员[1]免疫共沉淀的一般操作流程(中英文对照):1.用预冷的PBS洗涤细胞两次;2.Carefully wash cultured cells with pre-chilled PBS for 2 times.3.4. 2. 加入预冷的RIPA裂解缓冲液(107细胞加入1ml);5.Add in cold RIPA lysis buffer (1ml for 107cells).6.7. 3. 用预冷的细胞刮将细胞从培养介质上刮离,并转移到干净的管中。

ChIP实验精讲(做科研的必看)染色质免疫共沉淀(ChIP)概述ChIP:chromatinimmunoprecipitation assay,染色质免疫沉淀技术。
研究蛋白质与DNA在染色质环境下的相互作用是阐明真核生物基因表达机制的基本途径。
ChIP是目前唯一研究体内DNA与蛋白质相互作用的方法原理在活细胞状态下固定“蛋白质-DNA”复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学方法沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。
ChIP应用1、检测体内反式因子与DNA的动态作用,研究组蛋白的各种共价修饰与基因表达的关系;2、CHIP与基因芯片相结合建立的CHIP-on-ChIP 方法已广泛用于特定反式因子靶基因的高通量筛选;3、CHIP与体内足迹法相结合,用于寻找反式因子的体内结合位点;4、RNA-CHIP用于研究RNA在基因表达调控中的作用。
试验流程一、交联染色质免疫沉淀技术1. 细胞甲醛交联和收集注意事项:①需要优化甲醛使蛋白质和DNA交联的时间。
②交联的时间很关键。
交联的时间一般为2-30 分钟。
③交联过度会降低抗原的可结合性和超声的效率,也会被遮盖抗原的表位。
④甘氨酸可抑制甲醛的作用,终止交联反应。
1.1 取1直径10cm培养皿的细胞。
加入甲醛至终浓度为0.75%(V/V),使蛋白和DNA 交联。
1.2 室温下,轻摇10 分钟。
1.3 加入甘氨酸至终浓度为125 mM,室温下放置5 分钟,以终止交联。
1.4 吸去培养基,用冰冷PBS 洗细胞2 次。
1.5 使用细胞刮刀,加入5ml 冰冷PBS,刮下细胞,收集至一个50 ml 离心管中。
1.6 再用 3 ml 冰冷PBS 洗培养皿2次,至50ml 离心管中。
1.7 4℃,1000 g,离心5分钟收集细胞。
1.8 吸弃上清,用SDSLysis Buffer重悬沉淀(每1 X 107 个细胞加800 μl)。

沉淀反应沉淀反应特点:沉淀反应是指可溶性抗原和相应抗体在特定的条件下特异性结合所出现的沉淀现象。
沉淀反应中的抗原多为蛋白质、多糖、血清、毒素、核酸等可溶性的小分子物质。
一、概念可溶性抗原与其相应抗体特异结合,出现肉眼可见的免疫复合物,称为沉淀反应。
沉淀反应属于体外抗原抗体反应,其反应也分两个阶段:第一阶段位抗原抗体发生特异性结合,几秒到几十秒即可完成,出现可溶性小复合物,肉眼不可见;第二阶段为形成大的可见免疫复合物,如沉淀线、沉淀环等。
二、液相内的沉淀反应液相内的沉淀反应类型有絮状沉淀反应、环状沉淀反应和免疫浊度试验。
1、絮状沉淀反应在电解质溶液中,可溶性抗原与相应抗体特异性结合,当抗原和抗体分子比例合适的时,可形成絮状或颗粒状的不溶性沉淀物。
直接影响絮状沉淀的试验最重要的因素是抗原和抗体分子比例合适。
①抗原稀释法抗原进行一系列稀释与恒定浓度抗体反应②抗体稀释法抗体进行一系列稀释与恒定浓度抗原反应③方阵滴定法方阵滴定法即棋盘滴定法(二维的,既稀释抗原也稀释抗体)2、环状沉淀反应先将适量已知抗血清价值毛细玻璃管(2~3mm)底部,再沿管壁缓缓加入等体积待测样品溶液,使样品与抗血清分层清晰。
如果样品中有与已知抗体对应的可溶性抗原,会在两种液体的交界面出现白色沉淀环。
3、免疫浊度试验⑴原理:在特殊缓冲液中,分子比例合适的可溶性抗原与相应抗体形成抗原抗体复合物,使反应液出现浑浊,其浊度与免疫复合物的量成正比,利用光学测量仪器结合自动分析检测系统检测,并与一系列的标准品对照,即可计算出被检抗原或抗体的含量。
免疫浊度法按照仪器设计的不同,分为使用透射比浊仪的免疫透射比浊法和使用散射比浊仪的免疫散射法。
免疫浊度法可用于液体中的微量抗原、抗体及小分子半抗原(如药物等)的定量检测。
其优点是自动检测、操作简便快速、适合大批量标本检测、灵敏度高(可达毫微克水平)、且无放射性污染。
A、免疫透射比浊法原理及用途:当抗原抗体特异结合形成IC时,溶液浊度增加。

浅析染色质免疫沉淀(ChIP)技术在DNA与蛋白质相互作用研究中的重要性染色质免疫沉淀(ChIP)是研究蛋白质-DNA相互作用的一项强大技术,广泛用于多个领域的染色质相关蛋白的研究(如组蛋白及其异构体,转录因子等),特别适用于已知启动子序列或整个基因位点的组蛋白修饰分析研究。
这项技术采用特定抗体来富集存在组蛋白修饰或者转录调控的DNA片段,通过多种下游检测技术(定量PCR,芯片,测序等)来检测此富集片段的DNA序列。
ChIP技术自诞生之后,已成功的应用于人或动物细胞和组织[1] 、植物组织[2]、酵母[3] 以及细菌、质粒[4] 。
由于在信号转导和表观遗传研究中的突出作用,ChIP 在肿瘤[5-7]、神经科学[8-10]、植物发育[11-13] 等领域中应用非常广泛,同时有关细胞凋亡[14]、雌激素信号转导[15] 、胰岛素抵抗[16] 、组织发育[1]的文献中也用到ChIP。
目前,最常见的有以下两种ChIP实验技术:1. nChIP:用来研究DNA及高结合力蛋白,采用微球菌核酸酶(micrococcal nuclease)消化染色质,然后进行片段富集及后续分析,适用于组蛋白及其异构体,例如[17-19] ;2. xChIP:用来研究DNA及低结合力蛋白,采用甲醛或紫外线进行DNA和蛋白交联,超声波片段化染色质,然后进行片段富集及后续分析,适用于多数非组蛋白的蛋白,例如[9, 15, 20]。
X-ChIP试验的一般过程以上两种方法在分离DNA-蛋白质复合物之后,对DNA进行PCR扩增,验证目标序列的存在。
除验证实验外,ChIP DNA也可以进行测序分析,这种方法被称为ChIP-seq[22];也可做芯片分析,这种方法被称为ChIP on CHIP或ChIP-CHIP[23] 。
这两种方法都可用于分析感兴趣蛋白结合的未知序列,而不需要知道目标序列的详细信息,因此可以进行探索性的研究。
当需要对DNA结合的蛋白复合物(两个或两个以上蛋白共同结合在DNA上)进行研究时,可以采用reChIP技术对DNA蛋白复合物进行再次富集,从而分析两种蛋白同时结合的DNA片段,例如转录调控因子及其受体复合物[24]。
染⾊质与蛋⽩研究:染⾊质免疫共沉淀(ChIP)实验介绍(⼀)前⾯的⽂章中已经向⼤家介绍了免疫共沉淀技术(IP)的原理和⽅法,这⼀技术可以帮助我们便捷地探究蛋⽩与蛋⽩之间的互相作⽤。
但若研究的靶蛋⽩可能发挥组蛋⽩修饰酶的功能,或是可能作为某种转录因⼦发挥作⽤,那么就要应⽤染⾊质免疫共沉淀技术(chromatin-immunoprecipitation,ChIP)⽅法来探究其与DNA的直接调控了。
ChIP可以真实、完整地反映结合在DNA启动⼦区上的靶蛋⽩的调控信息,是⽬前基于全基因组⽔平研究DNA-蛋⽩质相互作⽤的标准实验技术。
接下来,我们⼀起来学习⼀下ChIP技术吧!1ChIP基本原理ChIP是在活细胞状态下固定蛋⽩质-DNA复合物,并将其随机切断为⼀定长度范围内的染⾊质⼩⽚段,然后通过免疫学⽅法沉淀此复合体,特异性地富集⽬的蛋⽩结合的DNA⽚段,通过对⽬的⽚断的纯化与检测,从⽽获得蛋⽩质与DNA相互作⽤的信息。
ChIP不仅可以检测转录因⼦与DNA的动态作⽤,还可以⽤来研究组蛋⽩的各种共价修饰与基因表达的关系。
基因的转录是从启动⼦区开始,由⼀系列的转录因⼦结合到基因的启动⼦区,通⽤转录因⼦结合在基本启动⼦区起始转录,⽽这个过程通常需要⼀些特异的转录因⼦结合在上游调节序列,使基因特异表达并维持的合适⽔平。
此外,基因的转录还会受到表观遗传的调控,如组蛋⽩甲基化修饰、⼄酰化修饰等,组蛋⽩特异位点的修饰均可以直接影响基因的转录⽔平。
因此,ChIP主要⽤于研究特异的转录因⼦或组蛋⽩修饰酶与下游基因启动⼦区的结合,如果ChIP发现⼆者可以结合,那么这说明该基因可能是其下游基因。
要想进⼀步证明,还要做⾼低表达和荧光素酶等实验。
⽬前,ChIP与⼀些⾼通量测序的结合,扩⼤了其应⽤范围:⽐如,ChIP与基因芯⽚相结合建⽴的ChIP-ChIP已⼴泛⽤于特定反式因⼦靶基因的⾼通量筛选;ChIP-Seq是将深度测序技术与ChIP实验相结合,可分析全基因组范围内DNA结合蛋⽩结合位点、组蛋⽩修饰、核⼩体定位或DNA甲基化的⾼通量⽅法,可以应⽤到任何基因组序列已知的物种,并能确切得到每⼀个⽚段的序列信息;RNA-ChIP⽤于研究RNA在基因表达调控中的作⽤。
免疫学实验技术
免疫学实验技术是一种用于研究和分析免疫系统的实验方法。
它涉及到各种技术和手段,用于检测、分析和研究免疫细胞、免疫分子以及免疫反应。
其中一些常见的免疫学实验技术包括:
1. 流式细胞术:这是一种用于对单个细胞进行高速分析和分选的技术。
它可以用于检测细胞表面标志物、细胞内蛋白质、细胞功能等。
2. 免疫组织化学:该技术用于检测组织样本中的特定抗原或蛋白质。
通过使用特异性抗体与组织中的目标抗原结合,然后通过显色或荧光染料进行可视化。
3. 酶联免疫吸附试验(ELISA):这是一种常用的检测体液中特定抗体或抗原的技术。
ELISA 利用抗体与抗原的特异性结合,并通过酶催化的显色反应来定量检测目标分子。
4. Western blotting:该技术用于检测蛋白质样本中的特定抗原。
它通过电泳分离蛋白质,然后将其转移到膜上,再使用特异性抗体进行检测。
5. 免疫沉淀:这是一种用于研究蛋白质-蛋白质相互作用的技术。
通过使用特异性抗体捕获目标蛋白质,然后通过沉淀和分析来确定与其相互作用的其他蛋白质。
6. 细胞培养和功能分析:免疫学实验常涉及细胞培养,如淋巴细胞的激活、增殖和功能测定,以研究免疫细胞的行为和应答。
这些技术在免疫学研究、疾病诊断、药物开发等领域都有广泛的应用。
随着技术的不断发展,新的免疫学实验技术也在不断涌现,为深入了解免疫系统的功能和机制提供了更多的手段和工具。