初中科学化学难点之指示剂与PH试纸
- 格式:ppt
- 大小:1.58 MB
- 文档页数:20

用酸碱指示剂、pH试纸两种方法鉴别盐酸氢氧化钠溶液易县高陌初级中学孙海静实验目的:利用pH 试纸和石蕊试剂两种方法鉴别稀盐酸、氢氧化钠溶液。
教学过程:前面我们已经学过了酸和碱的化学性质。
请回忆一下酸和碱的化学性质。
下面我们就一起用两种方法鉴别盐酸和氢氧化钠溶液。
实验器材:试管架[试管(15×150mm)2 支,试管刷1 支];托盘中盛放:烧杯(250mL,盛放玻璃棒 2 支)、pH 试纸、玻璃片、洁净纸、待测液A、B(1:3 稀盐酸,0.1%氢氧化钠溶液,分别盛于125mL 细口瓶,随机标示A、B)、石蕊试剂(盛于滴瓶中);废物瓶,废液瓶,抹布。
提出问题:酸性溶液能使紫色石蕊溶液变成什么颜色?碱性溶液能使紫色石蕊溶液变成什么颜色?怎样区分盐酸和氢氧化钠溶液?讨论交流:结合酸和碱的化学性质讨论归纳。
归纳总结:实验步骤:1.向两只试管中分别转移A、B 待测液A.瓶盖倒放于桌面上,倒液时瓶身标签正对手心。
B.试管口与试剂瓶口相接触,试管稍倾斜,缓缓倒入少量待测液(不超过2mL)。
2.方法一:用pH 试纸鉴别A.用洁净纸擦拭玻璃棒和玻璃片。
B.取两条pH 试纸,置于玻璃片上,用两支洁净干燥的玻璃棒蘸取少量待测液A、B,分别滴于两条pH 试纸上,观察试纸的颜色变化。
C.及时与比色卡对照,确定待测液的pH。
3.方法二:用石蕊试剂鉴别正确使用胶头滴管向A、B 两只试管中逐滴滴加指示剂。
4.得出结论,A.根据pH 及现象判断待测液A 的酸碱性。
B.根据pH 及现象判断待测液B 的酸碱性。
5.整理器材清洗玻璃仪器,整理器材放回原处,擦拭桌面。
6.填写实验报告教学反思成功之处:本节课是学生实验课,锻炼学生的实验动手能力,并在实验中利用分组的形式,培养学生的竞争意识以及组内的团队合作精神。
为了充分发展学生的思维,培养创新精神,使学生自发地萌生对酸和碱化学性质的认识。
不足之处:个别学生不会在小组中不与同学合作实验,造成本节课实验没有完成。


中考化学实验酸碱溶液与指示剂的作用1.化学反应原理:⑴石蕊和酚酞等酸碱指示剂能与酸溶液或碱溶液作用,生成不同颜色的物质,因此可用这些物质指示酸或碱,称为酸碱指示剂。
其显色情况如下表。
⑵很多植物色素在酸溶液或碱溶液中也显不同的颜色,也可用于作为酸碱指示剂。
2.实验仪器:试管、滴管、研钵、纱布等。
实验药品:石蕊试液、酚酞试液、食醋、石灰水、稀盐酸、稀氢氧化钠溶液、牵牛花、月季花、紫卷心菜、胡萝卜、酒精、蒸馏水等。
3.探究方案:方案一:将8支试管分成两组,每组的4组试管中分别加入少量食醋、石灰水、稀盐酸、稀氢氧化钠溶液。
向其中一组试管中滴入几滴紫色石蕊试液,向另一组试管中滴入几滴无色酚酞试液。
观察现象。
以上实验证明石蕊试液遇酸变红色,遇碱变蓝色;酚酞试液遇酸显无色,遇碱显红色。
方案二:⑴取几种植物的有色花瓣或有色表皮,如牵牛花瓣、月季花瓣、紫卷心菜叶、胡萝卜皮等,放入研钵中捣烂,加适量的酒精溶液(乙醇与水的体积比以1∶1为宜)浸泡十分钟。
⑵用纱布将浸泡出的汁液过滤或挤出,得到指示剂;⑶将自制的指示剂分别滴加到食醋、石灰水、稀盐酸和稀氢氧化钠溶液中,检测指示剂的变色情况。
4.探究评价:本实验的操作很简单,但现象是否明显,在于指示剂的配制。
市售的石蕊试剂中含有较多的红色素杂质,若没有除去就配成溶液,将该试液加入碱性溶液中后,由于红色素的干扰,使颜色偏紫,现象不明显。
酚酞不溶于水,因此,酚酞试液浓度过大,在溶液中易形成白色浑浊,干扰了实验现象的观察。
氢氧化钠溶液浓度过大,滴加酚酞试液后,变红色后会立即变无色,教师在学生面前可能遇到“有理说不清”的尴尬。
所以,氢氧化钠溶液的浓度切不可过高,一般在0.1 mol /L以下为宜。
理论上,有色植物器官的浸出液都可以做酸碱指示剂,但有些植物色素在酸碱溶液中变色不明显。
教师要多取几种植物色素,通过比较有选择性地推荐给学生。
一般来说,在自然条件下颜色较深的植物花瓣、果皮、茎叶表皮等,变色相对比较明显。
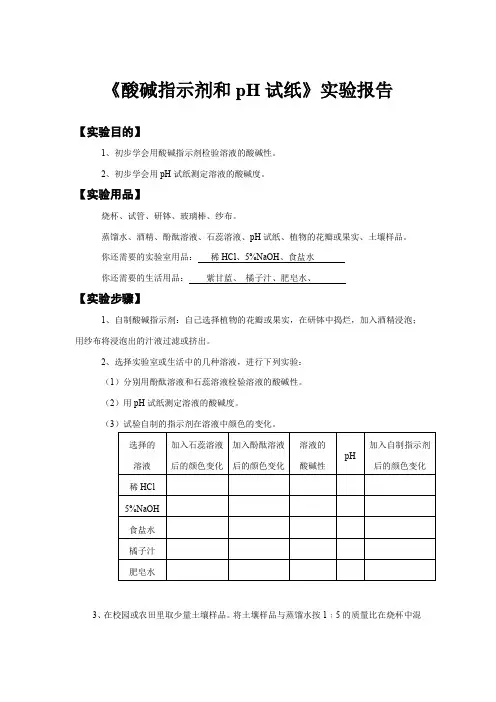
《酸碱指示剂和pH试纸》实验报告
【实验目的】
1、初步学会用酸碱指示剂检验溶液的酸碱性。
2、初步学会用pH试纸测定溶液的酸碱度。
【实验用品】
烧杯、试管、研钵、玻璃棒、纱布。
蒸馏水、酒精、酚酞溶液、石蕊溶液、pH试纸、植物的花瓣或果实、土壤样品。
你还需要的实验室用品:稀HCl、5%NaOH、食盐水
你还需要的生活用品:紫甘蓝、橘子汁、肥皂水、
【实验步骤】
1、自制酸碱指示剂:自己选择植物的花瓣或果实,在研钵中捣烂,加入酒精浸泡;用纱布将浸泡出的汁液过滤或挤出。
2、选择实验室或生活中的几种溶液,进行下列实验:
(1)分别用酚酞溶液和石蕊溶液检验溶液的酸碱性。
(2)用pH试纸测定溶液的酸碱度。
(3)试验自制的指示剂在溶液中颜色的变化。
3、在校园或农田里取少量土壤样品。
将土壤样品与蒸馏水按1﹕5的质量比在烧杯中混
合,充分搅拌后静置。
用pH试纸测澄清液体的酸碱度(测定结果:)。
【问题与交流】
1、你自制的指示剂检验溶液酸碱性的效果如何?了解其他同学自制的指示剂的检验效果,哪种植物的花瓣或果实制成的指示剂检验效果好?
2、归纳自制的知指示剂在酸、碱溶液中的颜色变化情况,与同学交流。

酸碱指示剂与pH值在我们的日常生活和化学实验中,经常会听到“酸碱指示剂”和“pH 值”这两个词。
它们可是化学世界里的重要角色,能够帮助我们了解溶液的酸碱性。
那它们到底是什么,又有着怎样的神奇作用呢?首先,咱们来聊聊酸碱指示剂。
简单来说,酸碱指示剂就是一些能够根据溶液酸碱性的不同而改变颜色的物质。
就好像是溶液的“告密者”,通过颜色的变化告诉我们溶液的酸碱性质。
常见的酸碱指示剂有酚酞、石蕊和甲基橙等。
酚酞溶液在酸性和中性溶液中是无色的,而在碱性溶液中会变成粉红色。
石蕊溶液在酸性溶液中呈现红色,在碱性溶液中呈现蓝色,在中性溶液中则是紫色。
甲基橙在酸性溶液中是红色,在碱性溶液中是黄色。
这些酸碱指示剂为什么能变色呢?这是因为它们的分子结构会随着溶液酸碱度的变化而发生改变。
从而导致它们对光的吸收和反射也发生变化,最终我们看到的就是颜色的不同。
那 pH 值又是什么呢?pH 值是用来表示溶液酸碱度的一个指标。
它的数值范围从 0 到 14。
pH 值小于 7 的溶液是酸性的,数值越小,酸性越强;pH 值等于 7 的溶液是中性的;pH 值大于 7 的溶液是碱性的,数值越大,碱性越强。
想象一下,pH 值就像是一把尺子,能够精确地测量出溶液的酸碱性程度。
比如说,柠檬汁的 pH 值大约在 2 到 3 之间,这表明它是一种酸性较强的溶液。
而肥皂水的 pH 值通常在 9 到 10 左右,说明它是碱性的。
那么,酸碱指示剂和 pH 值之间有什么关系呢?实际上,酸碱指示剂就是我们用来粗略判断溶液 pH 值范围的工具。
通过观察酸碱指示剂的颜色变化,我们可以大致了解溶液的 pH 值是在酸性、中性还是碱性的范围。
但要更准确地知道溶液的 pH 值,我们就需要用到 pH 试纸或者 pH 计。
pH 试纸的使用方法很简单,将一小段试纸浸入溶液中,然后取出与标准比色卡对比,就能读出溶液的 pH 值。
而 pH 计则是一种更加精确的测量仪器,可以直接给出溶液的 pH 值数字。





【初中化学】中考化学酸碱指示剂知识点酸碱指示剂(石蕊试液、无色酚酞)和ph值:
酸溶液的ph值小于7(如盐酸、稀硫酸、硝酸),酸性越强ph值越小,酸性越弱ph值越大。
水、中性的硫酸盐、硝酸盐和盐酸盐溶液不能使指示剂变色,ph值等于7。
不能使指示剂变色;可溶的碱溶液ph值大于7。
碱性越强ph值越大,碱性越弱ph越小
酸碱盐溶解性口诀:
钾钠硝铵溶溶碱有五种钡钾钙钠氨
不水溶性氯化物agcl不水溶性硫酸盐baso4碳酸盐只水溶性钾钠铵
口诀的含义:含有钾、钠、硝酸根、铵根的物质都溶于水
溶水的碱存有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶水
含cl的化合物只有agcl不溶于水,其他都溶于水;
含so42-的化合物只有baso4不溶水,其他都溶水
含co32-的物质只有含k+na+nh4+溶于水,其他都不溶于水
沉淀物中agcl和baso4不溶叶唇柱硝酸,fe(oh)3就是红褐色结晶,cu(oh)2就是蓝色结晶
其他沉淀是白色(包括fe(oh)2)有以下常见的沉淀:
mg(oh)2al(oh)3caco3baco3ag2co3
推测题中,往沉淀物加稀硝酸:若谈结晶不熔化,则结晶中一定存有agcl或baso4;若谈结晶全部熔化,则结晶中一定没agcl或baso4;若谈结晶部分熔化,则结晶中一定存有agcl或baso4中的一种,且除了另一种可以溶叶唇柱硝酸的结晶。
上面的内容是初中化学知识点总汇之酸碱指示剂,相信大家已经掌握酸碱盐溶解性的口诀了吧。
如果想要了解更多更全的
初中化学
知识就来关注吧。
化学九年级下ph试纸知识点在化学学习的过程中,我们经常会接触到酸碱性的概念。
而要准确地判断一个物质的酸碱性,就需要借助于ph试纸。
ph试纸是化学实验中常见的一种工具,它可以通过颜色的变化来检测溶液的酸碱性。
在本文中,我们将介绍化学九年级下ph试纸的相关知识点。
1. ph试纸的原理ph试纸的原理是利用酸碱指示剂的染色变化来检测溶液的酸碱性。
酸碱指示剂是一种可以根据溶液的酸碱程度而改变颜色的物质。
当溶液为酸性时,酸碱指示剂会呈现红色或橙色;当溶液为中性时,酸碱指示剂会呈现绿色;当溶液为碱性时,酸碱指示剂会呈现蓝色或紫色。
通过将ph试纸蘸取到被检测溶液中,根据试纸上显示的颜色变化,就可以判断出溶液的酸碱性。
2. ph试纸的使用方法使用ph试纸非常简单。
首先,取一片ph试纸,并将试纸的一端蘸取到需要测试的溶液中,保持几秒钟使试纸充分吸收溶液,然后取出试纸并观察其颜色变化。
根据试纸上显示的颜色,我们可以参照ph试纸标定表对溶液的酸碱性进行判断。
3. ph试纸的使用范围ph试纸可以广泛应用于许多领域,如农业、环境科学、工业和医学等。
在农业中,ph试纸常被用来测试土壤的酸碱度,以确定适宜的植物种植条件。
在环境科学领域,ph试纸可以检测水体的酸碱度,以评估水质的好坏。
在工业中,ph试纸被用于监测化工过程中溶液的酸碱性变化。
在医学领域,ph试纸常被用来检测尿液和唾液的酸碱性,以辅助医生进行疾病的诊断。
4. ph试纸的注意事项在使用ph试纸时,我们需要注意以下几点。
首先,为了保证测试结果的准确性,我们应该使用干燥、清洁的工具,并避免手指直接接触试纸部分。
其次,在进行测试时,我们需要等待足够的时间,让试纸充分与溶液接触,以确保颜色变化明显。
最后,为了获得更准确的测试结果,我们可以进行多次测试,并取平均值作为最终的判断结果。
总结起来,化学九年级下ph试纸是一种重要的工具,可以帮助我们判断溶液的酸碱性。
通过了解ph试纸的原理和使用方法,以及注意事项,我们能够更准确地进行酸碱性的测试,并在实验和实际应用中应用这一知识。
初中化学教案:酸碱指示剂与pH值一、酸碱指示剂的基本概念及分类酸碱指示剂是化学实验中常用的一种物质,用于检测溶液的pH值。
它们可以根据溶液的酸碱性质发生颜色的变化,从而判断溶液的酸碱性。
酸碱指示剂的种类较多,常见的包括洋红、酚酞、溴酚蓝等。
1. 洋红指示剂洋红是一种酸碱指示剂,它在酸性溶液中呈现红色,在碱性溶液中则呈现蓝色。
因此,它常被用于酸碱滴定实验中,用来判断滴定终点。
2. 酚酞指示剂酚酞是一种酸碱指示剂,它在酸性溶液中呈现无色,在碱性溶液中呈现红色。
由于酚酞的颜色变化范围较窄,通常只用于中性溶液的测定,如酸碱中和反应实验。
3. 溴酚蓝指示剂溴酚蓝是一种通用的酸碱指示剂,它在酸性溶液中呈现黄色,在中性溶液中呈现绿色,而在碱性溶液中呈现蓝色。
因此,溴酚蓝可以用于各种酸碱性质的溶液测定。
二、pH值的概念及测定方法pH值是一种用来表示溶液酸碱性强弱的指标,它是对数形式的指数。
pH值的范围从0到14,其中7表示中性溶液,低于7表示酸性溶液,高于7表示碱性溶液。
pH值的计算公式为:pH = -log[H+],其中[H+]表示溶液中的氢离子浓度。
1. pH试纸法pH试纸法是一种简便的测定溶液pH值的方法。
它使用特殊制成的试纸,将试纸蘸入待测溶液中,根据试纸颜色的变化,通过对照色卡来确定溶液的pH值。
这种方法操作方便、快速,适用于简单的酸碱性测定。
2. pH计法pH计是一种精确测定溶液pH值的仪器。
它通过检测溶液中的氢离子浓度,计算出pH值。
pH计具有高精确度和灵敏度,在科学实验和工业生产中广泛应用。
三、酸碱指示剂与pH值的关系及应用酸碱指示剂的颜色变化与溶液的pH值密切相关,利用这个特性可以实现一些实际应用。
1. 酸碱中和反应酸碱指示剂常被用于酸碱中和反应的判断。
在酸碱滴定实验中,加入少量的酸碱指示剂后,随着滴定剂的滴加,溶液颜色会发生变化。
当溶液达到中和点时,酸碱指示剂的颜色也会相应发生转变,这时可以确定溶液的pH值。
初中化学酸碱中性溶液的判断与计算方法详解化学是一门研究物质及其性质变化的科学,而酸碱性溶液是其中一个重要的研究对象。
在化学课程中,我们需要学习如何准确地判断和计算酸碱中性溶液的性质。
本文将详细介绍酸碱中性溶液的判断与计算方法,帮助读者更好地理解和掌握这方面的知识。
一、酸碱中性溶液的判断酸碱中性溶液的判断主要依靠一些特征性质进行。
下面介绍几种常见的判断方法。
1. 酸碱指示剂法:酸碱指示剂是一种能够根据溶液的酸碱性质而改变颜色的物质。
常见的酸碱指示剂有苏丹红、甲基橙、溴酚蓝等。
我们可以将少量溶液滴在白色滤纸上,再加入少量酸碱指示剂,观察颜色的变化来判断溶液的酸碱中性。
2. pH试纸法:pH试纸是一种能够通过改变颜色来显示溶液酸碱性质的试纸。
在实验中,我们将试纸浸泡在待测溶液中,然后根据试纸的颜色变化来判断溶液的酸碱性。
比如,蓝色试纸变红表示溶液为酸性,红色试纸变蓝表示溶液为碱性,绿色试纸表示溶液为中性。
3. 金属反应法:某些金属与酸或碱反应时会产生明显的气体释放或气泡形成。
通过观察气泡的数量和颜色变化可以判断溶液的酸碱性质。
例如,与酸反应产生气泡的溶液为酸性。
以上是几种常见的酸碱中性溶液的判断方法,通过这些方法可以很好地判断溶液的性质。
二、酸碱中性溶液的计算方法在化学中,我们常常需要计算酸碱中性溶液的浓度、pH值等。
下面介绍几种常用的计算方法。
1. 酸碱溶液的浓度计算:酸碱溶液的浓度可以通过C1V1=C2V2来计算,其中C1和V1分别是酸碱溶液的浓度和体积,C2和V2分别是稀释后酸碱溶液的浓度和体积。
2. pH值的计算:pH值是反映溶液酸碱性的指标,其计算公式为pH=-log[H+],其中[H+]是溶液中氢离子的浓度。
如果已知溶液的[H+]浓度,可直接带入公式计算pH值。
3. 酸碱滴定计算:在酸碱滴定实验中,我们通常使用酸碱滴定计算来确定溶液的浓度。
滴定计算方法根据滴定反应的化学方程和滴定剂的浓度,计算待测溶液的浓度。
化学初中溶液的酸碱性教案教学目标:1. 了解溶液的酸碱性的概念,能够使用酸碱指示剂和pH试纸测定溶液的酸碱性。
2. 理解酸碱性对生命活动及农作物生长的重要性及其影响。
3. 掌握溶液酸碱性的测定方法,能够应用于生产和生活中解决实际问题。
教学重点:溶液的酸碱性的概念,酸碱指示剂和pH试纸的使用方法。
教学难点:溶液的酸碱性与酸碱度的区别及联系。
教学方法:实验探究法,讲授法,小组讨论法。
教学准备:实验器材及药品,多媒体器材,网络及课件。
教学过程:一、导入(5分钟)1. 通过生活中的实例,如胃酸过多、土壤酸化等,引发学生对溶液酸碱性的兴趣。
2. 提出问题:“如何判断溶液的酸碱性?”引导学生思考和讨论。
二、知识讲解(15分钟)1. 讲解溶液的酸碱性的概念,介绍酸碱指示剂的作用和原理。
2. 讲解pH的概念,介绍pH试纸的使用方法和注意事项。
3. 强调酸碱性对生命活动及农作物生长的重要性及其影响。
三、实验探究(15分钟)1. 分组进行实验,每组配备不同的溶液(如食醋、氢氧化钠溶液等)和酸碱指示剂(如石蕊试液、酚酞试液等)。
2. 让学生通过实验观察和记录溶液的酸碱性,尝试使用酸碱指示剂进行判断。
3. 让学生使用pH试纸对溶液的酸碱度进行测定,并记录结果。
四、总结与讨论(10分钟)1. 让学生汇报实验结果,引导学生总结溶液的酸碱性的测定方法和注意事项。
2. 讨论酸碱性对生命活动及农作物生长的重要性及其影响。
3. 引导学生思考如何应用溶液的酸碱性知识解决生活中的实际问题。
五、作业布置(5分钟)1. 让学生完成实验报告,记录实验过程和结果。
2. 让学生查找资料,了解酸碱性在生产和生活中的应用,提高环保意识。
教学反思:本节课通过实验探究和小组讨论的方式,让学生掌握了溶液的酸碱性的概念和测定方法,培养了学生的实验操作能力和团队合作能力。
同时,通过生活中的实例和讨论,使学生认识到酸碱性对生命活动及农作物生长的重要性及其影响,提高了学生的环保意识。
酸碱指示剂与pH值酸碱指示剂是一种广泛应用于酸碱滴定和学术实验中的化学试剂,可以通过颜色的变化来指示溶液的pH值。
pH值是指溶液中所含氢离子(H+)浓度的负对数值,用于表示溶液的酸碱程度。
酸碱指示剂能够识别酸、碱和中性溶液,并根据不同溶液的pH值呈现出不同的颜色。
本文将介绍酸碱指示剂的工作原理和常用的酸碱指示剂种类,以及它们与pH值之间的关系。
一、酸碱指示剂的工作原理酸碱指示剂的工作原理基于指示剂分子在酸碱溶液中的不同电离状态下对光的吸收和释放。
当指示剂分子处于酸性环境下时,会处于酸性形态,能够吸收一定波长的光,从而呈现出特定的颜色。
而当指示剂分子处于碱性环境下时,则处于碱性形态,能够吸收不同波长的光,呈现出不同的颜色。
指示剂的颜色变化是由于溶液酸性或碱性改变所引起的。
当溶液的pH值发生改变时,指示剂分子的酸碱性质也会发生相应的变化,从而导致颜色的变化。
这种颜色变化通常是由于指示剂分子吸收不同波长的光而引起的。
二、常用的酸碱指示剂种类1. 酚酞:酚酞是一种常见的酸碱指示剂,它可以将溶液颜色从无色转变为粉红色。
在酸性溶液中,酚酞呈现出无色状态,而在碱性溶液中,它会呈现出粉红色。
酚酞的pH范围适用于酸性溶液,一般在pH 值为0-7之间。
2. 酚酞蓝:酚酞蓝是一种较常用的酸碱指示剂,它可以将溶液颜色从红色转变为蓝色。
在酸性溶液中,酚酞蓝呈现出红色状态,而在碱性溶液中,它会呈现出蓝色。
酚酞蓝的pH范围适用于中性溶液,一般在pH值为6-8之间。
3. 甲基橙:甲基橙是一种常见的酸碱指示剂,它可以将溶液颜色从黄色转变为红色。
在酸性溶液中,甲基橙呈现出黄色状态,而在碱性溶液中,它会呈现出红色。
甲基橙的pH范围适用于酸性溶液,一般在pH值为3.1-4.4之间。
三、酸碱指示剂与pH值的关系酸碱指示剂的颜色变化与溶液的pH值之间存在一定的对应关系。
根据酸碱指示剂的工作原理,当溶液的pH值与指示剂的颜色变化范围相符时,酸碱指示剂就会显示出相应的颜色。
初中化学知识点归纳酸碱中的指示剂和pH值初中化学知识点归纳:酸碱中的指示剂和pH值在学习化学的过程中,我们会接触到很多有关酸碱的知识,其中指示剂和pH值是酸碱性质中的重要部分。
本篇文章将对酸碱中的指示剂以及pH值进行归纳和总结,希望能够为初中化学学习提供帮助。
一、指示剂指示剂是一种能够根据反应溶液的酸碱性质而发生颜色变化的物质。
通过观察指示剂的颜色变化,我们可以判断溶液的酸碱性质是否发生了改变。
常见的指示剂有几种,下面将分别进行介绍。
1.酚酞指示剂酚酞指示剂呈现无色的酚酞酸形式(pH < 8),而在碱性溶液中则会变成粉红色的酚酞碱形式(pH > 10)。
因此,通过观察酚酞指示剂的颜色变化,我们可以判断出溶液是否为酸性或碱性。
2.甲基橙指示剂甲基橙指示剂在弱酸性溶液中呈橙黄色,在中性和碱性溶液中呈红色。
因此,通过观察甲基橙指示剂的颜色变化,我们可以判断出溶液是否为酸性、中性或碱性。
3.溴酚蓝指示剂溴酚蓝指示剂在酸性溶液中呈黄色,在中性溶液中呈绿色,在碱性溶液中呈蓝色。
通过观察溴酚蓝指示剂的颜色变化,我们可以判断出溶液的酸碱性质。
二、pH值pH值是用以表示溶液酸碱性质的指标,其数值范围从0到14。
在数值上,pH值越小,代表溶液越酸性;而pH值越大,代表溶液越碱性;pH值等于7代表溶液为中性。
在实际应用中,我们可以通过酸碱指示剂的颜色变化来判断溶液的酸碱性质,但是这并不能提供准确的数值。
而通过测量溶液的pH值,我们可以得到更加精确的判断结果。
三、酸碱中的指示剂与pH值的应用指示剂和pH值常常被用于以下领域:1.化学实验在化学实验中,我们常常需要测试溶液的酸碱性质。
使用指示剂可以通过观察颜色变化来快速判断溶液的酸碱性质。
而测量pH值则可以提供对溶液酸碱性质更加准确的判断。
2.医学领域在医学领域中,pH值的测量广泛应用于体液检测以及药物研发等方面。
通过测量体液的pH值,可以判断出机体内部的酸碱平衡状态,为疾病的诊断和治疗提供重要参考。