消除反应的机理一般为E1和E2E2反应机理SN2反应机理=进攻共108页
- 格式:ppt
- 大小:6.12 MB
- 文档页数:108

![消除反应[知识荟萃]](https://uimg.taocdn.com/6b722b9a6137ee06eff918dc.webp)

*第六章 消除反应消除反应(Elimination)指从有机分子中除去两个原子或基团(XY ),生成双键、三键或环状结构的反应。
++XAYA X Y根据消去的原子或基团(X ,Y )相对位置的不同,消除反应可分为下面三类。
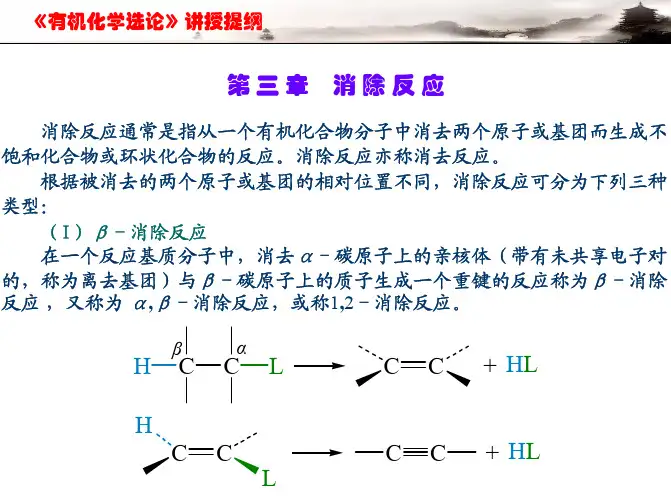
(一)α-消除(1,1-消除)被消去的两个基团(X ,Y )连在同一原子上,此种反应称α-消除。
+碳烯(卡宾Carbene )(X , Y)R 2CXYR 2C+氮烯(氮宾 Nitrene )(X , Y)RNXYRN例如,氯仿在强碱液中消去质子和氯负离子生成二氯卡宾(二氯碳烯):+++CHCl 3OHCCl 2ClH 2ON-对-硝基苯磺酰氧胺基甲酸乙酯(Ⅰ)在乙醇钠液中,消去质子和对-硝基苯磺酸根负离子,生成乙氧甲酰氮烯(Ⅱ):(Ⅰ)++NO 2OSO 2NHCOC 2H 5O C 2H 5O 2NOSO 2+C 2H 5OHN COC 2H 5O (Ⅱ)碳烯、氮烯均为不稳定的中间体,立即产生重排、二聚、加成等反应。
如氯仿在醇钠中生成的二氯卡宾,继续与乙醇作用得到原甲酸三乙酯(抗疟药氯喹原料): CH (OC 2H 5)3(二)β-消除(1,2-消除)消去的两个基团(X ,Y )连在相邻的两个原子上,反应后形成新的不饱和键如烯键、炔键或偶氮键等。
R 2CYXYCR 2R 2C+CR 2XX RCCR 2YXYCR RC +XY NRRN+RNXNYR反应中带着孤电子对离开的基团Y 称为离去基团,与Y 相连的碳原子称为α碳原子,与另一离去基团X (通常为氢)相连的碳原子称为β碳原子。
故在相邻原子上发生的消除反应称为β-消除反应。
β-消除是最重要最普遍的消除反应,常应用于药物合成。
例如五氯乙烷消去氯化氢,生成驱虫药四氯乙烯:CHCl 2CCl 2CCl 3CCl 222,3-二溴丁二酸消去两分子溴化氢,得到解毒药二巯琥钠的中间体丁炔二酸钠:BrHC BrHC NaOHC COONa CCOONa COOH COOH2-氯-9-(3-二甲氨基丙基)-9-羟基噻吨(Thiaxanthene )在硫酸催化下脱水制取神经官能症治疗药泰尔登:SCH 2CH 2CH 2N(CH 3)2HO SCHCH 2CH 2N(CH 3)2ClCl2466α-苯基丁酰胺脱水生成α-苯基丁腈,为全盛催眠药苯乙哌啶酮的中间体。

8.5 消除反应的机理9两种消除机理(E1和E2)9影响消除反应机理及其活性的因素9消除反应的方向9E2反应的立体化学9取代反应和消除反应的竞争单分子消除机理The E1 Mechanism第一步生成碳正离子,其速度慢,是决定整个反应速度的一步。
因为这一步反应中只有一种分子发生共价键的断裂,所以此反应历程称为单分子消除反应,以E1表示个E1的反应速度仅取决于卤烷的浓度,而与其它试剂(例如氢氧根负离子)的浓度无关。
H CH3H CH3•失去β-质子(被碱所接收)而生成烯烃。
E1 反应势能变化图•注意:E1反应的第一步和S N1的相同双分子消除机理The E2 Mechanism反应主要按双分子历程进行,反应不分阶段,新键的生成和旧键的断裂同时发生(协同进行)。
反应速度与反应物浓度及进攻试剂的浓度成正比,说明反应是按双分子历程进行,因此叫做双分子消除反应,以E2表示。
实验现象•(1)卤代烃脱卤代氢为二级动力学反应。
rate = k[卤代烃][碱]•(2) 消除反应的速度取决于C—X 的键能C—X 键越弱; 反应速度越快顺序: RI > RBr> RCl> RF碱试剂的影响9只有E2反应与试剂的碱性强弱、浓度有关,高浓度的强碱试剂可提高E2反应的速度。
9E1反应不受试剂的碱性和浓度的直接影响。
在E2反应中,过渡态已有部分双键的性质;烯烃的稳定性反映在过渡态的能量上,生成烯烃的稳定性大,则其过渡态的能量也低,反应所需的活化能小,反应速度快,在产物中所占的比例也多。
消除反应的立体化学(重点)在E2反应中,C-L和C-H 键逐渐断裂,π键逐渐形成,如果两个被消除的基团(L,H)和与它们相连的二个碳原子处于共平面关系(即L-C-C-H在同一平面上),在形成过渡态时,二个变形的SP3杂化轨道可以尽多地交盖(形成部分π键)而降低能量,有利于消除反应的进行。
E2 反应的立体化学反式消除与顺式消除反式共平面顺式共平面取代反应和消除反应的竞争(以自修为主)Substitution And EliminationAs Competing Reactions。





双分子消除反应双分子消除反应(又名E2反应,E代表Elimination,而2代表反应速率受到二个化合物浓度的影响),为消除反应的一项反应机构,由于反应为一步形成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应,故又称为“双分子消除反应”。
历史双分子消除反应为1920年代,克里斯托夫·英果尔德(Christopher Kelk Ingold)与罗伯特·鲁宾逊((Robert Robinson)展开了一连串有机化学的研究,提出了许多现代有机化学里的观念,像是亲核性、亲电性、S N1反应、S N2反应、E1反应、E2反应等等都是在他们研究后先后提出来的崭新概念,这些概念的提出对揭示有机反应内在机理从而实现控制有机反应起到了巨大的促进作用,而E2反应,就是他们提出越来解释消除反应的其中一项反应机构。
反应机构•上图乙醇作为碱攻击β-氢。
溴带着共用电子对在离去基作用下离去,而氢以质子的方式离去。
如同S N2反应,反应由一步完成,但不同的是由碱来拉走质子,而并不是当作亲核试剂,碱进攻β-氢,并与离去基同时离去,生成烯烃。
而由于反应为一步完成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应。
特性而因为E2反应不需侵入重围,攻击之中的碳原子,只需从旁拉走一个质子,因此立体阻碍在此并不如S N2反应般发生影响,因此在一、二、三级受质皆可发生反应,而因为E2反应不会产生碳阳离子,故不会发生重排现象。
E2反应为一步反应,因此碱的强弱对其反应速率有很显著的影响,越强的碱能使反应进行越快,而对于离去基来说,E2反应需要好的离去基方能进行反应,但离去基的影响相较于E1反应并没有如此敏感,但是离去基越强,皆能增加E1及E2的反应速率。
双分子消除反应与单分子消除反应和单分子亲核取代反应互为竞争反应。
但由于E1反应较难发生,所有条件都必须恰到好处,(三级受质、弱碱、极好的离去基),如果三个条件有一样稍微不同,反应都较倾向于遵循E2反应机构。

消除反应的两种反应历程一、单分子消除反应E11.本质第一步:R-CH2-CH2X →R-CH2-C+H2+X-离去基主动脱离生成碳阳离子第二步:R—CH2—C+H2→ R—CH=CH2 + H+β氢变成氢离子同时产生碳碳双键2.特征:①E1历程反应速率只正比于反应物浓度,与催化剂路易斯碱浓度无关。
②由于反应中生成碳正离子,有时有可能发生重排生成更为稳定的3°碳正离子,形成相应的不饱和产物.3。
反应速率:由于两步反应中第一步反应比较慢,而第二步反应比较快,所以整体的反应速率几乎只与第一步反应的反应速率有关,而第一步反应的反应速率由碳正离子稳定性决定,碳正离子越稳定,反应速率越快,故其反应速率顺序为:苄基〉烯丙基> 叔碳〉仲碳〉伯碳(β碳上带有推电子基团(如烃基、氨基、羟基等)有利反应的进行)二、双分子消除反应1.综述:又名E2反应,E代表Elimination,而2代表反应速率受到二个化合物浓度的影响。
为消除反应的一项反应机构,由于反应为一步形成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应,故又称为“双分子消除反应"。
2.本质:如同S N2反应,反应由一步完成,但不同的是由碱来拉走质子,而并不是当作亲核试剂,碱进攻β-氢,并与离去基同时离去,生成烯烃.而由于反应为一步完成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应。
3.特征:①因为E2反应不需侵入重围,攻击之中的碳原子,只需从旁拉走一个质子,因此立体阻碍在此并不如SN2反应般发生影响,因此在一、二、三级受质皆可发生反应。
②因为E2反应不会产生碳阳离子,故不会发生重排现象.E2反应为一步反应,因此碱的强弱对其反应速率有很显著的影响,越强的碱能使反应进行越快,而对于离去基来说,E2反应需要好的离去基方能进行反应,但离去基的影响相较于E1反应并没有如此敏感,但是离去基越强,皆能增加E1及E2的反应速率。
•上图乙醇作为碱攻击β—氢.溴带着共用电子对在离去基作用下离去,而氢以质子的方式离去。
8.5 消除反应的机理9两种消除机理(E1和E2)9影响消除反应机理及其活性的因素9消除反应的方向9E2反应的立体化学9取代反应和消除反应的竞争单分子消除机理The E1 Mechanism第一步生成碳正离子,其速度慢,是决定整个反应速度的一步。
因为这一步反应中只有一种分子发生共价键的断裂,所以此反应历程称为单分子消除反应,以E1表示个E1的反应速度仅取决于卤烷的浓度,而与其它试剂(例如氢氧根负离子)的浓度无关。
H CH3H CH3•失去β-质子(被碱所接收)而生成烯烃。
E1 反应势能变化图•注意:E1反应的第一步和S N1的相同双分子消除机理The E2 Mechanism反应主要按双分子历程进行,反应不分阶段,新键的生成和旧键的断裂同时发生(协同进行)。
反应速度与反应物浓度及进攻试剂的浓度成正比,说明反应是按双分子历程进行,因此叫做双分子消除反应,以E2表示。
实验现象•(1)卤代烃脱卤代氢为二级动力学反应。
rate = k[卤代烃][碱]•(2) 消除反应的速度取决于C—X 的键能C—X 键越弱; 反应速度越快顺序: RI > RBr> RCl> RF碱试剂的影响9只有E2反应与试剂的碱性强弱、浓度有关,高浓度的强碱试剂可提高E2反应的速度。
9E1反应不受试剂的碱性和浓度的直接影响。
在E2反应中,过渡态已有部分双键的性质;烯烃的稳定性反映在过渡态的能量上,生成烯烃的稳定性大,则其过渡态的能量也低,反应所需的活化能小,反应速度快,在产物中所占的比例也多。
消除反应的立体化学(重点)在E2反应中,C-L和C-H 键逐渐断裂,π键逐渐形成,如果两个被消除的基团(L,H)和与它们相连的二个碳原子处于共平面关系(即L-C-C-H在同一平面上),在形成过渡态时,二个变形的SP3杂化轨道可以尽多地交盖(形成部分π键)而降低能量,有利于消除反应的进行。
E2 反应的立体化学反式消除与顺式消除反式共平面顺式共平面取代反应和消除反应的竞争(以自修为主)Substitution And EliminationAs Competing Reactions。
教学目标:掌握卤代烷的消除反应机理、立体化学、反应取向及影响因素。
教学重点:消除反应机理,反应取向——Saytzeff 规则。
教学安排:H,H5—>H6;40min3,H4卤代烷不仅能发生S N反应,还可以发生消除反应。
卤代烷分子中消去卤化氢生成烯烃常称为消除反应(Elimination)用E 表示。
由于卤代烷中C-X 键有极性,卤素的诱导作用可通过α 碳传递到β 碳上,致使β-H 原子有一定的“酸性”;在碱的作用下卤代烷易于消去β-H 和卤原子,称为β-消除;这种消除反应是烯烃的一种制备方法。
如:与卤代烷的S N反应相似,卤代烷在发生消除反应时,也有双分子和单分子消除机理,分别记为E2 和E1。
一.双分子消除反应(E2)1.E2反应机理在卤代烷的双分子消除反应机理中,反应是一步完成的,其反应速率与反应物和亲核试剂的浓度成正比,故称为双分子消除反应机理。
记为E2。
反应的动力学方程为:在反应过程中,碱对卤代烷的β-H 进攻,同时C-X 键开始发生异裂,在达到过渡态时,Cβ-H 键和Cα-H 键都达到了高度的异裂活化状态,此时Cβ-Cα之间已有了部分双键的性质,这两个而原子已有部分sp2杂化的特性。
这时反应体系处于最高能量水平,随着反应的时行,β-H 完全成碱结合,卤负离子彻底离去,最终生成了烯烃。
2.立体化学实验表明,在按E2 机理进行的消除反应中,一般发生反式消除即卤原子与β-H 在σ 键的两侧(异侧)被消除。
β-H 与X 处于反式共平面能量低:观看动画例:二.单分子消除反应(E1)E1 反应与S N1 反应有相似的机理,反应也是分两步进行。
首先卤代烷在碱性水溶液中解离为碳正离子,随后OH-若进攻碳正离子的中心碳原子,则生成取代产物;若进攻β- 氢原子则发生消除反应生成烯烃。
两者也是相伴而生。
E1 消除反应的机理可表示如下(以叔丁基卤为例):第一步是慢步骤,第二步是快的,即反应速度取决于卤代烷的浓度,反应的动力学方程为:υ=k[RX],故这种反应机理称为单分子消除反应机理。
有机合成中的β-消除反应有机合成中的β-消除反应摘要:本文阐述了消除反应的类型和各类型反应的机理和历程,并讨论了其影响因素。
关键字:β—消除、立体选择、过渡态、碳正离子消除反应是从一个分子中消除两个原子或基团而不被其它原子或基团所置换的反应。
它可以分为三类,若消去的2个原子连在同一个碳原子上,则称为α—消除反应,若2个消去的原子连在相邻的2个碳原子上,则称为β—消除反应,若2个消去的原子连在1,3位碳原子上,则称为γ—消除反应,其中β—消除反应最为重要。
其实质是从相邻的两个原子上消除两个原子或基团,形成一个新的双键或叁键。
β—消除反应包括的反应多,而该类反应涉及的反应条件、反应产物都比较复杂,且消除反应和取代反应常常相伴而行,反应历程也时有变化,因而比较复杂[1]。
但其在实际中有广泛的应用,如卤代烃的消除反应、磺酸酯的消除反应、季铵碱的消除反应[2].接下来本文将对β—消去反应的反应历程和影响因素作简要介绍。
1反应历程分类β—消去反应的历程有三种,即:单分子消除反应机理(E1)、双分子消除反应机理(E2)和碳负离子反应机理(E1cb)[4]。
1.1E1机理单分子消除为2步过程,第一步是离去基团带着一对电子离去,底物成为碳正离子;第二步是碳正离子从β位脱去一个质子,给予碱或溶剂,生成烯键,第一步速率较慢,是决定反应速率的步骤,E1机理中C—X键断裂在前,C(β)一H 键断裂在后,故常伴随碳正离子重排。
单分子消除反应的动力学特征是:速率=K[RX]影响反应快慢的因素有:第二步中生成碳正离子的稳定性,介质是否容易电离和是否易于使离子溶剂化,不同结构的卤代烷烃反应活性难易为1。
RX<2。
RX<3。
RX。
消除反应按E1历程进行时,中间体正碳离子的稳定性决定反应速度,产物的生成发生在第2步,产物的稳定性是决定消除反应择向的主要因素。
在E1反应里,不论作用物性质如何,总是形成双键碳上带有最多烷基的烯烃主产物;所以消除反应按E1历程进行时一般服从规则,但Saytzaff消除反应产物由于空间作用变得不稳定时,消除反应将遵Hoffmann规则1.2E2机理1.2.1双分子消除反应为一步反应,当碱进攻β—H时,β—C—H 和α—C—H 同时均等协同地断裂,在过渡状态中5个原子团在同一个平面上,随后在α—碳和β—碳上生成π键。