(完整word版)南京工业大学2010-2011年分析化学试卷1.doc
- 格式:doc
- 大小:234.02 KB
- 文档页数:4

南京工业大学 有机化学 试题 (B )卷试题标准答案2010--2011 学年第一学期 使用班级一、命名或写出下列化合物的结构式(本大题共10小题,每小题1。
5分,共15分)CH 3CCHCH 2CH 3CH 3CH 3CH 31.2. (Z)-3-甲基-4-异丙基-3-庚烯3. 反-1,3-二甲基环己烷4. 2,6-二甲基双环[3.1.1]庚烷5. 3-氯环己烯6. 3-丁烯-1-醇7.R-2-氯丙酸8.α-D-葡萄糖CH 2CH 2C CN BrO9.10. 3-溴噻吩二、单项选择题(本大题共20小题,每小题1。
5分,共30分)在每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号三、用化学方法鉴别下列各组化合物(本大题共3小题,每小题3分,共9分) 苯酚环己醇环戊酮++1.2.乙二胺二乙胺三乙胺+3.甲酸乙酸乙二酸+四.完成下列反应(本大题共20个空,每空1分,共20分)1.CH 2ClCH 2CCHCH 2COCH 3CH 2COCH 3BrBr2.CH 3CH OHCH CH 3OH 3.BrMgBrCH 2CH 2OHCH 2CH 2OHBrBrCH 2CH 2CN4.NO 2CH 3CH 32CH 3CH 3NHAcBrCH 3Br NH 2CH 3BrCH 3CH 3NH 2COOHCOClCONH 26.CH 2OHHCOONa7.5.N CH 3CH 3+I-CH 2(H 3C)2NCH 2CH 2N(CH 3)38.CH 2OHCH 2OOCCH 39.N N SO 3HNH 2五、简答题(本大题共两小题,每题4分,共8分)1.(a ) (b )CH 3CH 332.由于伯卤烃首先形成碳正离子过度态,而伯碳正离子是很不稳定的,所以很快会重排为较稳定的仲碳正离子,所以很难形成题中的产物。
可以先用丙酰氯与苯发生酰基化,然后再利用克莱门森还原,即可得到较为理想的产品。

南京工业大学 无机与分析化学 试卷(下、下、A)A)(一页开卷一页开卷))2012—2013学年第二学期学年第二学期 使用班级使用班级 :全校相关专业:全校相关专业学院学院 专业专业 学号学号 姓名姓名题号题号 一 二 三 四 五 六 七 总分总分 得分得分一 、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)将答案填入答题表中)题号题号12 3 4 5 6 7 8 9 10 答案答案 题号题号 11 12 13 14 15 16 17 18 19 20 答案答案1. 取同浓度的Zn 2+-EDTA 配合物的溶液两份,分别用A :用NaOH 溶液控制pH=10.0,其条件稳定常数记作K'ZnY ZnY,A ,A ,B :用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY ZnY,B ,B ,。
正确的关系式是:正确的关系式是:2. 佛尔哈德法测定Cl -时,使用的指示剂是:时,使用的指示剂是:(A) Ag 2CrO 4 (B) 二氯荧光黄二氯荧光黄 (C) 甲基橙 (D) FeNH 4(SO 4)2 3. 在下列物质中,不能将KI 氧化成I 2的是:的是: (A) KIO 3 (B) FeNH 4(SO 4)2 (C) Fe(NH 4)2(SO 4)2 (D) CuSO 44. 下列说法正确的是:下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大非构晶离子的盐浓度越大,沉淀溶解度越大 (B) 非构晶离子的盐浓度越大,沉淀溶解度越小非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小两种沉淀的溶度积相比,溶度积小的溶解度也小 (D) 不同种类沉淀的溶解度越大,溶度积也越大不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo (V) H 2PO 2-____-2.25V ____P 4_______________PH 3 |_____________-1.23V -1.23V____________| 可计算电对P 4/ PH 3的标准电极电位φo P4/PH3为:为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V 6. 在配离子[Co(C 2O 4)2(en)]-中(en 为H 2N-CH 2-CH 2-NH 2),中心离子Co 3+的配位数是:的配位数是:(A) 3 (B) 4 (C) 5 (D) 6 7. 用Na 2C 2O 4标定KMnO 4,加入第一滴KMnO 4时,KMnO 4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO 4很快退色,最有效的措施是:很快退色,最有效的措施是:(A) 加大H 2C 2O 4浓度浓度(B) 加大酸度加大酸度 (C) 事先加入Mn 2+ (D) 加快滴KMnO 4的速度的速度opH lgαY(H)pH lgαY(H)pH lgαY(H)0.0 23.64 5.0 6.45 10.0 0.45 1.0 18.01 6.0 4.65 11.0 0.07 2.0 13.51 7.0 3.32 12.0 0.01 3.0 10.60 8.0 2.27 4.0 8.44 9.0 1.28 17. 碘量法中所用的指示剂为:碘量法中所用的指示剂为: (A) 淀粉溶液淀粉溶液 (B) 二甲酚橙二甲酚橙 (C) 亚甲基蓝亚甲基蓝 (D) 二苯胺磺酸钠二苯胺磺酸钠18. 晶形沉淀陈化的主要目的是:晶形沉淀陈化的主要目的是:(A) 增大沉淀的溶解度增大沉淀的溶解度 (B) 小颗粒长大,使沉淀更纯净小颗粒长大,使沉淀更纯净 (C) 避免后沉淀现象避免后沉淀现象 (D) 形成非晶型沉淀形成非晶型沉淀19. 当含有Mg 2+、Na +、Ag +、Al 3+离子混合液流过阳离子交换树脂时,最先流出和最后流出的离子分别是:的离子分别是:(A) Na +,Mg 2+(B) Ag +,Al 3+(C) Na +,Al 3+(D) Mg 2+,Ag +20. 已知M 与EDTA(Y)的lg K MY = 13.2,在pH = 5.0的HAc-NaAc 缓冲溶液中,αY(H) =106.45;αM(L) =102.4;αM(OH) =100.4;则在此条件下,lgK’MY 为:为: (A) 6.75 (B) 4.35 (C) 3.95 (D) 2.95 二、填空和简单计算(每题2分) 1. 称取0.3581g 的ZnO(M = 81.38)定容250.00mL ,吸取该溶液20.00mL ,用EDTA 溶液滴定。

南京工业大学《无机与分析化学》测试题答案南京工业大学《无机与分析化学》测试题答案一.单选题(共4题,40.0分)1下列说法正确的是:A、溶解度小的沉淀总是向溶解度大的沉淀转化B、盐效应使沉淀的溶解度减小C、酸效应使沉淀的溶解度增大D、加水稀释后仍含有AgCl(s)的溶液来说,稀释前后的溶解度和溶度积均不变正确答案:D 我的答案:D2进行重量法分析,下列说法正确的是:A、称量形式和沉淀形式应一致B、对溶度性大的沉淀可用大量水洗涤对非晶型沉淀可用冷水洗涤D、对非晶型沉淀可用热溶液洗涤正确答案:D 我的答案:A3pH=3.5时用莫尔法测定Cl-含量,则测定结果A、偏高B、偏低C、无影响D、不确定正确答案:A 我的答案:A4下列条件中适于采用佛尔哈德法的是:A、滴定酸度在中性或弱酸性条件B、以荧光黄为指示剂滴定酸度为0.1~1.0mol·L-1D、以K2CrO4为指示剂正确答案:C 我的答案:C二.简答题(共3题,30.0分)1pH= 4时用莫尔法滴定Cl-,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏高。
pH≈4时,CrO42-酸效应较大,溶液中CrO42-浓度减小,指示终点的AgCrO4沉淀出现过迟。
我的答案:偏高,酸性增强使铬酸根转化为重铬酸根,铬酸银难溶,重铬酸银溶解度较大,所以此时铬酸银沉淀将出现延迟,故偏高2若试液中含有铵盐,在pH≈10时,用莫尔法滴定Cl-,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏高。
在pH≈10时,溶液中NH3型体的浓度较高,形成Ag-NH3络合物,需加入过量的Ag+才能出现终点,故结果偏高。
我的答案:偏高,因为银和铵盐会作用行成络合物3用佛尔哈德法测定Cl-时,未将沉淀过滤也未加硝基苯,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏低。
因为用佛尔哈德法测定Cl-时,若未将沉淀过滤也未加硝基苯,那么AgCl沉淀将发生转化,成为AgSCN,消耗过多滴定剂SCN-,由于是返滴定,故结果偏低。

南京工业大学无机分析化学题库试题1第二学期模拟试卷一、选择题1. 配合物[Cu(NH3)4]SO4的导电性和加入Ba2+后的现象是:(A) 导电、有沉淀(B) 导电、无沉淀(C) 不导电、有沉淀(D) 不导电、无沉淀2. 当0.01mol氯化铬(III)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol 氯化银沉淀析出,此样品的分子式应表示为:(A) [Cr(H2O)6]Cl3 (B) [CrCl(H2O)5]Cl2 (C) [CrCl2(H2O)4]Cl (D)[CrCl3(H2O)3]3. 根据晶体场理论,形成高自旋配合物的理论判据是:(A) 晶体场分裂能>电子成对能(B) 电离能>电子成对能(C) 晶体场分裂能>成键能(D) 电子成对能>晶体场分裂能4. 有关EDTA酸效应的叙述中,正确的是:(A) pH越大,αY(H)越大(B) pH越大,αY(H)越小(C) pH值愈大,酸效应系数愈大(D) 酸度越大,酸效应系数愈小5. 关于EDTA滴定法滴定突跃的说法不正确的是(忽略金属离子的水解):(A) pH越大,突跃范围越小(B) KMY越大,突跃范围越大(C) M或Y浓度约达,突跃范围越大(D) pH越大,突跃范围越大6. 在化学反应Mn(NO3)2 + PbO2 + HNO3→HMnO4 + Pb(NO3)2中,还原剂是:(A) Pb(NO3)2 (B) PbO2 (C) Mn(NO3)2 (D) HMnO47. 原电池(-)Zn│Zn2+(mo l?L-1 )‖Ag+(mo l?L-1 )│Ag(+),已知:φoAg+/Ag=0.80V,φoZn2+/Zn=-0.76V,在298.15 K 时,该电池的反应平衡常数lgKθ为:(A) 26.4 (B) 52.9 (C) 63.3 (D) 79.8. Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O;能斯特方程表达式是:(A) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059lg [Cr2O72-](B) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+](C) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+]2(D) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/6 lg [Cr2O72-]/[ Cr3+]29. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 加快滴KMnO4的速度(D) 加热10. φo Cr2O72-/ Cr3+ = 1.33V,φoFe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+]=1mol·L-1)滴淀突跃范围为:(A) 0.86~1.15V (B) 0.86~1.33V (C) 0.68~1.33V (D) 0.68~1.14V11. 可以用作标定Na2S2O3标准溶液的基准物质是:(A) KBrO3 (B) K2S2O8 (C) ZnO (D) 无水Na2CO312. 下列测定中需要加热的有:(A) KMnO4溶液测定H2O2 (B) KMnO4法测定MnO2(C) 碘量法测定Na2S (D) 溴量法测定苯酚13. 晶形沉淀陈化的目的是:(A) 增大沉淀的溶解度(B) 小颗粒长大,使沉淀更纯净(C) 避免后沉淀现象(D) 形成非晶型沉淀14. BaSO4在稀硫酸、氯化钠、EDTA和水中溶解度从大到小的顺序为:(A) EDTA>NaCl> H2O>稀H2SO4 (B) EDTA>NaCl>稀H2SO4>H2O(C) NaCl>稀H2SO4>H2O> EDTA (D) 稀H2SO4>NaCl>EDTA>H2O15. 进行重量法分析,下列说法正确的是:(A) 欲使沉淀净化,洗涤水量越多越好(B) 非晶型沉淀,一定用热溶液洗涤(C) 沉淀的洗涤剂只能是蒸馏水(D) 沉淀的体积越大越易洗净16. 下列哪组试剂是佛尔哈德法测定Cl-时全需使用?(A) FeNH4(SO4)2、K2CrO4 (B) KSCN、FeNH4(SO4)2(C) Fe(NH4)2(SO4)2 、硝基苯(D) K2CrO4、硝基苯17. 锰形成多种氧化态的化合物,其中最稳定的是:(A) 酸性介质中的Mn (Ⅱ) (B) 酸性介质中的Mn (Ⅶ)(C) 中性介质中的Mn (Ⅳ) (D) 中性介质中的Mn (Ⅵ)18. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+ (B) Cu2+和Zn2+ (C) Fe3+和Cr3+ (D) Cr3+和Zn2+19. K+与四苯硼钠可以形成晶体沉淀,这种沉淀是:(A) 离子化合物(B) 螯合物(C) 分子晶体化合物(D) 离子对化合物20. 用等体积萃取并要求一次萃取率不小于99%,则分配比最小为:(A) 50 (B) 100 (C) 99 (D) 199二、填充题1. 配合物[Co(en)3]Cl3(en为乙二胺简写符号)的名称为______________________。

名姓号学级班11混酸混酸NHOKOHCH 3CH 2OHCH 3CH 2Br12N13.24+NaOH+Br 2N H 2O14NaNO , HClNH 20-5℃OH15.三:排序(6 )1.将下列化合物对亲电取代反应的容易程度排列成序BrNO2.比较下列羧酸的酸性COOHCH 3COOHNO 2COOHNO 2COOH3.比较下列化合物的碱性甲胺 二甲胺 氨 苯胺四、区别下列各组化合物:(4)1 甲酸 乙酸 乙醇CH 3OCH 3OOCH 3OCH 3OO CH 3C H 32.五 用化学方法分离下列各组化合物(6)1.邻甲苯酚 水杨酸 N-甲基苯胺 对甲基苯胺 甲苯2CH 3NO 2CH 3CN六 用指定的原料合成下列各化合物(小分子及无机试剂任选) (25)C H 2COOH1.BrC H 32.3.从苯出发合成多巴胺O HO HN H 24从丙二酸脂出发合成OCOOCH 3CH 3CH 3OOOC H 3CH 3CH 3COOH5.七、简要回答问题(19分)1 写出下述反应的机理H 5C 6H 2CCH 2C 6H 5O+C H 2C H 3ONaO CH CH 3OHOH 5C 6C 6H 5C H 3H 3H 3H3H 32.(1) 哪个化合物是手性分子? (2) 写出手性分子的稳定构象式。
3.化合物A (C 9H 10O )不能起碘仿反应,其红外光谱表明在1690cm -1处有一强吸收峰,其核磁共振数据如下:δ1.2(3H,t),δ3.0(2H,q),δ7.2(5H,m)。
写出A的结构并标注对应的化学位移。
南京工业大学有机化学B 试题(A)卷试题标准答案2008--2009 学年第二学期使用班级化学0701-2一:命名1.甲基丁二酸酐2.N,N-二甲基环戊甲酰胺3.3-吡啶磺酸4.溴化二甲基苄基十二烷基铵5.α-环己酮甲酸甲酯6.4-甲基-4’-乙氧基偶氮苯7.3-甲基-丁腈8.(2S,3S)-2-乙基-2,3-二羟基丁二酸9.3-呋喃甲酸10.-甲基葡萄糖二:完成反应C O O HC O O HN H OO1.2CH2NH2ONC H3C H3O H3CH3OC H34.ClON HO H5CH 3CH 3OC H 3OO C H 36NO 27.NH28.H 339.CH 3CNO HCH 3COOH O H10.N H 2NO 211.O 2NO 2NNO 2+NO 2NO 212.OONC H 3OONKNSO 3H13.N H 214.N 2ClNNOH15.三:排序BrNO>>>1.C O O HNO 2COOHNO 2COOHCOOHCH 3>>>2苯胺>>3.二甲胺甲胺>氨四:区别化合物1. 银镜反应,碳酸钠溶液 2. FeCl 3溶液 3. 五:分离1. 兴斯堡反应,蒸馏。

一、选择题1. 配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为:(A) 无机阴离子-无机分子-有机配体(B) 无机分子-无机阴离子-有机配体(C) 有机配体-无机分子-无机阴离子(D) 有机配体-无机阴离子-无机分子2. [Cu(NH3)4]2+为内轨型配合物、平面四方形构型,其磁矩为:(A) 5.75?SUB>B (B) 3.87?SUB>B (C) 1.73?SUB>B (D) 0?SUB>B3. Fe2+有6个3d电子,配合物[Fe(CN)6]4-,△o= 395kJ·mol-1;Ep=213kJ·mol-1。
则晶体场稳定化能CFSE等于(kJ·mol-1):(A) -522 (B) -470.4 (C) -948 (D) -3094. 在等年度的Ca2+、Mg2+、Al3+、Fe3+溶液中,加入EDTA溶液,首先与EDTA形成配合物的是:(A) Ca2+ (B) Mg2+ (C) Al3+ (D) Fe3+5. 在pH = 12.00的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是:(A) Mg2+的量(B) Ca2+的量(C) Ca2+-Mg2+的量(D) Ca2++Mg2+的量6. 物质Fe3O4中的Fe的氧化数是(A) +2 (B) +3 (C) +4/3(D) +8/37. 已知: Fe3++ e = Fe2+φo = 0.77V;Zn2++ 2e = Zn φo = -0.76 VFe2++ 2e = Fe φo = -0.44V;Al3++ 3e = Al φo = -1.66 V上述物质中还原性最强的是(A) Zn (B) Fe2+(C) Fe (D) Al8. 人们规定标准电极在标准状态下的电极电位为0。
标准电极是:(A) 甘汞电极(B) 银电极(C) 氢电极(D) 铂电极9. 用能斯特方程φ=φθ+ (0.0592/n)lgC(氧化型)/C(还原型)计算φCr2O72-/Cr3+的电极电位时,说法不正确的是:(A) 温度应为298 K (B) Cr3+浓度增大则φ减小(C) H+浓度的变化对φ无影响(D) Cr2O72-浓度增大,则φ增大10. φo MnO4-/ Mn2+ = 1.45V,φoSn4+/Sn2+= 0.15V,以MnO4-滴定Sn2+,([H+]=1mol·L-1)其化学计量点的电极电位为:(A) 0.80V (B) 1.48V (C) 1.30V(D) 1.08V11. 可以直接配制的标准溶液是:(A) K2Cr2O7 (B) K2S2O8 (C) Na2S2O3 (D) Ce(SO4)212. 碘量法用纯Cu标定Na2S2O3标准溶液,将Cu溶解说Cu2+所用的溶剂为:(A) HNO3 (B) HCl (C) 浓H2SO4 (D) HCl + H2O213. 下列说法正确的是:(A) 聚集速度越大越易形成晶体沉淀(B) 过饱和度越大,定向速度越大(C) 聚集速度越小越易形成晶体沉淀(D) 过饱和度越小,定向速度越大14. 在下列措施中,不能增加ZnS沉淀溶液中Zn2+浓度(mol·L-1)的措施是:(A) 加HNO3 (B) 加水(C) 加Cu2+ (D) NaCl15. 下列说法不正确的是:(A) 称量形式的组成必须单一(B) 沉淀形式溶度积一定要小(C) 沉淀剂不纯对重量分析法无影响(D) 加入的沉淀剂的量不必准确16. 法扬司法测定Cl-时,使用的指示剂是:(A) Ag2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 工业上五氧化二钒的主要用途是做(A) 吸附剂(B) 表面活性剂(C)催化剂(D)氧化剂18. 下列离子的颜色为粉红色的是(A) [Fe(H2O)6]2+ (B) [Ni(H2O)6]2+ (C) [Ni(NH3)6]2+ (D) [Co(H2O )6]2+19. 阴离子交换树脂可分离下列哪组物质?(A) 氯化钠和氯化钾(B) 苯酚和醋酸(C) 氯化钠和溴化钠(D) 水和NaOH20. 用薄层层析法,以苯-乙酸乙酯为展开剂分离黄连素时,已知比移值为0.41,溶剂前沿距离为24.5 cm,则斑点中心只原点的距(A) 10.0cm (B) 14.5cm (C)10.3cm (D) 无法确定二、填充题1. 配离子[Co(NH3)4(NO2)Cl]+的名称为_____________________(若有多个答案,用”;“号间隔。
![分析化学试题及答案[汇总].doc](https://img.taocdn.com/s1/m/d0bec9e102020740bf1e9b78.png)
分析化学试题及答案一.填空(每空1分,共28分,答在试卷上)1 •定量分析过程包插_______________ , _________________________ ,_____________________ 和______________ 四个步骤.2.根据有效数字计算规则计算:1.683 + 37.42x7. 3321.4-0. 056二14.43. _____________________________________________________________ 某酸的水溶液中,若6哄为0.28, 6 a-=5 8 那么6 为 _______________________________________________________ 。
4.含有ZF和A广的酸性缓冲溶液,欲在pH=5〜5. 5的条件下,用EDTA标准溶液滴定其中的Zn2;加入一定量六亚甲基四胺的作用是 _______ :加入NHF的作用是________ 「5.NaOH滴定HC1时,浓度增大10倍,则滴定曲线突跃范围增大___ 个pH单位;若为滴定叽,则突跃范围増大 ___ 个pll单位.6. _______________________________________________ 对于实验数据中的异常值的取舍,通常可根据_____________________________________________________ 、________ 和_________ 方法來判断。
7. _____________________________________________________ 莫尔法与佛尔哈徳法的指示剂分别为、_____________________________________________________________ 。
8.紫外可见分光光度计由_________ . ______________ , ________ 和____________ 四部分组成.9.检验两组结果是否存在显著性差异采用____ 检验法,检验两组数据的精密度是否存在显著性差异采用 ___ 检验法。

南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名一1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。

2011分析化学试题及答案A卷一、选择题(每题2分,共20分)1. 下列哪种物质不是分析化学中常用的标准物质?A. 纯水B. 硝酸银C. 硫酸铜D. 氯化钠答案:B2. 以下哪种仪器不适合用于测量溶液的pH值?A. pH计B. 滴定管C. 酸度计D. 电子pH计答案:B3. 在滴定分析中,终点的确定可以通过以下哪种方法?A. 观察颜色变化B. 测量溶液的密度C. 测量溶液的粘度D. 测量溶液的电导率答案:A4. 原子吸收光谱法中,原子化器的作用是什么?A. 将样品转化为气态B. 将样品转化为固态C. 将样品转化为液态D. 将样品转化为固态和液态5. 以下哪种方法不适用于分离蛋白质?A. 电泳B. 色谱C. 离心D. 蒸馏答案:D6. 红外光谱法中,化合物的哪些官能团可以被检测?A. 金属离子B. 非金属离子C. 有机官能团D. 无机官能团答案:C7. 质谱分析中,质荷比(m/z)表示什么?A. 分子量与电荷量的比值B. 分子量与质量的比值C. 电荷量与质量的比值D. 电荷量与电量的比值答案:A8. 以下哪种方法用于测定溶液中的离子浓度?A. 紫外-可见光谱法B. 原子吸收光谱法C. 核磁共振法D. 电导率法答案:B9. 液相色谱中,固定相通常是什么?B. 液体C. 固体D. 离子答案:C10. 以下哪种物质不是常用的缓冲溶液?A. 磷酸二氢钾B. 柠檬酸C. 硫酸铵D. 硼酸答案:C二、填空题(每题2分,共20分)1. 在酸碱滴定中,滴定终点的pH值与滴定剂的_________有关。
答案:浓度2. 火焰原子吸收光谱法中,火焰的温度通常在_________℃左右。
答案:2000-30003. 紫外-可见光谱法中,_________是测量溶液中物质含量的重要参数。
答案:吸光度4. 在气相色谱分析中,_________是影响分离效率的关键因素之一。
答案:柱温5. 质谱仪中,_________的作用是将样品分子电离成离子。

南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名一1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。

一、填空题(20分,每小题2分)1.两股不同组成的料液进同一精馏塔分离,两股料分别进入塔的相应塔板和两股料混合后再进塔相比,前者能耗 __________后者。
(大于、小于、等于、不确定)2.连续精馏塔操作时, 增大塔釜加热蒸汽用量,若回流量和进料的F 、F x 、q 都不变,则L/V__________。
(增大、减少、不变、不确定)3.塔顶和进料操作条件不变,易挥发组分回收率不变,设计精馏塔时,用直接蒸汽加热釜液与用间接蒸汽加热相比,残液组成W x __________ 。
(增大、减少、不变、不确定)4. 试比较某精馏塔中第n,n+1层理论板上参数的大小(理论板的序数由塔顶向下数起),即:1+n y ___n y ,n t ___1+n t ,n y ___nx大于、小于、等于、不确定)5. 某二元物系的相对挥发度α=3,在具有理论板的精馏塔内于全回流条件下作精馏塔操作,已知n x =0.3,则1-n y =___(由塔顶往下数) 6.某连续精馏塔的设计任务为:原料为F x F ,,要求塔顶为D ,D x ,塔底为W x 。
若选定回流比R 加料状态由原来的饱和蒸汽改为饱和液体,则所需的理论板数N_____________,提馏段下降液体量L ’_____________。
(增加、减小、不变)7.举出四种型式的塔板_______、______、_______、________。
8.干燥进行的必要条件是物料表面所产生的水汽(或其它蒸汽)压力__________________。
9. 某湿物料含水量为0.4绝干料水kg kg /,当与一定状态的空气接触时,测出平衡水分0.1绝干料水kg kg /,则湿物料的自由含水量为______________。
10. 物料中结合水的特点之一是其产生的水蒸汽压_____________同温度下纯水的饱和蒸汽压。
(小于 、 等于、 大于)二、选择题(20分,每小题2分)1.降液管内液体表观停留时间不得少于3-5秒的限制,是为了( )。

《工业化学分析》试题(卷)A一、选择题是(每小题1.5分,共22.5分)1. 定量分析工作要求测定结果的误差:()A.愈大愈好 B. 等于零 C.没有要求 D .在允许范围之内2. 用电光分析天平称物。
天平的零点为-0.3mg,当砝码和环码加到11.3500g 时,天平停点为+4.5 mg。
此物重为:()A. 11.3545 gB.11.3548C.11.3542 gD.11.0545 g3. 用25ml移液管移出的溶液体积应记录为:()A.25ml B.25.0ml C.25.00ml D.25.000ml4. 欲配制一升0.1mol/LNaOH溶液,应称取NaOH(其摩尔质量为40.01g/mol)多少克?()A.0.4 gB. 1 gC. 4 gD.10 g5.标定NaOH溶液常用的基准物有:()A.无水Na2CO3B. 邻苯二甲酸氢钾C.硼砂D. CaCO36.滴定分析中,一般利用指示剂颜色的突变来判断等量点的到达,在指示剂变色时停止滴定。
这一点称为:()A.等量点B.滴定分析C.滴定D.滴定终点7.按质子理论,Na2HPO4是:()A.中性物质B.酸性物质C.碱性物质D.两性物质8.某碱样为NaOH和Na2CO3的混合液,用HCl标准溶液滴定。
先以酚酞为指示剂,耗去HCl溶液V1毫升,继以甲基橙为指示剂,又用去HCl溶液V2毫升。
V1与V2的关系是:()A. V1=V2B.V1=2 V2C.2V1=V2D.V1> V29.在Ca2+、Mg2+的混合液中,用EDTA法测定Ca2+,要消除Mg2+的干扰,宜用:()A.控制酸度法B.络合掩蔽法C.氧化还原掩蔽法D.沉淀掩蔽法10.以AgNO3溶液滴定NaCl溶液,合适的指示剂为:()A.酚酞B.甲基橙C.甲橙红D.铬酸钾11. 摩尔法测定Cl-含量时,要求介质的pH在6.5-10.0范围内。
若酸度过高,则()A.AgCl沉淀不完全B.AgCl沉淀易胶溶C.AgCl沉淀吸附Cl-D.Ag2CrO4沉淀不易形成12.下列哪条违反了非晶形沉淀的沉淀条件?()A.沉淀作用宜在较浓的溶液中进行B.沉淀俢宜在热溶液中进行C.在不断搅拌下,迅速加入沉淀剂D.沉淀宜放置过夜,使沉淀陈化13.如果被吸附的杂质和沉淀具有相同的晶格,这就形成:()A.后沉淀B.机械吸留C.包藏D.混晶14.以SO24-沉淀Ba2+时,加入适量过量的SO24-可以使Ba2+离子沉淀更完全。

南京工业大学无机分析化学题库试题10一、选择题1. 配合物[PtCl2(NH3)2]能与C2O42-反应形成了螯合物,则[PtCl2(NH3)2]应为:(A) 左旋光异构体(B) 右旋光异构体(C) 顺式异构体(D) 反式异构体2. 螯合物[Fe(C2O4)3]3-的磁矩为5.75μB,其空间构型和中心原子的杂化轨道类型是:(A) 八面体型和sp3d2杂化(B) 八面体型和d2sp3杂化(C) 三角双锥型和sp3d2杂化(D) 三角形和sp2杂化3. 若Co3+的电子成对能为21000cm-1,F-和NH3的配位场分裂能分别为13000cm-1和23000cm-1,判断[CoF6]3-和[Co(NH3)6]3+配离子的自旋状态:(A) 高自旋、高自旋(B) 高自旋、低自旋(C) 低自旋、高自旋(D) 低自旋、低自旋4. EDTA与Ca2+、Fe3+、Al3+配合物稳定常数的次序是:(A) Ca2+>Fe3+>Al3+ (B) Al3+>Ca2+>Fe3+ (C) Fe3+>Al3+>Ca2+ (D) Al3+>Fe3+>Ca2+5. M与EDTA配合物组成是:(A) M?H4Y (B) M?H2Y2- (C) M?HY3- (D)M?Y4-6. 物质OF2中的O的氧化数是:(A) +2 (B) +1 (C) -1 (D) -27. 原电池(-)Zn│Zn2+(mo l?L-1 )‖Ag+(mo l?L-1 )│Ag(+),已知:φoAg+/Ag=0.80V,φoZn2+/Zn=-0.76V,在298.15 K 时,该电池的反应平衡常数lgKθ为:(A) 26.4 (B) 52.9 (C) 63.3 (D) 79.78. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4______-0.89V____PH3电对φH2PO2-/PH3的标准电极电位为:(A) -1.57V (B) -1.23V (C) -4.92V (D) -1.91V9. 用Na2C2O4标定KMnO4时,由于反应速度不够快,因此滴定时要维持足够的酸度和温度,但酸度和温度过高时,又会发生:(A) H2C2O4分解(B) H2C2O4析出(C) H2C2O4挥发(D) H2C2O4与O2反应10. φo Cr2O72-/ Cr3+ = 1.33V,φoFe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+]=1mol ?L-1)滴至40%时的电极电位为:(A) 0.65V (B) 1.01V (C) 0.11V (D) 0.67V11. 用H2C2O4标定KMnO4时,所用的指示剂为:(A) 二甲酚橙(B) 淀粉溶液(C) KMnO4 (D) 二苯胺磺酸钠12. 用K2Cr2O7滴定Fe2+, K2Cr2O7的计量单元等于其摩尔质量除以:(A) 3 (B) 5 (C) 6 (D) 713. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 沉淀的溶度积小者,溶解度一定小(D) 沉淀的溶解度大者,其溶度积一定大14. 在CaC2O4沉淀中加入同体积、同浓度的液体,溶解度最大的是:(A) NH3 (B) KNO3 (C) EDTA (D) NaCl15. 进行重量法分析,下列说法正确的是:(A) 欲使沉淀净化,洗涤水量越多越好(B) 非晶型沉淀,一定用热溶液洗涤(C) 沉淀的洗涤剂只能是蒸馏水(D) 沉淀的体积越大越易洗净16. 莫尔法测定Cl-时,使用的指示剂是:(A) K2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 锰形成多种氧化态的化合物,其中最稳定的是:(A) 酸性介质中的Mn (Ⅱ) (B) 酸性介质中的Mn (Ⅶ)(C) 中性介质中的Mn (Ⅳ) (D) 中性介质中的Mn (Ⅵ)18. 溶液中加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是(A) Cr(Ⅲ) (B)Ni(Ⅱ) (C) MnO42- (D) Fe2+19. 某物质由阴、阳离子组成,不溶于水但可溶于有机溶剂,这种物质称作:(A) 离子化合物(B) 离子对化合物(C) 螯合物(D) 配合物20. 用等体积萃取并要求一次萃取率大于94%,则分配比最小为:(A) 19 (B) 38 (C) 9.5 (D) 95二、填充题1. 配合物Li[AlH4]的名称为______________________。

第一章分析质量保证1.某人以差示光度法测定某药物中主成分的含量时,称取此药物0.0250g,最后计算其主成分的含量为98.25%,此含量的正确值应该是___________ 。
(98%,因为仪器误差为2%)2. 2.某学生分析工业碱试样,称取含Na2CO3(Mr =106.0)为50.00%的试样0.4240g,滴定时消耗0.1000mol/LHCl40.10ml,该次测定的相对误差是_____。
(0.24%)3. 3.用高碘酸钾光度法测定低含量锰的方法误差约为2%。
使用称量误差为±0.001g的天平减量法称取MnSO4,若要配制成0.2mg/ml的硫酸锰的标准溶液,至少要配制____________ml。
( 0.002/m=0.02,m=0.1g,故配制500ml)4. 4.溶液中含有0.095mol/L的氢氧根离子,其pH值为__________ 。
(12.98)5. 5.列有关置信区间的定义中,正确的是:A 以真值为中心的某一区间包括测定结果的平均值的几率B 在一定置信度时,以测量值的平均值为中心的,包括真值在内的可靠范围C 真值落在某一可靠区间的几率D 在一定置信度时,以真值为中心的可靠范围(B)6. 6.有两组分析数据,要比较它们的精密度有无显著性差异,应当用______检验法7.7.滴定管的初读数为(0.05±0.01)ml,末读数为(22.10±0.01)ml,滴定剂的体积可能波动的范围是________________。
(22.05±0.02ml)8.8.某同学测定盐酸浓度为:0.2038、0.2042、0.2052和0.2039mol/L,按Q(0.90)检验法,第三份结果应__________-;若再测一次,不为检验法舍弃的最小值是_________;最大值是_____________。
(Q=0.71<0.76,保留;0.2014;0.2077)9.准确度是表示测得值与____________之间符合的程度;精密度是表示测得值与_________之间符合的程度。

南京工业大学无机与分析化学样卷(上)卷(一页开卷)学年第一学期使用班级化工、材料、生工、环境各专业学院专业学号姓名一、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)1. 元素N的核外电子正确排布是:(A) 1s22s22px 1py1pz1(B) 1s22s12px2py1pz1 (C) 1s22s22px2py1 (D)1s22s22px 1py22. 下列那种物质可作为基准物质标定NaOH?(A) 1mol/L的HCl(B) 无水Na2CO3(C) FeSO4(D) 邻苯二甲酸氢钾3. 已知HAc的浓度为0.12 mol/L,其pH值表达正确的是:(A) 2.8 (B) 2.83 (C)2.833 (D) 2.83284. 实验数据的精密度不好,最可能的引起原因是:(A) 系统误差所致 (B) 实验操作不熟练 (C) 偶然误差太大 (D) 实验次数太少5. 下列完全正确的4个量子(依次为n,l,m,ms)数组合是:(A) 3、3、-2、+1/2 (B) 3、2、5、+1/2 (C) 3、2、-1、-1/2 (D) 3、1、-1、+16. 下列化学键中具有“键角”参数的物质是:(A) 金属Zn (B) KCl (C) HCl (D) H2S7. CO2中碳原子C中的2s和2p轨道采取:(A) sp杂化 (B) sp2杂化 (C) 等性sp3杂化 (D) 不等性sp3杂化8. O2、H2S、NH3、NaCl化学键极性从强到弱顺序为:(A) O2> H2S> NH3> NaCl (B) H2S> NH3> NaCl> O2(C) NH3> NaCl> O2> H2S (D) NaCl> NH3> H2S> O29. BaS、BaO、NaCl、NaF晶体的熔点从高到低的顺序为:(A) BaS>BaO>NaCl>NaF (B)BaO>NaF>BaS>NaCl(C) BaO>BaS>NaF>NaCl (D) NaF>NaCl>BaS>BaO10. 下列那组物质是共轭酸碱(A) H2O和OH- (B)H3PO4和HPO42- (C)NaOH和HCl (D)H2SO4和H2SO311. 第29号元素为Cu,其亚铜离子溶液为无色,其核外电子排布式应为:(A) [Ar]3d104s1 (B)[Ar]3d94s2 (C)[Ar]3d105s1 (D)[Ar]3d54p612. 欲配制pH=9~10的缓冲溶液,最好使用选择那种体系:(A) KH2PO4+K2HPO4(Ka2= 6.30×10-3) (B)NH3+NH4Cl (Kb=1.8×10-5)(C) NaAc+HAc (Ka =1.8×10-5) (D) KHSO3+H2SO3(Ka=1.3×10-2)13. HCl滴定某碱,突跃范围为pH=4.3~3.6,化学计量点的pH=3.95,且知溴甲酚绿的变色范pH=4.0~5.6 (黄~蓝,中间色为绿色),酚酞的变色范围为pH=8.0~10.0 (无色~红色),下列指示剂的选择及滴定终点的颜色均正确的是:(A) 溴甲酚绿,黄色(B) 溴甲酚绿,绿色 (C) 酚酞,无色(D) 酚酞,红色14. 在下列物质中,能用强碱NaOH溶液直接滴定的溶液是:(A) NH4Cl (NH3的Kb=1.8×10-5) (B) NH2OH (NH2O-的Kb=9.1×10-9)(C) 苯酚 (Ka=1.1×10-10) (D) HCN(CN-的Kb= 1.5×10-5)15. 下列分子中,键角最小的是:(A) AlCl3 (B) PH3(C)CH4(D) MgBr216. 在化学反应中,催化剂的作用是:(A) 增大平衡常数K (B) 增大活化能(C) 降低活化能(D) 增加分子能量17. 根据离子极化和离子变形学说,下列物质在水中溶解度从大到小的顺序为:(A) CuI>CuCl>CuF>CuBr (B)CuI>CuBr>CuCl>CuF(C) CuF>CuI>CuCl>CuBr (D) CuF>CuCl>CuBr>CuI18. 已知下列反应的平衡常数:H2(g) + S(s) = H2S(s) K1、S(s) + O2(g)= SO2(g) K2、则反应: H2(g) + SO2(g) = O2(g) + H2S(g) 的平衡常数K等于:(A) K1 + K2(B) K1-K2(C) K1·K 2(D) K1/K219. 放热反应2NO(g) + O2(g) = 2NO2(g) 达平衡后,若分别采取:①增加反应的总压力;②用吸附剂吸附NO2,减少NO2的量;③减少O2的量;④升高温度(假设K不变);⑤加入催化剂。
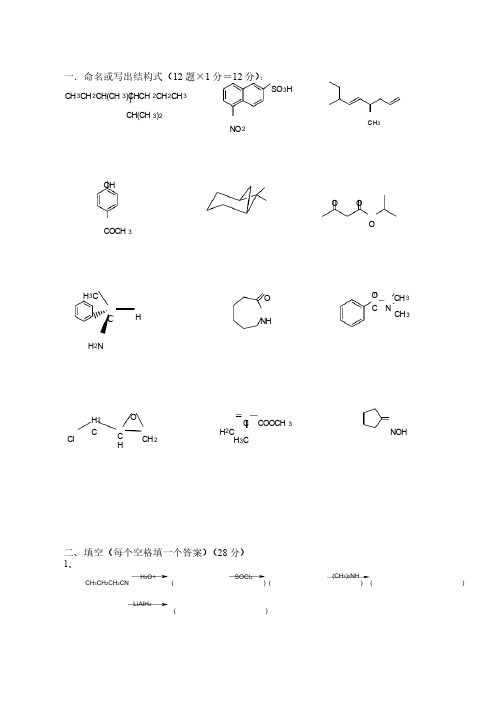
一.命名或写出结构式(12题×1分=12分):CH 3CH 2CH(CH 3)CHCH 2CH 2CH 3CH(CH 3)2CH 3OHCOCH 3H 2CH 3CC COOCH3NOHSO 3HNO 2OOO CH 2NH 3CHNHOC CH 3CH 3O NO C HCH 2H 2CCl二、填空(每个空格填一个答案)(28分)1、( )( )( )( )H 3O+CH 3CH 2CH 2CNSOCl 2(CH 3)2NH LiAlH 42、LiAlH 4CH 3CH 2CH 2CHOHCNOH-稀NaHSO 3NHNH 2NO 2O 2NZn-Hg,HCl干HOCH 2CH 2OHCl H ( )( )( )( )( )( )( )4、( )( )( )NH O ONaOH KOHBrCH 2COOCH 2CH 3OH-O H 2NaOH/H 2OClHNO3,H 2SO 45ClZn, HOAc 6O 3H 2O (1)(1)CH 3INAg 2O78H 2O, H(1)B 2H 6(2)H 2O 2, NaOHN aOHC lOHC H 3OH92 NO2BrFe/HCl Br 2 /H 2 O (CH 3 CO)2 O 稀盐酸稀盐酸10三、用化学方法区别下列各组化合物(10分)分)A) CH3(CH 2)3NH 2B) (CH3CH 2CH 2)2NH C) (CH3CH 2)3N 1.A) CH3CH 2CH 2CH 2Br B) CH3CHBrCH 2CH 3C) (CH3)3CBr 2.四、简要回答问题(10分)分) 1.写出下述反应的机理:.写出下述反应的机理:CH 2OHH++2.请写出下述化合物的最稳定构象:.请写出下述化合物的最稳定构象:ClCH 2CH 2Cl(1)HCH 3HC(CH 3)3(2)五、指定顺序排列(12分)分) 1.按碱性强弱顺序:按碱性强弱顺序:NH 2NHCOCH 3A.C.NH 2B.2.按酸性强弱顺序:按酸性强弱顺序:A. C.B.C 6H 5OH CH 3CO 2H ClCH 2CO 2H3.按亲核加成活性强弱顺序:按亲核加成活性强弱顺序: A. C.B.CH 3CHOCH 3COCH 3C O4.按羧酸衍生物水解活性强弱顺序:按羧酸衍生物水解活性强弱顺序: A. C.B.CH 3CH 2COCl CH 3CO 2CH 3CH 3CH 2CONH 2六、指定原料合成下列化合物,其它试剂可任意选择(20分)分)1.CH 2(CO 2C 2H 5)2CH 3CH 2CH 2CH 2CO 2H2.H 3CH 3CBrO3.CH3COCH2CO2C2H5C C2H5C2H5C2H54.OH分)七、推测化合物结构(8分)化合物(A)的分子式为C5H6O3,它能与乙醇作用得到两个互为异构体的化合物(B)和(C),(B)和(C)分别与亚硫酰氯(SOCl2)作用后再与乙醇反应,两者都生成同一化合物(D)。

南京⼯业⼤学分化期末试卷光学分析概论(⼀)判断题()1.从本质上⽽⾔,质谱应属于波谱范畴。
()2.化合物的可见-紫外吸收光谱,主要是由分⼦中价电⼦的跃迁⽽产⽣。
(⼆)单选题1.属于⾮光谱分析法的是()A.UV B.IR C.X-ray D.AAS E.NMR2.属于光谱分析法的是()A.⽐浊法B.折射法C.旋光法D.红外吸收法E.X-射线衍射法3.某化合物受电磁辐射作⽤后,振动能级发⽣变化,所产⽣的光谱波长范围是()A.紫外光B.X射线C.微波D.红外线E.可见光4.不同波段的电磁波具有不同的能量,其⼤⼩顺序是()A.⽆线电波>红外光>可见光>紫外光>X射线B.X射线>红外光>可见光>紫外光>⽆线电波C.X射线>红外光>可见光>紫外光>微波D.X射线>紫外光>可见光>红外光>微波E.微波>X射线>紫外光>可见光>红外光5.电⼦能级间隔越⼩,跃迁时吸收光⼦的()A.数⽬越多B.波长越长C.能量越⼤D.波数越⼤E.频率越⾼6.分⼦吸收了外来辐射后,外层价电⼦跃迁时所产⽣的光谱波长范围通常在()A.⽆线电波区B.微波区C.X射线区D.红外光区E.可见-紫外光区7.复合光变成单⾊光的过程称为()A.散射B.折射C.衍射D.⾊散E.激发(三)多选题1.真空紫外、近紫外、可见光谱的能级跃迁⽅式是()A.内层电⼦跃迁B.中层电⼦跃迁C.外层电⼦跃迁D.分⼦振动跃迁E.价电⼦跃迁2.属于光谱法的是()A.UV B.IR C.AAS D.MS E.X-ray3.属于⾮光谱分析法的是()A.UV B.IR C.X-ray D.CD E.AES(四)填空题1.当光照射到物质上时,光与物质之间便产⽣光的、、、等现象。
2.按产⽣光谱的⽅式不同,光谱法可以分为、、。
(五)名词解释(⼀)判断题1.×2.√(⼆)单选题1.C 2.D 3.D 4.D 5.B 6.E 7.D(三)多选题1.CE 2.ABC 3.CD(四)填空题1.反射、散射、折射、吸收。
一、选择题(每小题 2 分,共 40 分)1(A)(B)(C)(D)23(A) 1.030 mol/L (B) pH = 12.023(C) 1.023 mol/L (D) pH = 1.233(A) (B)(C)(D)4 NaOH(A)K b = 4.6× 10-10 (B) NH 4NO 3 NH 3 K b = 1.8× 10-5(C)K a =1.4×10-4(D) Na 2SO 45 pH 3(A) HAc pK =4.74(B) pKa =3.74a(C)pK a =2.86 (D)pK a =1.306 H 3PO 42.12 7.20 12.36NaOHpH(A) 2.12(B) 5.66(C) 7.20(D) 9.787nn(A)(C)Y(H)Y(H)1K a i[ H]i(B)i 1niH[ H ] i1(D)i1Y(H)Y(H)1[ H ] ii 1n [H ]i 1K a ii 18EDTABi 3+ Pb 2+ Bi 3+Pb 2+lg K BiY27.94 lg K PbY 18.04 pK sp,Bi(OH) 3 30.4 pK sp,Bi(OH) 3 14.93(A) pH(B) pH(C) Bi 3+Bi(OH) 3Bi(OH) 3Bi 3+(D) Pb 2+Pb(OH) 2Bi 3+9lg K ZnY16.5pH45 67lgY(H)8.44 6.454.563.200.02000 mol/L EDTA0.02 mol/L Zn2+0.1%(A) pH 4(B) pH 6(C) pH8(D) pH 1010Fe 3+ Fe 2+Fe 3+/Fe 2+(A)H SO4(B)(C) NHF(D) K Cr O7242 211E 0' 4/Ce 31.44 V E 0' 3/Fe 20.68VCe 4++ Fe 2+ = Ce 3+ + Fe 3+CeFeFe 3+ Fe 2+(A) 1.08 × 10-18 (B) 92.5(C) 36.2(D) 2.76 × 106(A) [Fe 3+ ]=[Cr 3+ ], [Fe 2+2-] (B) 3+ 3+2+2- ]]=[Cr 2 O 73[Fe ]=[Cr] , [Fe]=6[Cr 2O 7(C) [Fe 3+]=3[Cr 3+], [Fe 2+]=6[Cr 2O 72- ] (D) [Fe 3+]=3[Cr 3+] , 6[Fe 2+]=[Cr 2O 72- ]13 间接碘量法的主要误差来源是 ()(A) 碘的挥发和空气中的氧对碘离子的氧化 (C) 淀粉指示剂对大量碘的吸附(B) 碘的溶解度较小,易在溶液中析出(D) 碘的黄色褪去不易观察14 在不另加试剂的情况下, 可以用莫尔法直接滴定的含氯试样是()(A) FeCl3(B) BaCl2(C) NaCl + NaS (D) NaCl + Na SO42215 某荧光吸附指示剂 HFl 形式为黄色,游离的 Fl -形式呈蓝色, Fl -被吸附后显紫红色。
碱性条件下,将其加入用 AgNO 3 滴定 Cl -的体系中,化学计量点前后的颜色转变是( )(A) 黄色→蓝色(B) 黄色→紫红色 (C) 蓝色→紫红色(D) 紫红色→蓝色16 能使沉淀的溶解度降低的因素是 ()(A) 同离子效应(B) 酸效应(C) 络合效应(D) 盐效应17 移取 FeCl 3 溶液 20.00 mL ,每次用 2.00 mL 含 HCl 的乙醚溶液萃取, 连续萃取三次。
已知 FeCl 3在乙醚和水中的分配比 D = 100,则上述操作中 FeCl 3 的萃取百分率为()(A) 90.9%(B) 99.0% (C) 99.1% (D) 99.9%18 用酸碱滴定法滴定硼酸时,痕量重金属离子杂质对滴定有妨害,若用离子交换法去除痕量重金属阳离子, 则应选用的离子交换树脂是 ()(A) 强酸性阳离子交换树脂 (B) 弱酸性阳离子交换树脂(C) 强碱性阴离子交换树脂肪 (D) 弱碱性阴离子交换树脂19 测定肉类试样中的易挥发重金属, 可以采用的试样预处理方法是()(A) 用氢氧化钠溶解(B) 高温灰化后用酸溶液(C) 在密封罐中用氧化性强酸消解(D) 蒸馏20 完成一项酸碱滴定方案设计的合理步骤是 ()① 根据指示剂的变色范围需部分与滴定突跃范围重叠的原则选择指示剂; ② 写出反应方程式,确定化学计量比和滴定终点的产物; ③ 估算滴定终点产物的 pH 值和滴定突跃范围; ④ 估算终点误差以检验滴定方法是否合理。
(A) ①②③④(B) ③①②④(C) ④②③① (D) ②③①④二、填空题(每空 1 分,共 10 分)1 若使用 50 mL 滴定管进行常量分析, 则设计实验时应使滴定剂消耗的体积不少于 。
若使用分析天平称样进行常量分析,则设计实验时应使称样质量不少于。
2 写出含 c 1 mol/L NaAc 和 c 2 mol/L NaOH 的混合水溶液的质子条件式:。
写出浓度为 c mol/L 的 Na 2CO 3 水溶液中 HCO 3-的分布分数计算公式:。
0.02000 mol/L HCl 溶液滴定相同浓度的 NaOH 溶液,突跃范围是。
3 根据标定与测定条件相近的原则,以二甲酚橙为指示剂,用EDTA 测定废水中的 Pb 2+时,所用 的 EDTA 标准溶液宜用标定(填“高纯 CaCO 3”或“ ZnO ”);若将在弱酸性条件下标 定的 EDTA 用于在强碱性条件下测定金属离子, 则所得结果。
(填“不受影响” 、“偏高”或“偏低” )4 得失电子数均为 1 的两个电对之间的可逆氧化-还原反应,其电位差至少达到时,反应的完全程度才能达到 99.9%以上;而对于得失电子数分别为 1 和 2 的两个电对之间的反应,该差值需达到。
5 纸上层析分离中,固定相是指,流动相是指起展开作用的溶剂。
三、问答题(每题 5 分,共 10 分)1 用 0.1000 mol/L NaOH标准溶液滴定浓度约为0.1mol/L 的 CH 3COOH ( pK a = 4.74 ),试通过简单的计算说明下列 4 种指示剂中哪个最合适。
A. 酚酞( pK a = 9.1 );B. 中性红( pK a = 7.4 );C. 甲基橙( pK a = 3.4 );D. 溴酚蓝( pK a = 4.1)2为了得到便于分离的沉淀,晶形沉淀和无定形沉淀的条件各是什么?四、计算题(每题8 分,共 40 分)1 测定黄铁矿中的硫的质量分数,六次测定结果分别为30.48% ,30.42% ,30.59%,30.51%,30.56%,30.49% 。
计算平均值、相对平均偏差、相对标准偏差和置信度为95%的平均值的置信区间。
置信度,显著性水准f P = 0.90,α= 0.10 P = 0.95,α= 0.05 P = 0.99,α= 0.015 2.02 2.57 4.036 1.94 2.45 3.712. 现有含 0.1000 mol/L HCl 和 0.1000 mol/L HAc 的混合溶液,能否用甲基橙作指示剂(变色点pH 为 4.0),用 0.1000 mol/L 的 NaOH 标准溶液准确测定其中HCl 的浓度?(要求测量误差小于 1.0%,已知 HAc 的 pK a = 4.74)3 称取三聚磷酸钠( 5 3 1043-,在 NH 34Cl Na P O )样品 0.3627 g ,溶于水,加强酸将其分解为PO-NH 缓冲溶液中,加入 0.2145 mol/L 的 Mg 2+溶液 25.00 mL 将 PO 43- 全部形成 MgNH 4PO 4 沉淀,过滤、洗涤。
沉淀灼烧成 Mg 2P 2O 7,称重为 0.3192 g ,滤液和洗液混合后用 EDTA 滴定多余的沉淀剂Mg 2+,终点时,问消耗 EDTA 标准溶液( c = 0.1241 mol/L )多少毫升?样品中三聚磷酸钠的质量分数是多少?已知 Mr(Na 5P 3O 10) = 367.9 ,M r(Mg 5P 2O 7) = 222.6。
4 计算在 1mol/LHCl 溶液中,用 Fe 3+滴定 Sn 2+至化学计量点时的电位,并计算滴定至99.9%和θ'θ'0.14 V 。
100.1% 时的电位。
已知 E Fe 3 /Fe 2 0.68V , E Sn 4 /Sn 2-49, Ka 1 ,H 2S=1.3× 10 -7 ,Ka 2 ,H 2 S =7.1 ×10 -15,Ag-NH 3 络合物的 1,5 已知 K sp,Ag 2S =2.0× 10lg β=3.24 lg β=7.05。
计算 Ag S 在 pH 8.00 、 [NH ]=0.01 mol/L 的水溶液中的溶解度。
22 3。