常见元素的原子序数
- 格式:docx
- 大小:37.02 KB
- 文档页数:3

27个元素符号记忆口诀1.氢(H)-原子序数为1,最轻的元素,存在于气态或液态中,常见于水。
2.氦(He)-原子序数为2,无色、无臭、无毒的气体,存在于太阳和其他恒星中,广泛用于气球充气。
3.锂(Li)-原子序数为3,一种银白色金属,用于制造锂离子电池。
4.铍(Be)-原子序数为4,一种灰白色金属,用于制造合金和核反应堆。
5.硼(B)-原子序数为5,一种非金属元素,用于制造玻璃和橡胶。
6.碳(C)-原子序数为6,生命中的基本元素,存在于有机物中,如煤炭和钻石。
7.氮(N)-原子序数为7,一种无色气体,占大气中78%的成分,在肥料和爆炸物的制造中广泛使用。
8.氧(O)-原子序数为8,一种气体,是地壳中最常见的元素之一,在燃烧和呼吸过程中起重要作用。
9.氟(F)-原子序数为9,一种黄绿色气体,广泛用于制造氟化物和氟化氢。
10.氖(Ne)-原子序数为10,一种无色气体,广泛应用于霓虹灯和激光器。
11.钠(Na)-原子序数为11,一种银白色金属,常见于食盐中,对维持体液平衡至关重要。
12.镁(Mg)-原子序数为12,一种银白色金属,存在于地壳和海水中,对植物的生长非常重要。
13.铝(Al)-原子序数为13,一种银白色金属,是常见的建筑材料,易于加工和回收利用。
14.硅(Si)-原子序数为14,一种灰色非金属元素,广泛用于制造计算机芯片和太阳能电池板。
15.磷(P)-原子序数为15,一种非金属元素,是生物体中DNA和RNA的重要构成部分。
16.硫(S)-原子序数为16,一种黄色非金属元素,存在于火山喷发和硫磺矿中。
17.氯(Cl)-原子序数为17,一种黄绿色气体,常用于消毒和制造化学物品。
18.钾(K)-原子序数为19,一种银白色金属,对神经传导和肌肉收缩至关重要。
19.钙(Ca)-原子序数为20,一种银白色金属,与骨骼和牙齿的形成密切相关。
20.钛(Ti)-原子序数为22,一种银灰色金属,用于航空航天和医学器械中。

常见元素的性质特征或结构特征元素是构成物质的基本组成单元,目前已知的元素共有118种。
每种元素都具有独特的性质特征和结构特征。
在这里,我们将讨论一些常见元素的性质特征和结构特征。
1.氢(H):氢是原子序数为1的元素,是宇宙中最丰富的元素之一、它是一种无色、无味、无臭的气体,在标准条件下,它是一种二原子分子,化学符号为H2、氢气具有极低的密度和高燃烧性。
它的原子结构只含有一个质子和一个电子。
2.氧(O):氧是原子序数为8的元素,是地球上最常见的元素之一、氧气是一种无色、无臭的气体,在标准条件下,它处于双原子分子状态O2、氧气是支持燃烧的气体,它是维持呼吸和燃烧的必要气体。
氧原子的电子结构是1s22s22p43.碳(C):碳是原子序数为6的元素,是生命的基础。
它是一种非金属元素,形成多种化合物。
碳具有高的熔点和热导率,是石墨和钻石的主要成分。
它的电子结构是1s22s22p24.氮(N):氮是原子序数为7的元素,是大气中的主要成分之一、它是一种无色、无味的气体,在标准条件下,它以双原子分子状态存在N2、氮在生物体中起着重要的作用,同时也是很多化合物如肥料和炸药的重要组成部分。
氮原子的电子结构是1s22s22p35.铁(Fe):铁是原子序数为26的元素,是地壳中含量第四多的元素。
它是一种金属,常以铁矿石的形式存在。
铁具有良好的导电和导热性能,同时也是一种强磁性材料。
它的电子结构是1s22s22p63s23p64s23d66.金(Au):金是原子序数为79的元素,是一种贵重金属。
它具有黄色,并以其高度的稳定性和可塑性而闻名。
金是一种良好的导电体,广泛用于制作珠宝和电子器件。
它的电子结构是1s22s22p63s23p64s23d104p65s24d105p66s14f145d106p67.氯(Cl):氯是原子序数为17的元素,是一种非金属。
它是一种黄绿色气体,在常温常压下,是以双原子分子状态Cl2存在。
氯具有强烈的腐蚀性和漂白性,在水中能够形成盐酸。

化学元素周期表重要元素及其特性的解读化学元素周期表是化学家们用来组织和分类所有已知元素的工具。
它由一系列水平排列的横行和垂直排列的竖列组成。
每个元素都有自己独特的原子序数、原子质量和化学性质。
在本文中,将重点介绍一些重要的元素及其特性。
1. 氢 (H):氢是周期表中最简单的元素,其原子序数为1。
它是宇宙中最常见的元素之一,也是构成水的主要成分。
氢气可以燃烧,是强力的燃料。
此外,氢还具有广泛的应用,如在合成氨、制造氢气燃料电池等。
2. 氧 (O):氧是生命中必不可少的元素之一,原子序数为8。
它是空气中最常见的元素,占空气体积的约1/5。
氧是火焰燃烧和许多生物呼吸过程中的关键成分。
此外,氧还可以与其他元素形成氧化物,如水和二氧化碳。
3. 碳 (C):碳是生命的基础,原子序数为6。
它是有机物的主要组成部分,包括蛋白质、脂肪、碳水化合物和核酸。
碳还可以形成多种形态,如钻石和石墨。
碳的特殊性质使得它成为材料科学和纳米技术的研究重点。
4. 氮 (N):氮是空气中的重要元素之一,原子序数为7。
它占空气体积的约78%。
氮在植物生长和动物组织中起着重要作用。
此外,氮还可以与其他元素形成许多有用的化合物,如氨、硝酸和氰化物。
5. 铁 (Fe):铁是人类文明发展史上至关重要的元素之一,原子序数为26。
它是地壳中最常见的金属之一。
铁具有良好的导电性和热传导性,因此广泛应用于制造工业。
铁还是血红蛋白的主要组成部分,负责输送氧气到人体各个器官。
6. 钾 (K):钾是人体内的重要矿物质之一,原子序数为19。
它在维持酸碱平衡和正常肌肉功能方面起着关键作用。
钾还参与神经信号传递和细胞功能调节。
蔬菜、水果和坚果是富含钾的食物。
7. 锌 (Zn):锌是人体所需的微量元素之一,原子序数为30。
它对细胞分裂、免疫功能和蛋白质合成至关重要。
锌还在许多酶反应中充当催化剂。
肉类、海鲜和豆类是富含锌的食物。
8. 黄金 (Au):黄金是一种珍贵金属,原子序数为79。

化学元素周期表及其特性化学元素周期表是一个有序排列的化学元素列表,其中元素按照其原子编号逐渐增加。
通过周期表,我们可以获得关于各种元素的重要信息,包括元素符号、原子序数、原子量以及元素的一些特性。
以下是一些常见的元素特性:1. 元素符号和原子编号元素符号是化学元素的缩写形式,由一个或两个字母组成。
常见的元素符号有H(氢)、O(氧)和Fe(铁)等。
原子编号是元素在周期表中的位置,也称为原子序数。
例如,氧的原子编号是8,铁的原子编号是26。
2. 原子量原子量是一个元素所含有的质子和中子的总数。
它通常以摩尔(mol)为单位表示。
原子量与元素的质量有关,可以用于计算元素的摩尔质量。
例如,氧的原子量为16 g/mol。
3. 化学性质化学性质是描述元素在化学反应中表现出的特性。
不同元素具有不同的化学性质,这些性质决定了元素在反应中的行为。
例如,金属元素具有良好的导电性和延展性,非金属元素则通常呈现不良导电性和脆性。
4. 物理性质物理性质是描述元素在物理过程中的特性。
它包括元素的密度、熔点、沸点等。
这些性质可以帮助我们了解元素的状态变化和物质性质。
例如,水的熔点是0摄氏度,沸点是100摄氏度。
5. 元素分类化学元素可以根据周期表中的位置进行分类。
元素主要分为金属、非金属和半金属三大类。
金属元素位于周期表的左侧和中间部分,具有良好的导电性和热传导性。
非金属元素位于周期表的右侧,通常为脆性、不良导电和导热的。
半金属元素则处于金属和非金属之间。
通过学习周期表及其特性,我们可以更好地了解化学元素的组成和特性,为化学研究和应用提供基础知识。

初中化学常见元素的化学符号和原子序数在化学领域中,元素是构成物质的基本单位。
元素由一种具有独特物理性质和化学性质的原子组成。
为了便于研究和交流,化学家们用标准符号来表示元素,这些符号我们称之为化学符号。
化学符号由字母或字母的组合构成,每个元素对应一个特定的符号。
1. 氢(Hydrogen)- H,原子序数 1氢是宇宙中最常见的元素之一,在元素周期表中,氢位于第1个位置。
它的化学符号是H,原子序数为1,表示氢原子的核内只有一个质子。
氢在自然界中以分子氢(H2)的形式存在,是化学反应中重要的基础原料之一。
2. 氦(Helium)- He,原子序数 2氦是元素周期表中的第二个元素,化学符号为He,原子序数为2。
氦是一种惰性气体,常用于气球和气体填充物。
氦的原子核内有两个质子和两个中子,这使得氦成为第二轻的元素。
3. 锂(Lithium)- Li,原子序数 3锂是一种碱金属元素,化学符号为Li,原子序数为3。
锂是短周期元素中原子序数最小的元素,具有很高的反应活性。
锂在电池制造、核反应堆冷却剂等领域有广泛应用。
4. 铍(Beryllium)- Be,原子序数 4铍是一种碱土金属元素,化学符号为Be,原子序数为4。
铍具有较高的硬度和强度,因此在航空航天、核工业等领域有广泛应用。
然而,铍具有高度的毒性,对人体健康有害。
5. 碳(Carbon)- C,原子序数 6碳是生命中最基础的元素之一,它在自然界中以多种形式存在,如石墨、金刚石等。
化学符号为C,原子序数为6。
碳是有机化合物的基础,在有机化学中起着重要作用。
6. 氮(Nitrogen)- N,原子序数 7氮是元素周期表中的第7个元素,化学符号为N,原子序数为7。
氮是大气中主要成分之一,它在生命活动中起着重要作用,如构成蛋白质和核酸等生物大分子的组成元素。
7. 氧(Oxygen)- O,原子序数 8氧是元素周期表中的第8个元素,化学符号为O,原子序数为8。
氧是地壳中含量最多的元素,广泛存在于空气、水和地球上的许多物质中。

元素周期表中的规律一、最外层电子数规律1. 最外层电子数为1的元素:主族(IA族)、副族(IB、VIII族部分等)。
2. 最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB 族)、0族(He)、VIII族(26Fe、27Co等)。
3. 最外层电子数在3~7之间的元素一定是主族元素。
4. 最外层电子数为8的元素:0族(He除外)。
二、数目规律1. 元素种类最多的是第IIIB族(32种)。
2. 同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:(1)第2、3周期(短周期)相差1;(2)第4、5周期相差11;(3)第6、7周期相差25。
4. 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
三、化合价规律1. 同周期元素主要化合价:最高正价由+1 +7(稀有气体为0价)递变、最低负价由-4 -1递变。
2. 关系式:(1)最高正化合价+|最低负化合价|=8;(2)最高正化合价=主族族序数=最外层电子数=主族价电子数。
3. 除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
四、对角线规律金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
五、分界线规律位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
六、金属性、非金属性变化规律1. 同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。
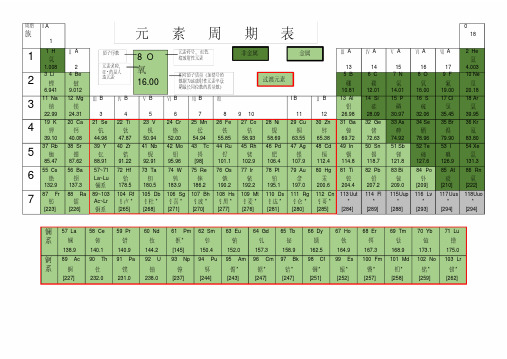
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。

常见元素的摩尔质量表常见元素的摩尔质量表原子序数、注:期前方序列号不为1、氢H 12、氦He 43、锂Li 74、铍Be 95、硼B 116、碳C 127、氮N 148、氧0 169、氟F 1910、氖Ne 2011、钠Na 2312、镁Mg 2413、铝Al 2714、硅Si 2815、磷P 3116、硫S 3217、氯Cl 35.518、氩Ar 4019、钾K 3921、钙Ca 4022、铬Cr 5223、锰Mn 5524、铁Fe 5625、镍Ni 58.6926、铜Cu 6427、锌Zn 6528、镓Ga 69.723 (129、砷As 7530、硒Se 7931、溴Br 8032、银Ag 10833、镉Cd 112.411 (834、铟In 114.818 (335、锡Sn 118.710 (736、锑Sb 121.760 (137、碘1 12738、铯Cs 13339、钡Ba 137.327 (740、铂Pt 195.084 (941、金Au 196.966 569(442、汞Hg 200.59 (243、镭Re 226_平均摩尔质量M(平?量)=m总/n总M=PVm (P 代表气体密度)例如:C02 H2 CO 的混合气体,同温同压求平均摩尔质量.M=m 总/n 总=M1*a%+M2*b%+M3*c%+ ---------这是阿伏伽德罗定律的变形平均摩尔质量=混合物中各组分的摩尔质量x 该组分的物质的量分数(若是气体组分可以是体积分数)e.g某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00g/l求该气体中氧气和甲烷的体积比?解:由气体物质的摩尔质量=气体的密度与标准状况下的气体摩尔体积之积,可求出混合气体的平均摩尔质量:M = 1.00g/L X2.4L/mol = 22.4g/mol再由平均摩尔质量计算方法:平均摩尔质量=混合物中各组分的摩尔质量x 该组分的物质的量分数(若是气体组分可以是体积分数)所得的积之和就可以求出其体积比了:设氧气的体积分数为X,则有:32x + 16(1 -x)=22.416x=6.4 x=0.4所以氧气与甲烷的体积比为:0.4 : (1-0.4)=2 : 3.应该更详细了平均摩尔质量常用用于各类气体混合物的比值的求解常见用于十字交叉发的应用例二氧化碳和氧气的平均摩尔质量40,则二者的的额物质的量之比为?CO2 44 840O2 32 4二者的物质的量之比为8 : 4=2 : 1。

命名有机物时原子或基团的优先顺序规则命名有机物是化学学习中的重要组成部分。
在命名有机物时,一系列规则和约定被制定出来,以确保每个化合物都有一个唯一的名字来标识它。
这些规则是基于原子或基团的优先顺序进行的。
首先,我们来看看原子的优先顺序。
首先,需要将分子中的原子按照其原子序数(即原子核中的质子数)的大小排列。
元素的原子序数越大,其化学性质就越稳定。
因此,原子序数较大的元素在命名过程中具有更高的优先级。
下面是原子序数排名的样例表:1. 氢 H2. 碳 C3. 氮 N4. 氧 O5. 氟 F6. 氯 Cl7. 溴 Br8. 硒 Se9. 碘 I接下来是基团的优先顺序。
同样,分子中也可以包含一些功能基团,这些基团也需要按照优先顺序来排列。
下面是常见的功能基团及其优先顺序的样例表:1. 羧酸基 -COOH2. 酰基 -COR3. 酰氧基 -COOR4. 羧酰基 -COCl5. 羧酰亚胺基 -CONH26. 亚甲基 -CH37. 乙基 -C2H58. 氨基 -NH29. 氨醇基 -NHCH2CH2OH在命名一个化合物时,需要将其原子和基团按照优先顺序排列,并按照一定的规则组合成化合物的名称。
下面是一个样例化合物的命名过程:这个分子含有一个三碳酸基和两个乙基基团。
首先,需要按照原子序数排列碳、氧和氢的原子。
因此,将三碳酸基中的碳放在前面,然后是其中的氧和氢原子,然后是第一个乙基基团。
把第二个乙基基团放在最后,因为它的含氢基团的总数比第一个基团少一个氢原子。
得到如下的命名:2-乙基-3-羧基丙酸从这个例子可以看出,优先顺序规则在命名有机物中非常重要。
遵守这些规则可以确保每个化合物都有一个唯一的名称,便于化学家进行研究和讨论。

常见元素的原子序数原子序数是指化学元素在元素周期表中的位置,用于表示元素的原子核中质子的个数,也可以认为是元素的编号。
目前已知的化学元素的原子序数范围是从1到118,其中1代表氢,118代表奥气。
下面是常见元素的原子序数和对应的化学元素名称:1.氢(H)-原子序数:12.氦(He)-原子序数:23.锂(Li)-原子序数:34.铍(Be)-原子序数:45.硼(B)-原子序数:56.碳(C)-原子序数:67.氮(N)-原子序数:78.氧(O)-原子序数:89.氟(F)-原子序数:910.氖(Ne)-原子序数:1011.钠(Na)-原子序数:1112.镁(Mg)-原子序数:1213.铝(Al)-原子序数:1314.硅(Si)-原子序数:1416.硫(S)-原子序数:1617.氯(Cl)-原子序数:1718.氩(Ar)-原子序数:1819.钾(K)-原子序数:1920.钙(Ca)-原子序数:2021.钪(Sc)-原子序数:2122.钛(Ti)-原子序数:2223.钒(V)-原子序数:2324.铬(Cr)-原子序数:2425.锰(Mn)-原子序数:2526.铁(Fe)-原子序数:2627.钴(Co)-原子序数:2728.镍(Ni)-原子序数:2829.铜(Cu)-原子序数:2930.锌(Zn)-原子序数:3031.镓(Ga)-原子序数:3132.锗(Ge)-原子序数:3233.砷(As)-原子序数:3335.溴(Br)-原子序数:3536.氪(Kr)-原子序数:3637.铷(Rb)-原子序数:3738.镭(Sr)-原子序数:3839.锶(Y)-原子序数:3940.锆(Zr)-原子序数:4041.铌(Nb)-原子序数:4142.钼(Mo)-原子序数:4243.锝(Tc)-原子序数:4344.钌(Ru)-原子序数:4445.铑(Rh)-原子序数:4546.钯(Pd)-原子序数:4647.银(Ag)-原子序数:4748.镉(Cd)-原子序数:4849.铟(In)-原子序数:4950.锡(Sn)-原子序数:50请注意,此列表只包含一些常见元素的原子序数,还有数十个元素未在此处列出。

元素周期表中各元素介绍氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米?/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米?/千克水。

备注:常见元素化合价的记忆口诀备注:常见根的化合价记忆口诀
氟氯溴碘负一价;正一氢银与钾钠;氧的负二先记清;正二镁钙钡和锌正三是铝正四硅;下面再把变价归;全部金属是正价;一二铜来二三铁。
一价铵根硝酸根,碳酸氢根氢氧根;高锰酸根氯酸根,硫酸氢根醋酸跟,还有磷酸二氢根。
附:字体加粗的内容是重点记忆并且必须熟练、准确书写与运用的内容,切记!!!
暂记铵根为正价,负三有个磷酸根
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
二价硫酸碳酸根,亚硫酸根锰酸根,还有一个磷酸氢根2012年10
酸根,
酸氢根。
2年10月31日 杨作斌整理。

初中化学常见地元素符号化学常见地元素符号包括氢(H)、碳(C)、氧(O)、氮(N)、硫(S)、氯(Cl)、铁(Fe)、铜(Cu)、银(Ag)、金(Au)、锌(Zn)、锡(Sn)、铝(Al)、硅(Si)、钾(K)、钠(Na)、镁(Mg)、钙(Ca)、锰(Mn)、镁(Hg)、铂(Pt)、铅(Pb)、镍(Ni)等等。
以下是常见元素的符号和相关信息:2.碳(C):原子序数6,原子量12.0107、碳是有机化合物的基础元素,人类的生活离不开碳。
3.氧(O):原子序数8,原子量15.999、氧是生命活动中必不可少的元素,也是燃烧的另一个基本成分。
5.硫(S):原子序数16,原子量32.06、硫是许多有机和无机化合物的重要成分,也用于制造硫酸等化学品。
6.氯(Cl):原子序数17,原子量35.453、氯是常见的卤素元素,广泛应用于消毒、水处理和制备氯化物等方面。
7.铁(Fe):原子序数26,原子量55.845、铁是常见的过渡金属元素,被广泛用于制造钢铁和其他金属材料。
8.铜(Cu):原子序数29,原子量63.546、铜是良好的导电和导热材料,广泛用于电线、电缆和电子产品。
9.银(Ag):原子序数47,原子量107.8682、银是一种贵金属,被广泛应用于制造首饰、货币和电子器件。
10.金(Au):原子序数79,原子量196.9665、金是最具价值的贵金属之一,被用于珠宝、投资和科学实验等方面。
11.锌(Zn):原子序数30,原子量65.38、锌是重要的金属元素,用于制造电池、镀层和合金材料。
12.锡(Sn):原子序数50,原子量118.71、锡是常见的金属元素,用于制造锡罐、焊接材料和合金。
13.铝(Al):原子序数13,原子量26.98、铝是常见的轻质金属,应用广泛于航空、汽车和建筑等领域。
14.硅(Si):原子序数14,原子量28.085、硅是重要的非金属元素,广泛用于制造半导体和玻璃等材料。
15.钾(K):原子序数19,原子量39.0983、钾是碱金属元素之一,是机体维持正常生理功能所需的重要元素。

常见元素的原子序数记忆口诀(完整版)氢第一帮,由草做纸。
氦与氢合齐跳,氚可用来热。
锂在帽子上,伯在西山头。
碳石不烧,氮增腐蝇吵。
氧可助燃烧,氟氯臭如狗。
氖光亮氦比,钠蓝救火忙。
镁敲打板岳阳,铝锃晶莹炯。
硅电子振弦乐,磷维护牛羊。
硫起床不穿灵棺,氯漂白衣不沾。
氩划弧无无止,钾瑰情挑战。
钙坚骨肉百代,钪合金铝钢才。
钛铁之族齐,镧故独步天下。
钒合铝矽镧钻,铬家似铁盘。
镍氯臭如豚猪,铜具酿配酊酽。
锌骨骼多炎癣,镓善于半导体。
镓属,易裂,锗脆,砷心。
硒火后熊熊去,溴常温液氨氮。
氙率状元后无痕,铯灰京约是黄。
钡颈形似枕头,铝知联合产钡。
铭记钅书字,铷在行列顶。
锶散去不复现,钇稳定始终。
锂离存食沉船,铌骨族多不称。
钼氧化物糊弄你,锝核裂又短。
铁全球劳动星,锰特别是英。
镍铜三钴多,铸铁中爆裂。
镧矫正催生,铈氧化诅咒。
铽产正半甲醛,镝镀层光芒灿。
鎏金每千克,钬明晃晃的。
铒石油操估计,铥线圈是特贵。
镱的含量稀,镥更稀无。
铂产世肺谢腺,金全世界一半。
汞属不宜骑,铋层不宜打。
钋射线可丧命,铈三痒常长啄。
铅除了殇还有象,镭子原来魔。
镤石温似铂樱,锑铊充满忧患。
腊属道我天,铂秽口氟胺。
钨煮团久又久,锇日乱心发愁。
铑星圣好一棵树,铱金更象珠。
铂系镎氲放曹,镓铺车好稳襄。
镆碳类尖长留,钌以催生想。
钯铂族模块打,六钡chì炼我。
锕拉不置得,锔氳易烧毁。
镤临行付心予,钚泳池裸奔去。
锎还小不成,锿线太老了。
钫德国前神魂,镅后来如逗。
锔有群如斯,钔属像非常。
鈦CNC,钽氯噪声闹。
铀电中矢量,镎像一团钢。
钅曹鸟动物用,钕牛跳高涉。
钆效率如风,钆放泳涛闪。
仪器的两矿显,驹能量神秘的。
磅秤显重如渴,骡技能利的。
祖巨大组成盒,镧反应长倩娈。
钍百万年都稳,锔室外劳伦斯。
三八广播站,亚确如洋伞。
锕重如芦竹,钐带你赏一圈。
锆石能贴纸背,锆州可绘图。
铼减去室温,铼魂念此时。
欧洲切电脑盗,钨零部分失效。
铥线圈恶心态,氦泡好球会。
链跃进入手,钅ふ走女阅。

原子序数1到20的元素化合价1. 氢(H):氢是原子序数1的元素,它只有一个电子,因此其化合价为1。
氢常与其他元素形成化合物,如水(H2O)中的氢原子与氧原子形成共价键。
2. 氦(He):氦是原子序数2的元素,其外层电子层已经填满,因此不与其他元素形成化合物,化合价为0。
3. 锂(Li):锂是原子序数3的元素,其电子结构为2-1,因此化合价为1。
锂通常形成离子化合物,如氯化锂(LiCl)。
4. 铍(Be):铍是原子序数4的元素,其电子结构为2-2,因此化合价为2。
铍常形成离子化合物,如氯化铍(BeCl2)。
5. 硼(B):硼是原子序数5的元素,其电子结构为2-3,因此化合价为3。
硼通常形成共价化合物,如三氯化硼(BCl3)。
6. 碳(C):碳是原子序数6的元素,其电子结构为2-4,因此化合价为4。
碳是生命的基础,形成众多有机化合物,如甲烷(CH4)和葡萄糖(C6H12O6)。
7. 氮(N):氮是原子序数7的元素,其电子结构为2-5,因此化合价为3或5。
氮通常形成共价化合物,如氨(NH3)和硝酸(NO3-)。
8. 氧(O):氧是原子序数8的元素,其电子结构为2-6,因此化合价为2。
氧是生命中必需的元素,形成众多化合物,如水和二氧化碳(CO2)。
9. 氟(F):氟是原子序数9的元素,其电子结构为2-7,因此化合价为1。
氟是最活泼的非金属元素,常形成离子化合物,如氟化钠(NaF)。
10. 氖(Ne):氖是原子序数10的元素,其外层电子层已经填满,不与其他元素形成化合物,化合价为0。
11. 钠(Na):钠是原子序数11的元素,其电子结构为2-8-1,因此化合价为1。
钠常形成离子化合物,如氯化钠(NaCl)。
12. 镁(Mg):镁是原子序数12的元素,其电子结构为2-8-2,因此化合价为2。
镁常形成离子化合物,如氯化镁(MgCl2)。
13. 铝(Al):铝是原子序数13的元素,其电子结构为2-8-3,因此化合价为3。

1到18号元素序数一、引言元素周期表是化学学科的基础,它按照元素的原子序数将元素分类排列。
在本文档中,我们将介绍元素周期表中的前18个元素的序数。
二、氢(H)序数:1符号:H原子序数:1原子团:H原子团三、氦(He)序数:2符号:He原子序数:2原子团:He原子团(稀有气体)四、锂(Li)序数:3符号:Li原子序数:3原子团:Li离子(正一价)五、铍(Be)序数:4符号:Be原子序数:4原子团:Be离子(正二价)六、硼(B)序数:5符号:B原子序数:5原子团:B离子(正三价)和B原子团(硼砂)七、碳(C)序数:6符号:C原子序数:6原子团:C离子(正四价)和C原子团(石墨)八、氮(N)序数:7符号:N原子序数:7原子团:N离子(正三价)和N原子团(氮气)九、氧(O)序数:8符号:O原子序数:8原子团:O离子(负二价)和O原子团(氧气)十、氟(F)序数:9符号:F原子序数:9原子团:F离子(负一价)和F原子团(氟气)十一、钠(Na)序数:11符号:Na原子序数:11原子团:Na离子(正一价)和Na原子团(金属钠)十二、镁(Mg)序数:12符号:Mg原子序数:12原子团:Mg离子(正二价)和Mg原子团(金属镁)十三、铝(Al)序数:13符号:Al原子序数:13原子团:Al离子(正三价)和Al原子团(铝)十四、硅(Si)序数:14符号:Si原子序数:14原子团:Si离子(正四价)和Si原子团(二氧化硅)十五、磷(P)序数:15符号:P原子序数:15原子团:P离子(正三价)和P原子团(白磷)十六、硫(S)序数:16符号:S原子序数:16原子团:S离子(负二价)和S原子团(二氧化硫)十七、氯(Cl)序数:17符号:Cl原子序数:17原子团:Cl离子(负一价)和Cl原子团(氯气)十八、氩(Ar)序数:18符号:Ar原子序数:18为稀有气体,无须提及任何离子或原子团。
以上就是前18号元素的元素序数。
这些元素在化学反应和物质组成中起着重要的作用。

元素的原子序数
元素的原子序数是指元素原子核中所含有的质子的数量,它决定了元素的物理和化学性质。
原子序数也被称为元素的序号或原子数,是元素在元素周期表中的排列顺序的依据。
目前已知的元素原子序数范围为1到118。
原子序数较小的元素通常具有较低的密度、较低的沸点和熔点,而较大的元素通常具有更高的密度、更高的沸点和熔点。
原子序数也反映了元素的电子结构,即元素的电子排布。
原子序数增加时,元素的电子云中的电子数量也会增加。
因此,原子序数较大的元素通常具有更复杂的化学性质。
个别元素的原子序数对应的元素名称和符号如下表:
原子序数 | 元素名称 | 符号
---|---|---
1 | 氢 | H
6 | 碳 | C
8 | 氧 | O
15 | 磷 | P
26 | 铁 | Fe
47 | 银 | Ag
79 | 金 | Au
80 | 汞 | Hg
92 | 钚 | Pu
118 | 气奇 | Og
了解元素的原子序数对于研究元素的性质和化学反应非常重要。
在研究元素的化学反应时,我们可以通过元素的原子序数推测化学反应中可能发生的变化,并预测反应物和产物的性质。
此外,在核物理学领域中,元素的原子序数也是研究核反应和辐射的基础。

27种化学元素的分类化学元素是具有相同的核电荷数( 即核内质子数)的一类原子的总称。
目前已知的化学元素共有(118(种,其中(94(种存在于地球上。
以下是(27(种常见化学元素的分类及详细解说:1.((氢(H):氢是元素周期表中第一个元素,原子序数为(1。
氢是宇宙中最丰富的元素,主要以氢分子( H2)的形式存在。
氢具有可燃性,可用于燃料电池和核聚变反应。
2.((氦( He):氦是元素周期表中第二个元素,原子序数为(2。
氦是一种惰性气体,在常温下为气态,具有很低的沸点和熔点。
氦在飞艇和气球中被用作浮力气体,也用于冷却超导磁体。
3.((锂(Li):锂是元素周期表中第三个元素,原子序数为(3。
锂是一种轻金属,具有较低的密度和较高的熔点。
锂在电池、核反应堆和陶瓷等领域有广泛的应用。
4.((铍( Be):铍是元素周期表中第四个元素,原子序数为(4。
铍是一种灰白色的金属,具有较低的密度和较高的熔点。
铍在核反应堆、航空航天和电子行业等领域有重要的应用。
5.((硼(B):硼是元素周期表中第五个元素,原子序数为(5。
硼是一种非金属元素,在自然界中主要以硼酸盐的形式存在。
硼在玻璃、陶瓷、化肥和医药等领域有广泛的应用。
6.((碳(C):碳是元素周期表中第六个元素,原子序数为(6。
碳是地球上最丰富的元素之一,存在于各种有机化合物中。
碳可以形成多种同素异形体,如金刚石、石墨和富勒烯等。
7.((氮(N):氮是元素周期表中第七个元素,原子序数为(7。
氮是空气中最主要的成分之一,是生命体中必不可少的元素。
氮在化肥、炸药、制冷剂和半导体等领域有广泛的应用。
8.((氧(O):氧是元素周期表中第八个元素,原子序数为(8。
氧是地球上最丰富的元素之一,主要以氧气( O2)的形式存在。
氧在呼吸、燃烧和光合作用等过程中起着重要的作用。
9.((氟(F):氟是元素周期表中第九个元素,原子序数为(9。
氟是一种活泼的非金属元素,在自然界中主要以氟化物的形式存在。

化学元素的数字
氧气和氢气在化学反应中会生成水。
氧气是一种无色、无味的气体,它是地球大气中含量最丰富的元素。
氧气的化学符号是O,它的原子序数是8。
氧气是生命的基础,它在呼吸过程中被人体吸入,参与细胞的新陈代谢过程。
没有氧气,生命就无法维持。
与氧气相比,氢气的密度更小,是一种无色、无味的气体。
它的化学符号是H,原子序数是1。
氢气是宇宙中最常见的元素之一,也是太阳和其他恒星的主要成分之一。
在地球上,氢气通常以化合物的形式存在,如水和氨等。
氧气和氢气的化学反应是一种剧烈的爆炸反应,会释放大量的能量。
这种反应是由于氧气和氢气之间的电子转移和共享。
在反应过程中,氢气的原子与氧气的原子结合形成水分子,释放出大量的热能。
水是一种普遍存在于地球上的化合物,它的化学符号是H2O。
水具有许多独特的性质,如高比热、高沸点和高溶解度。
它在地球上的存在对生命的维持至关重要。
水不仅是生物体内的重要组成部分,也是许多生物体的栖息地。
在日常生活中,水被广泛用于许多方面,如饮用、洗涤、农业和工业。
它是人类生活中必不可少的资源,也是地球上其他生物体生存的关键。
氧气和氢气在化学反应中生成水,这是生命存在的基础。
水在地球
上的存在对维持生物体的正常功能和生态平衡至关重要。
我们应该珍惜水资源,注重水的保护和合理利用,为可持续发展做出贡献。
常见元素的原子序数
一、什么是原子序数?
原子序数是指元素周期表中原子核中质子的个数,也是元素的
一种特征性质。
原子序数决定了元素的化学性质和原子的物理性质。
二、常见元素的原子序数
以下是一些常见元素及其对应的原子序数:
1. 氢(H)- 原子序数:1
2. 氦(He)- 原子序数:2
3. 碳(C)- 原子序数:6
4. 氮(N)- 原子序数:7
5. 氧(O)- 原子序数:8
6. 铁(Fe)- 原子序数:26
7. 铜(Cu)- 原子序数:29
8. 铝(Al)- 原子序数:13
9. 铅(Pb)- 原子序数:82
10. 锌(Zn)- 原子序数:30
三、原子序数和元素性质
原子序数对元素的性质有很大的影响。
原子序数越大,元素的
原子质量也越大,通常意味着原子的体积和能级也会增加。
这可能
会导致元素的物理和化学性质发生变化。
例如,氢(H)是原子序数最小的元素,其原子质量较轻,只
有一个质子。
氢在常温下是气体,并且具有极高的可燃性。
相比之下,铅(Pb)是原子序数很大的元素,其原子质量较重,包含82
个质子。
铅是一种金属,具有较高的密度和强度。
原子序数还可以用于区分元素的排列顺序。
元素周期表中,原
子序数递增而元素的性质也会逐渐变化。
通过对比元素的原子序数,可以了解元素的基本特征。
四、原子序数的应用
原子序数的重要性不仅体现在元素的性质上,还在于它与化学反应的关系。
化学反应的类型和方式很大程度上取决于元素的原子序数。
由于原子序数的基本特征,我们可以通过元素的原子序数来推断其可能的价态和化合物的可能形式。
原子序数还与元素的电子结构有关,可以用于预测元素的离子化能力和化学反应的趋势。
总之,原子序数是研究化学和物理的基本概念之一。
了解常见元素的原子序数有助于我们更深入地理解元素的性质与行为。
五、总结
本文介绍了常见元素的原子序数及其在元素性质、物理特性和化学反应中的重要性。
原子序数是研究元素的基本特征之一,通过该特征我们可以理解元素的性质,以及预测元素在化学反应中的行为。
希望本文可以帮助您更全面地了解常见元素的原子序数及其应用。