答:生成铜的质量12.8g;c(FeSO4)是2mol/L。
例2.恒温恒压的密闭容中,合成塔中:N2(g)+3H2(g) 2NH3(g)反应达到平衡,测得平衡混合气体中NH3的体积 分数为25%,计算平衡时与起始时气体的体积比__4_:5__。
解析:设平衡混合气体的体积为100L,其中NH325L
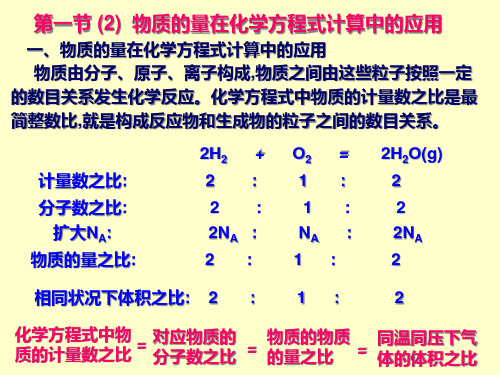
左右对应(比例)。→正比例关系。 4.列出已知量和未知量比例式或列出方程式或方程组,利用数学方 法解出答案。
5.答。把求解的结论完整表达出来。
解→设未知数→写方程式→列出关系量→列比例式 →解比例式→ 答。
三、根据化学方程式的计算类型和方法
①简单计算(关系式法): 已知一种反应物或者生成物的量计算其他反应物或者生成
①计算生成Cu的质量。
②假若反应后溶液的体积是0.1L,计算FeSO4的物质的量浓度。
解:设生成Cu的质量为xg,生成FeSO4ymol。
CuSO4+Fe=FeSO4+ Cu
△m增加
56g 1mol 64g
8g
ymol xg
1.6g
列比例式并求解得:y=0.2mol x=12.8g
c(FeSO4)=0.2mol/0.1L=2mol/L
2mol
y=0.1mol
2.24L xg
ymol
44.8/2.24=32/x x=1.6g 答:标准状况下与2.24L氢气反应的O2是1.6g,生成水0.1mol。
例2. 6.0gCaO、Ca(OH)2、CaCO3的混合物,恰好溶解于100mL 2mol/L盐酸,然后稀释至1L,计算稀释后溶质的物质的量浓度。
(这里的“份”可以是g、kg、t等)。
d.2mol氢气和1mol氧气化合生成2mol水。 e.2个氢气分子和1个氧气分子化合生成2个水分子。