循环伏安法与线性扫描伏安法
- 格式:doc
- 大小:94.50 KB
- 文档页数:7

伏安法根据线性扫描伏安法与循环伏安法的基本原理, 采用电化学中典型的K3 [ Fe(CN) 6 ] 电化学可逆系统设计了线性扫描伏安法与循环伏安法实验。
作为应用化学专业高年级学生和研究生学习电化学课程的实验, 收到了非常好的教学效果。
1伏安法:电化学是研究两类导体形成的带电界面现象及其上所发生的变化的科学。
如今已形成了合成电化学、量子电化学、半导体电化学、有机导体电化学、光谱电化学、生物电化学等多个分支。
电化学在化工、冶金、机械、电子、航空、航天、轻工、仪表、医学、材料、能源、金属腐蚀与防护、环境科学等科技领域获得了广泛的应用。
当前世界上十分关注的研究课题, 如能源、材料、环境保护、生命科学等等都与电化学以各种各样的方式关联在一起。
电化学实验技术也在不断的发展, 随着微电子技术和计算机技术的迅猛发展, 线性扫描伏安法和循环伏安法、交流阻抗法和一系列更复杂灵巧的极化程序控制方法已在很大程度上取代了经典极化曲线测量和极谱方法[ 1 - 2 ] 。
本文在参考国内外有关电化学线性扫描伏安法与循环伏安法的基础上[ 3 - 4 ] , 进行了广泛的探索,采用电化学中典型的K3 [ Fe (CN) 6 ] 电化学可逆系统设计了线性扫描伏安法与循环伏安法实验, 得到了适合应用化学专业高年级学生和研究生实验教学的综合研究性实验方案。
教学效果表明, 该实验采用计算机控制的综合电化学测试仪, 实验参数容易控制, 数据测量准确, 实验结果便于计算机处理。
学生通过对实验数据的处理, 自己得出电化学可逆体系的诊断标准, 使学生通过这个综合性研究实验, 加深了对线性扫描伏安法与循环伏安法的特点和基本原理的理解, 掌握线性扫描伏安法的定量分析方法, 熟悉循环伏安法在研究电极机理方面的应用从而达到掌握线性扫描伏安法和循环伏安法实验技术的实验目的。
使用表面静止的液体或固体电极,称为伏安法。
循环伏安法(Cyclic V oltammetry)。

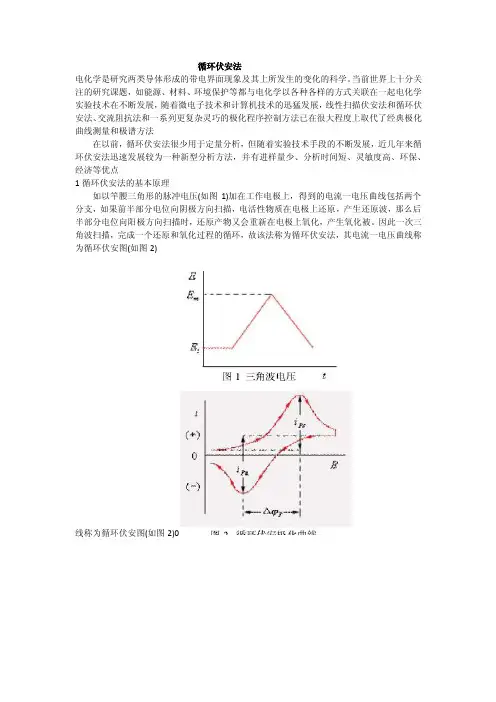
循环伏安法电化学是研究两类导体形成的带电界面现象及其上所发生的变化的科学。
当前世界上十分关注的研究课题,如能源、材料、环境保护等都与电化学以各种各样的方式关联在一起电化学实验技术在不断发展,随着微电子技术和计算机技术的迅猛发展,线性扫描伏安法和循环伏安法、交流阻抗法和一系列更复杂灵巧的极化程序控制方法已在很大程度上取代了经典极化曲线测量和极谱方法在以前,循环伏安法很少用于定量分析,但随着实验技术手段的不断发展,近几年来循环伏安法迅速发展较为一种新型分析方法,并有进样量少、分析时间短、灵敏度高、环保、经济等优点1循环伏安法的基本原理如以竿腰三角形的脉冲电压(如图1)加在工作电极上,得到的电流一电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化被。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流一电压曲线称为循环伏安图(如图2)线称为循环伏安图(如图2)0三电极系统三电极电化学传感器通过在工作电极和参比电极间加控制电压,在工作电极表而产生电流信号,该电流信号与被测物质浓度具有一定的关系,分析该电流信号就可以算出被测物的浓度实际进行信号处理时,需要在工作电极和参比电极间加一个恒定电位,以维持传感器的电化学稳定性,使其能稳定地输出模拟信号。
因此,恒电位仪是电化学传感器不可缺少的设备恒电位仪的原理三电极电化学传感器包含工作电极(W E),参比电极(RED和辅助电极(AE)o WE的作是在电极表而产生化学反应; RE在没有电流通过的前提下,用来维持工作电极与参比电极间电压的恒定;AE用来输出反应产生的电流信号,由测量电路实现信号的转换和放大如果直接在工作电极和参比电极间加电压,在电压的作用下,工作电极表而产生化学反应。
由于此时工作电极和参比电极间形成回路,反应所产生的电流将通过参比电极输出,随着反应电流的变化,工作电极和参比电极间的电压也会发生改变,无法保持恒定。

循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。

在这一节中,将引入两个紧密相关的伏安形式* 线性扫描伏安法* 循环伏安法我们将看到如何进行这些测量以研究电极反应的电子传递机理和传输特性。
一、线性扫描线性扫描伏安法在线性扫描伏安(LSV)中,施加一个电位范围,非常类似于电位阶跃测量。
然而在LSV 中,电位从低限扫描到高限,如下图所示。
电压扫描速度 (v) 从直线的斜率计算,显然,改变扫描范围所用的时间,就可以改变扫描速度。
记录的线性扫描伏安的特性取决于下列因素:(1)、电子传递反应的速度;(2)、电活性粒子的化学反应(3)、电压扫描速度;在LSV测量中,电流响应被作图为电压的函数,而不是时间的函数,这与电位阶跃不同。
例如,如果我们回到Fe3+/Fe2+ 系统随后可以看到一个用只包含单Fe3+的电解液进行的单电压扫描的伏安图。
扫描从电流/电压图的左侧开始,这里没有电流。
当电压向右扫描时(向更加还原值),开始出现电流,最终在下降之前达到一个峰值。
为了理解这个行为,我们需要考虑电压对建立于电极表面的平衡的影响。
如果我们考虑Fe3+到Fe2+的还原,电子传递速度与电压扫描速度相比要快!因此,在电极表面,一个平衡被建立,与热力学预测的相同。
可以从平衡电化学回忆起Nernst方程预测的浓度和电压(电位差)之间的关系,这里E为施加电位差,Eo为标准电极电位。
所以,当电压从V1扫描V2到时,平衡位置从电极表面反应物没有转换的V1移动到全转换的V2 。
伏安行为的确切形式可以通过考虑电压和物质传递效应来理解。
当电位从V1开始扫描时,表面平衡开始改变,电流开始出现:随着电压从初始值继续扫描,电流在增加;平衡位置继续向右移动,有更多的反应物被转换。
峰值出现了,由于在某些点上,电极上部的扩散层已经足够增长,所以向电极方向的反应物流量速度已经不能满足Nernst方程的要求。
在这种情况下,电流开始下降,正如在电位阶跃测量中一样。
事实上,电流的下降服从Cottrell方程所预测的相同行为。

山西大学综合化学实验报告实验名称电化学分析方法学院化学化工学院学生姓名霍雨深蒋康利专业化学学号 2012296013 2012296014 年级 2012级指导教师高春光二Ο一五年四月七日摘要:本实验通过对K3[Fe(CN)6]进行快速循环伏安扫描和线性扫描,了解并掌握利用循环伏安法判定电极的可逆性,扫描速度和浓度对循环伏安图的影响,以及线性扫描中极限峰电流与活性组分浓度关系,掌握循环伏安法于线性扫描法的参数设置。
关键词:循环伏安法,线性伏安扫描法,铁氰化钾溶液,电化学分析1引言:电化学分析方法是仪器分析的一个重要分支,是建立在溶液电化学性质基础上的一类分析方法,或者说利用物质在溶液中的电化学性质及其变化规律分析的一类方法。
电化学性质是指溶液的电学性质(如电导、电量、电流、电位等)与化学性质(如溶液的化学的组成、浓度、形成及其化学变化等)之间的关系。
㈠循环伏安法循环伏安法是一种特殊的氧化还原分析方法。
其特殊性主要表现在实验的工作环境是在三电极电解池里进行。
w为工作电极(即绿色的夹子接铜电极),s为参比电极(即黄色的夹子接饱和氯化钾电极),a为辅助电极(即红色的夹子接铂电极)。
当加一快速变化的电压信号于电解池上,工作电极电位达到开关电位时,将扫描方向反向,所得到的电流-电位(I-E)曲线,称为循环伏安曲线,同样有峰电流ip和峰电位Ep,ip、Ep的表达式也分别相同。
对于可逆电极反应ip=6.25×105n3/2D1/2v1/2Ac 其中:ip为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),v 为扫描速度(V/s),c为浓度(mol/L)。
由此可见,ip与v1/2和c都是直线关系。
由于Da和Dc大致相同,对于可逆电极反应ipa/ ipc ≈1铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e-= [Fe(CN)6]4-φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst方程式为φ=φθ’+ RT/Fln(C Ox/C Red)在一定扫描速率下,从起始电位(0.110V)正向扫描到转折电位(0.181V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(0.181V)变到原起始电位(0.110V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。




实验五线性扫描伏安法和循环扫描伏安法一.实验目的1、了解线性扫描伏安法和循环扫描伏安法的特点和基本原理。
2、掌握线性扫描伏安法的定量分析方法。
、3、了解循环扫描伏安法在研究电极机理方面的应用。
二、基本原理1、线性扫描伏安法线性扫描伏安法是在电极上施加一个线性变化的电压,即电极电位是随外加电压线性变化记录工作电极上的电解电流的方法。
记录的电流随电极电位变化的曲线称为线性扫描伏安图。
可逆电极反应的峰电流可由下式表示:Ip=0.4463nFADo1/2Co*(n F v/RT)1/2=5.99*105n3/2Ado1/2v1/2Co*(1)式中n为电子交换数,A为电极有效面积,Do为反应物的扩散数,v为电位扫描速度,Co*为反应物(氧化态)的本体浓度。
也可简化为(A不变时)ip=kv1/2Co* (2)即峰电流与扫描速度的1/2次方成正比,与反应物的本体浓度成正比。
这就是线性扫描伏安法定量分析的依据。
对于可逆电极反应,峰电位与扫描速度无关,Ep=E1/2±1.1RT/nF (3)但当电位反应为不可逆时(准可逆或完全不可逆)。
Ep随扫描速度增大而负(正)移。
2、循环伏安法循环伏安法的原理同线性扫描伏安法相同,该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
只是比线性扫描伏安法多了一个回归。
所以称为循环伏安法。
循环伏安法是电化学方法中最常用的实验技术。
循环伏安法有两个重要的实验参数,一个峰电位之比,二是峰电位之差。
对于可逆电极反应,峰电流之比iPc/ipa的绝对值约等于1。
峰电流之差约为59.6mv(25℃)。
△Ep=2.22RT/nF (4)三.仪器和试剂1.电化学分析系统2.三电极系统:玻碳电级为工作电极,Ag/Agcl电极为参比电极,铂钛电极为对极。
3.1.0×10-3mol/L铁氰化钾溶液四.实验步骤1.选择仪器实验方法:电位扫描技术——线性扫描伏安法或循环伏安法。

循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为Faraday 常数(96485 C.molmnFidtQt==∫0-1)。
如图3的CV 图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μC/cm 2。
阶梯和线性扫描伏安法的比较有价值的替代:循环伏安法中的模拟电流积分循环伏安法中的阶梯法广泛应用于基于数字微处理器的仪器,因为使用数字电子仪器产生不连续的阶梯比真正的线性扫描要容易。
此外,如果阶梯时间足够长,双电层对电流的贡献或充电电流会减小。
这样的数据被认为只会从法拉第反应产生。
Autolab电化学仪器和软件通常使用阶梯法进行循环伏安测量,也可以选择SCANGEN模块进行真线性扫描伏安测量。
图1表示一个阶梯波试验的例子。
电流测量的时刻(由α值确定)可以定义。
α=0.25时,电流自阶梯的1/4处取样;α=1时,电流自阶梯的终点取样,等等。
为改进信号噪音比,电流取样在一个特定的间隔内进行,如果可能在净循环(20或16.6ms)。
图1:阶梯波循环伏安法,α值指示取样时刻.当研究动力学过程时,阶梯和线性扫描方法的区别被认为并不大。
M. Seralthan和R.A. Osteryang(J.Electroanal.Chem.222,69(1987))对常规阶梯伏安和线性扫描伏安进行了理论比较。
他们指出,如果在阶梯的适当时刻测量电流,可以得到相近的结果。
对于一个可逆系统,电流应该在整个阶梯时间的1/4处取样。
因此,对那些有关电化学动力学的研究,阶梯伏安是一个替代(真正)线性扫描伏安的好方法。
对于个别时间相关的过程,如:欠电位沉积(UDP),双电层效应和铂电极的氢吸收,情况就不相同。
在这些条件下,上面描述的(常规)阶梯法失效。
这是由于这些现象发生在阶梯的开始,而且在电流取样时已经消失。
Autolab仪器和软件也提供一个记录这些快速现象的阶梯方法。
在这种方法中,采用内置模拟电流积分器的μAutolab恒电位仪,PGSTAT10恒电位仪和FI20模块。
积分器在每个阶梯开始时重新设置。
然后,积分的电流或电量在每个阶梯的终点取样。
电量除以阶梯时间就可以得到(假)电流。
在采用电流积分方法测量假电流时,重要的是知道积分法和线性扫描法的区别。
脉冲技术实验八水中铅、镉离子的电化学检测一、实验目的1、学会用脉冲技术测定微量离子的方法;2、熟悉电化学工作站的使用方法一、实验原理差分脉冲极谱法又称为微分脉冲极谱法,它施加于电化学池的电压和时序关系如图所示。
(a)(b)工作电极的电位首先保持在E i,维持τ`秒,此时不发生电极反应,没有法拉第电流流过。
在τ`秒时,电极电位突然阶跃至E值,维持40—60ms。
在加脉冲期间,在脉冲末期一预定时刻τ开始记录通过电化学池的电流。
脉冲结束时工作电极电位又回复到起始电位,开始下一个脉冲周期。
每个周期的电极电位保持在E i的时间及加脉冲的时间,采样电流的时间和脉冲结束的时间完全相同,仅脉冲电压较前一周期增加△EmV。
记录电流的方法有两种,一是在加脉冲后的预定时刻τ至脉冲结束前的一极短时间间隔内记录电流的积分值,由此称为积分极谱。
二是加脉冲后的时间τ的电流和加脉冲前瞬间(τ`)的电流的差值。
LK2006A 型记录电流的方式为后者。
二、仪器与试剂仪器LK2006A电化学工作站(天津兰力科化学电子高技术有限公司);三电极体系:工作电极为银基汞膜电极或已镀好汞膜的玻碳电极,参比电极为饱和甘汞电极,对电极为铂片电极。
试剂 1.00×10-3 mol·L-1Cd2+标准溶液,1.00×10-3 mol·L-1Pb2+标准溶液,4mol·L-1盐酸。
四、实验步骤1、汞膜电极用湿滤纸沾去污粉擦净电极(银丝)表面,用蒸馏水冲洗后浸入1:1HNO3中,待表面刚变白后立即用蒸馏水冲洗并沾汞。
初次沾汞往往浸润性不良,可用干滤纸将沾有少许汞的电极表面擦匀擦亮,再用1:1HNO3把此汞膜溶解,蒸馏水洗净后重新涂汞膜。
每次沾涂一滴汞(约4~5mg),涂汞需在Na2SO3除O2的氨水中进行。
新制备的汞膜电极应在0.1mol/L KCl(Na2SO3除O2)中于-1.8V(vs.Ag/AgCl电极)阴极化并正向扫描至-0.2V,如此反复扫描3次左右后电极便可使用。
电化学工作站简介电化学工作站在电池检测中占有重要电位,它将恒电位仪、恒电流仪和电化学交流阻抗分析仪有机的结合,既可以做三种基本的常规实验,也可以做基于这三种基本功能的程式化实验。
在实验中,既能检测电池电压、电流、容量等基本参数,又能检测体现电池反应机理的交流阻抗参数,从而完成对多种状态下电池参数的跟踪和分析。
基本简介电化学工作站(Electrochemical workstation)是电化学测量系统的简称,是电化学研究和教学常用的测量设备。
将这种测量系统组成一台整机,内含快速数字信号发生器、高速数据采集系统、电位电流信号滤波器、多级信号增益、IR 降补偿电路以及恒电位仪、恒电流仪。
可直接用于超微电极上的稳态电流测量。
如果与微电流放大器及屏蔽箱连接,可测量1pA或更低的电流。
如果与大电流放大器连接,电流范围可拓宽为±2A。
某些实验方法的时间尺度的数量级可达l0倍,动态范围极为宽广。
可进行循环伏安法、交流阻抗法、交流伏安法等测量。
工作站可以同时进行四电极的工作方式。
四电极可用于液/液界面电化学测量,对于大电流或低阻抗电解池(例如电池)也十分重要,可消除由于电缆和接触电阻引起的测量误差。
仪器还有外部信号输入通道,可在记录电化学信号的同时记录外部输入的电压信号,例如光谱信号等。
这对光谱电化学等实验极为方便。
基本分类电化学工作站主要有2大类,单通道工作站和多通道工作站,区别在于多通道工作站可以同时进行多个样品测试,较单通道工作站有更高的测试效率,适合大规模研发测试需要,可以显著的加快研发速度。
电化学工作站已经是商品化的产品,不同厂商提供的不同型号的产品具有不同的电化学测量技术和功能,但基本的硬件参数指标和软件性能是相同的。
电化学是研究电和化学反应相互关系的科学。
电和化学反应相互作用可通过电池来完成,也可利用高压静电放电来实现,二者统称电化学,后者为电化学的一个分支,称放电化学。
因而电化学往往专指“电池的科学”。
循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。
循环伏安法原理:循环伏安法(CV)是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63-在电极上还原,反应为:Fe(CN)63-+e-→Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64--e-→Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
图2 氧化还原cv曲线图图1 cv图中电势~时间关系如通过对未知研究体系的CV研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday定律估算,, 其中m为反应的摩尔量, n为电极反应中的得失电子数,F为图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。
如图3的CV图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μC/cm2。
由于氢在铂上只能吸附一层,通过实验得到的吸附电量可以推算实验中所用的电极的真实面积。
若电化学过程不只涉及一层物种的反应,如Ag在Pt上的沉积,见图3,通过积分沉积的Ag的溶出电量,以及Ag的晶格参数可以估算电极上沉积的银的层数。
通过改变CV实验中的扫描速度,根据实验中得到的Ip, ΔEp, Ep/2,Ep, ,值,判断电极过程的可逆性。
25°C下,针对反应可逆性的不同,将具有以下特征(以一个还原反应通过改变CV实验中的扫描速度,根据实验中得到的Ip, ΔEp, Ep/2,Ep, ,值实验方法:氧化还原体系的循环伏安法测定可以按下列步骤进行:(1)选择好溶剂,支持电解质、研究电极、参比电极、辅助电极。
(2)配好电解液,接好电极测定回路。
(3)通氮气约30分钟,除去溶解氧后停止通气,让电解液恢复静止状态。
(4)定好电位测定幅度和扫描速度。
(5)进行测定。
以一定条件下Fe(CN)63-/4-体系为例:1.工作电极预处理:金盘电极、石墨电极分别作为测定Fe(CN)63-/4-工作电极,工作电极使用前在细砂纸上轻轻打磨至光亮。
2. 溶液配制3.循环伏安法测量(1)电化学分析系统,选择循环伏安法。
(2).设置实验参数:灵敏度:20μA 初始电位:+0.600 V滤波参数:10Hz 终止电位:-0.200V放大倍数:1 扫描1.0 mV循环次数:1 扫描速度按实验要求选择。
(3).将配制的系列铁氰化钾和亚铁氰化钾溶液逐一转移至电解池中(已通过氮气,除过氧气的),插入冲洗干净的金盘电极(工作电极)、铂丝电极(辅助电极)及Ag/AgCl参比电极。
夹好电极夹。
以50mV/S的扫描速度记录循环伏安图并存盘。
(4). 用一定浓度铁氰化钾和亚铁氰化钾溶液,分别记录扫描速度为5 mV/S、10mV/S、20mV/S、50mV/S、100mV/S、200mV/S的循环伏安图并存盘。
在完成每一次扫速的测定后,要轻轻摇动一下电解池,使电极附近溶液恢复至初始条件。
数据处理:1. 列表总结Fe(CN)63-/4-的测量结果(E pa ,E pc,ΔE p, i pa, i pc)。
2. 绘制Fe(CN)63-/4-的i pc和i pa与相应浓度C的关系曲线;绘制i pc和i pa与相应υ1/2的关系曲线。
3.求算Fe(CN)63-/4-电极反应的n和E0ˊ。
对于符合Nernst方程的可逆电极反应,在25℃时i p.a / i p.c ≈1在循环伏安法中,阳极峰电流iPa,阴极峰电流i PC,阳极峰电势E Pa,阴极峰电势E PC,以及i pa/i pc ,ΔEp(E pa- E pc)是最为重要的参数。
对于一个可逆过程:ΔEp = E Pa - E PC≈(57~63)/n mV (25℃)一般情况下, ΔEP约为58/n mV (25℃)正向扫描的峰电流ip为:i p = 2.69×105n3/2AD1/2υ1/2C式中各参数的意义为:i p:峰电流(安培);n:电子转移数;A:电极面积(cm2);D :扩散系数(cm2/s);υ:V/s;C:浓度(mol·L-1)。
从ip的表达式看:ip与υ1/2和C都呈线性关系,对研究电极过程具有重要意义。
标准电极电势为:E0 =( E Pa+E Pc)/2所以对可逆过程,循环伏安法是一个方便的测量标准电极电位的方法。
表1 可逆性的判据可逆体系循环伏安法特点:1.i P与本体溶液浓度C成正比。
2.i P与v1/2成正比,扫描速度越快,流过的i P越大。
和使用汞电极的极谱分析法中的极限电流i P相比,i P≈8.7v1/2 i l 。
所以当v=1V/s时,用循环伏安法可以得到大约大十倍左右的电流值。
3.E P与v和C无关,是一定值,偏离E1/2仅28.50/n[mV]。
4.i P与电极的面积A和扩散系数的平方根D1/2成正比。
5.i P与反应电子系数n3/2成正比(极谱分析和旋转圆盘电极中i正比于n)非可逆体系的循环伏安法特点:1. 峰电流i p = 299(αn α)1/2AD 1/2υ1/2C (25℃)可知i p 正比于C (和可逆体系一样)。
i p 与电位扫描速度υ1/2成正比。
(和可逆体系一样)。
如果n 、D 、A 等已知,可以通过上式求出αn α2. 峰电位ΔEp=])ln()ln(780.0[2/12/12/1RTF n D n RT E S υακααα++- =E P/2-Ep=(1.857RT )/αn αF=47.7/αn α[mv](25℃)可知Ep 的大小与扫描速度有关。
当进行还原反应时,Ep 越大越向负电位方向偏移。
在25℃时,αn α=1时,扫描速度υ增大10倍,E P 往负方向的偏移大约30mV 。
Κs 越小,E P 和E 1/2的偏差越大。
Ep - E P/2的差与υ和C 无关。
υ一定时,Ep 与C 无关。
3. αn α可以按i p =299(αn α)1/2AD 1/2υ1/2C 求得,以i p 对υ1/2作图。
αn α和Κs 可以改变υ(在三个数量级的范围内),求出i p 和E P 以下式logi p 和E P 作图)](exp[10227.02/13E E RTF n nFAC i p s p -⨯=-αακ从直线截距可以求出Κs ,从斜率可以求出αn线性扫描伏安法原理:线性扫描伏安法是在电极上施加一个线性变化的电压, 即电极电位是随外加电压线性变化记录工作电极上的电解电流的方法。
记录的电流随电极电位变化的曲线称为线性扫描伏安图,如图1。
可逆电极反应的峰电流如下:ip= 0.4463nFAD O1 /2 Co*( nF v /R T ) 1 /2= 2.69×105 n3 /2AD O1 /2v1 /2 Co* (1)不可逆过程ip=2.99×105 nA(αnα)1/2D O1 /2v1 /2 Co* (2)式中, n为电子交换数; A为电极有效面积; Do 为反应物的扩散系数; v为电位扫描速度; Co*为反应物(氧化态) 的本体浓度。
当电极的有效面积A不变时, 式(1) 也可以简化为:ip = k v1 /2 Co* (3)即峰电流与电位扫描速度v的1 /2次方成正比, 与反应物的本体浓度成正比。
这就是线性扫描伏安法定量分析的依据。
对于可逆电极反应, 峰电位与扫描速度无关,Ep = E1 /2±1.1RT / nF(4)可逆反映还有以下特点:1.当n=1时,对于可逆的电流峰的电位值只比平衡电位正28.5mV(可用于定性分析)2.电流的峰值可用于定量分析。
3.电流的上升非常快,n=1时从电流峰值的10%上升到电流峰值时的电位变化幅度为100mV。
但当电极反应为不可逆时(准可逆或完全不可逆) , 峰电位Ep 随扫描速度v增大而负(或正) 移。
电极表面上还原物的浓度受到电极电位的变化和扩散层的增大等因素的影响,随着扫描的进行电流急剧上升,属于前一种影响,而过了波峰,电流开始减少,则属于后一种原因。
由式(1)和(2)可见,不管电极反应是否可逆,ip都与Co*呈正比,这是线性扫描伏安法定量分析的依据。
图1中Ep与电活性物质的支持电解质有关,是定性分析的依据。
线性扫描伏安法可测定电活性物质的最佳浓度范围为10-2-0-4mol/L。
式(1)和(2)还表明,ip正比于v1 /2,随着v的增大ip增大,分析灵敏度提高。
但是对于不可逆电极过程,由于电极反应速度慢,在快速扫描时电极反应的速度跟不上极化速度,伏安曲线将不出现电流峰,应此应选用较慢的电位扫描速度。
如有侵权请联系告知删除,感谢你们的配合!。