晶体的类型与性质
- 格式:ppt
- 大小:881.50 KB
- 文档页数:20

化学晶体知识点总结一、晶体的概念晶体是由晶格和晶格点组成的,晶格是晶体由周期性点阵构成的三维空间有序排列而成的规则结构。
晶格点是晶体中原子、分子或离子的位置。
晶体是由晶格点和晶格构成的,在空间中呈规则有序排列的固体。
二、晶体的分类根据晶体的结构和性质,晶体可以分为分子晶体、离子晶体、原子晶体、共价晶体等几种类型。
1. 分子晶体分子晶体是由分子形成的晶体,分子之间通过范德华力进行相互作用。
例如,冰、蓝晶石等。
2. 离子晶体离子晶体是由正负离子形成的晶体,通过静电力进行相互作用。
例如,氯化钠、氧化钙等。
3. 原子晶体原子晶体是由原子形成的晶体,原子之间通过金属键或者共价键进行相互作用。
例如,金属晶体、石墨等。
4. 共价晶体共价晶体是由原子通过共价键形成的晶体,共价键的方向性导致晶体的各项异性,在晶体结构中原子间存在共用电子对。
例如,硅、金刚石等。
三、晶体的结构晶体结构是指晶体中原子、离子或分子的排列方式。
晶体结构分为立方晶系、四方晶系、正交晶系、六角晶系、单斜晶系、三斜晶系六种晶格系统。
四、晶体的性质1. 光学性质晶体在光学上的行为叫做光学性能。
晶体的光学性质是由其晶格的结构和原子排列决定的,包括吸收光能、产生衍射等性质。
2. 热学性质晶体的热学性质是指晶体在高温下的行为,如热膨胀、热导率、热容等。
3. 电学性质晶体在电场中的行为称为电学性能,包括电导率、介电常数、压电效应等。
五、晶体生长晶体生长是指晶体在固相状态下生长的过程。
晶体生长过程包括平衡生长和非平衡生长两种类型。
六、晶体的制备晶体的制备方法主要包括溶液法、气相法、热法、溶胶-凝胶法等。
七、晶体的应用1. 材料领域晶体材料具有优异的物理、化学和光学性能,广泛应用于半导体、光电子器件、激光器件等领域。
2. 医药领域晶体结构可以对分子进行结构表征,用于药物合成和药物性质研究。
3. 能源领域晶体在太阳能电池、锂电池等能源设备中具有重要应用价值。
4. 其他领域晶体还广泛应用于化学分析、生物化学、环境保护等领域。
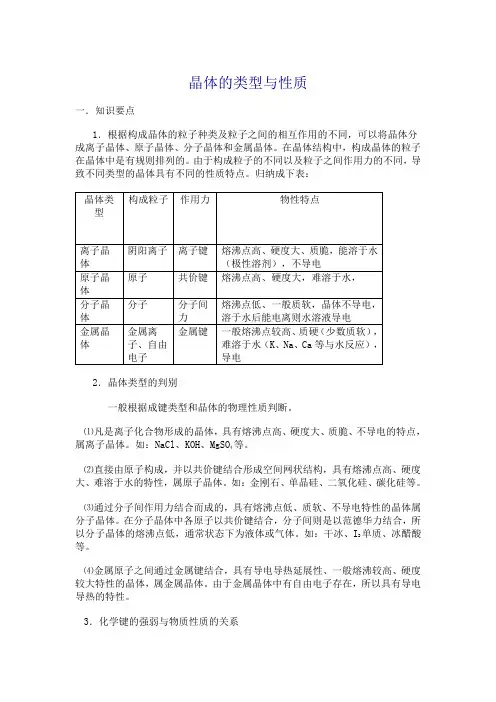
晶体的类型与性质一.知识要点1.根据构成晶体的粒子种类及粒子之间的相互作用的不同,可以将晶体分成离子晶体、原子晶体、分子晶体和金属晶体。
在晶体结构中,构成晶体的粒子在晶体中是有规则排列的。
由于构成粒子的不同以及粒子之间作用力的不同,导致不同类型的晶体具有不同的性质特点。
归纳成下表:2.晶体类型的判别一般根据成键类型和晶体的物理性质判断。
⑴凡是离子化合物形成的晶体,具有熔沸点高、硬度大、质脆、不导电的特点,等。
属离子晶体。
如:NaCl、KOH、MgSO4⑵直接由原子构成,并以共价键结合形成空间网状结构,具有熔沸点高、硬度大、难溶于水的特性,属原子晶体。
如:金刚石、单晶硅、二氧化硅、碳化硅等。
⑶通过分子间作用力结合而成的,具有熔沸点低、质软、不导电特性的晶体属分子晶体。
在分子晶体中各原子以共价键结合,分子间则是以范德华力结合,所单质、冰醋酸以分子晶体的熔沸点低,通常状态下为液体或气体。
如:干冰、I2等。
⑷金属原子之间通过金属键结合,具有导电导热延展性、一般熔沸较高、硬度较大特性的晶体,属金属晶体。
由于金属晶体中有自由电子存在,所以具有导电导热的特性。
3.化学键的强弱与物质性质的关系离子晶体中,离子键键能的大小与离子的半径、离子所带的电荷数、离子的核电荷数有关,一般起决定作用的主要是离子半径的大小。
离子半径小,阴、阳离子间的静电作用力大,离子键键能就大,离子晶体的熔沸点就高,硬度也大。
原子晶体中共价键键能的大小与成键的原子半径有关,原子半径越小,键长越短,键能就越大,晶体的熔沸点就越高,硬度也就越大。
分子晶体中分子与分子之间的作用力为范德华力,其能量较小。
对于组成和结构相似的物质,其分子间的作用力随相对分子质量的增大而增大,熔沸点也随之增高。
还与分子的极性有关,分子极性大,分子间作用力大,熔沸点高。
金属晶体中金属离子半径越小,离子电荷数越大,其金属离子与自由电子间的作用力越强,金属的熔沸点就越高。
4.石墨晶体具有层状结构的特点,层内原子间以共价键的方式形成平面网状结构(相当于原子晶体),层与层之间以范德华力结合(相当于分子晶体),层与层间有自由电子存在,晶体具有导电性(相当于金属晶体),所以石墨是一种过渡性或混合型晶体。



晶体的结构和物理化学性质晶体是一种具有规则的、周期性的空间排列方式的固态物质,其结构和物理化学性质具有一定的特殊性。
一、晶体的结构晶体的结构是指晶体中原子、离子或分子的排列方式。
晶体结构的研究对于了解晶体的性质和应用具有重要意义。
1. 基本概念晶体结构的基本单位是晶胞,晶胞是一个空间点阵,由若干个格点组成。
晶体中的原子、离子或分子占据着这些格点,并以一定的方式连接在一起。
2. 晶体的对称性晶体的结构具有各种各样的对称性,包括旋转对称性、镜面对称性、轴对称性等。
晶体对称性的存在决定了晶体的物理性质和外观特征。
3. 晶体的晶系和晶格根据晶体结构的不同,晶体可以分为七个晶系:立方晶系、六方晶系、四方晶系、三方晶系、正交晶系、单斜晶系和三斜晶系。
每个晶系下又有不同的晶格类型,如简单立方晶格、面心立方晶格、体心立方晶格等。
二、晶体的物理化学性质晶体的结构决定了它们的物理性质和化学性质,下面我们将重点介绍晶体的几个重要性质。
1. 硬度晶体的结构紧密有序,其中的化学键比较稳定,因此晶体通常具有较高的硬度。
不同晶体的硬度不同,可以通过硬度测试来定量评估晶体的硬度。
2. 双折射部分晶体具有双折射现象,也就是将入射光线分为两束线偏振光。
这种现象是由于晶体结构中的非中心对称性所导致的。
3. 光学性质晶体对于光的吸收、透射和折射等具有一定的选择性。
某些晶体具有特殊的光学性质,如偏光现象、发光现象等。
4. 热稳定性晶体的结构相对稳定,因此对于温度变化的适应能力较强。
晶体在高温下不易改变结构,具有较高的熔点和热稳定性。
5. 热导率和电导率部分晶体具有较高的热导率和电导率,这是因为晶体的结构中存在导电或热导路径,使得能量传导效率较高。
6. 化学反应晶体在一定条件下可以发生化学反应,这是因为晶体中的化学键具有一定的活性。
晶体的表面也可以参与化学反应,与周围环境发生相互作用。
综上所述,晶体的结构和物理化学性质密切相关,晶体的不同结构决定了其不同的性质。

晶体的类型与性质作者:李金洲来源:《神州·中旬刊》2013年第06期摘要:四种晶体所涉及的知识点多,学生经常把性质张冠李戴,本文就知识点加以总结,应用图表把性质、代表物加以分析,并配有练习,能够使学生轻松掌握该知识点。
关键词:离子晶体原子晶体分子晶体金属晶体一、知识点精讲1、晶体类型及性质比较*注意:⑴四种晶体类型的化学式表示的意义不同:离子晶体、原子晶体中化学式表示的分别是阴阳离子最简比和原子最简比,从而有的资料上把离子晶体和原子晶体看成是巨型分子;分子晶体中表示的是单个的分子。
⑵晶体讨论的是固态形式,而我们通常讨论化学性质时,不仅仅讨论其固态形式,包括其液态、气态和其水溶液。
2、化学键与分子间作用力的比较3、化学键和分子间作用力对物理、化学性质的影响(1)不同晶体类型的硬度大小、熔沸点高低等物理性质由于化学键键能比较大,使得其硬度较大和熔沸点较高,所以原子晶体、离子晶体和金属晶体分别大于和高于分子晶体。
但必须注意得是融化过程中原子晶体、离子晶体和金属晶体破坏的是化学键而分子晶体是分子间作用力(有的是氢键)。
(2)晶体性质的比较:比较晶体的硬度大小、熔沸点高低等物理性质的依据是:原子晶体→共价键键能→键长→由原子半径决定。
如:金刚石>晶体硅离子晶体→离子键强弱→离子半径和离子所带电荷数决定。
如:NaCl金属晶体→金属键→金属阳离子半径、所带的电荷数、自由电子的多少而定。
阳离子半径越小,所带的电荷越多,自由电子越多,相互作用就越大,熔点就会相应升高。
如:熔点KNa>K>Rb>Cs。
分子晶体→分子间力→结构相似的情况下由相对分子质量决定(分子有氢键例外)(3)氢键对分子晶体物理性质的影响⑴对溶解度的影响,分子中有氢键的可以在水中溶解,如NH3极易溶于水。
⑵对熔沸点的影响,分子中有氢键的相对而言熔沸点较高,如氧族元素中H2O的熔沸点最高。
⑶解释一些反常现象,如冰的密度小于水。

质对市爱慕阳光实验学校高三化学晶体的类型和性质【本讲主要内容】晶体的类型和性质【知识掌握】【知识点精析】1. 晶体的概念晶体是经过自然结晶而形成的具有规那么几何外形的固体。
自然结晶可以是液态物质降温变成固体的过程,也可是蒸发溶剂析出晶体的过程。
比方:水结成冰,海水蒸发得到的食盐固体。
晶体的宏观结构特点:有规那么的几何外形。
晶体的微观结构特点:构成晶体的微粒空间排列有规那么。
构成晶体的粒子有:分子、原子、离子。
晶体内部粒子间的作用有:离子键〔离子晶体〕、共价键〔原子晶体〕、分子间的作用力〔又叫范德瓦耳斯力,分子晶体〕,甚至氢键〔氢键不是化学健,是一种比拟强的范德瓦耳斯力,特殊的分子晶体,如:冰〕。
2. 晶体的分类根据构成晶体的粒子种类及粒子间的相互作用不同,可将晶体分为假设干类型,如:离子晶体、分子晶体、原子晶体、金属晶体。
〔1〕离子晶体①离子间通过离子键结合而成的晶体叫做离子晶体。
构成离子晶体的粒子是阴离子和阳离子。
离子晶体中离子间的作用是离子键。
离子化合物的晶体是离子晶体。
②典型离子晶体的结构模型NaCl晶体的结构模型 CsCl晶体的结构模型晶胞的概念:晶体中可以重复的最小单元。
③离子晶体的物理性质由于离子晶体离子键的能量较大,阴阳离子之间具有稳的结合方式,所以离子晶体的硬度较大、难于压缩,具有较高的熔点和沸点。
④离子晶体熔化、溶解过程中,均破坏离子键。
氯化钠晶体熔化变成液态,离子能够自由移动,离子键被破坏;氯化钠晶体溶于水中,电离成自由移动的离子,也破坏了离子键。
离子晶体固态时不导电,但熔化或溶解过程中,均能产生自由移动的阴、阳离子而导电。
〔2〕分子晶体①分子间作用力〔范德瓦耳斯力〕:分子间作用力比化学键弱得多,它对物质的熔点、沸点有影响。
②分子晶体的概念分子间以分子间的作用力相结合的晶体叫做分子晶体。
构成分子晶体的粒子是分子。
构成分子晶体的粒子间的作用是分子间作用力〔即范德瓦耳斯力〕。
由分子构成的物质在固态时都属于分子晶体。
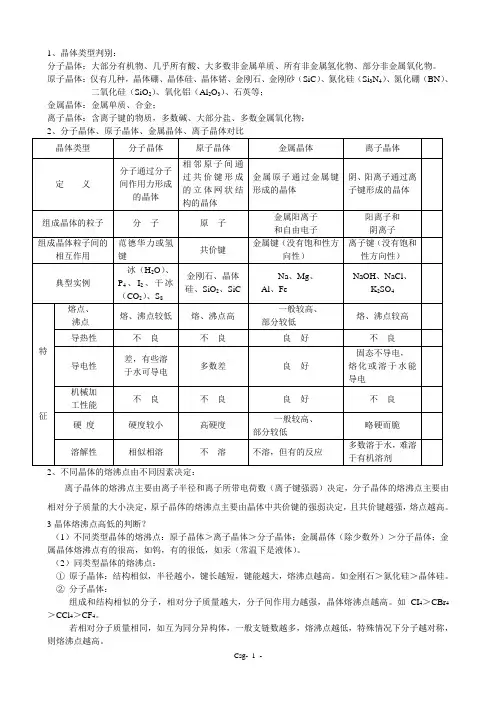
1、晶体类型判别:分子晶体:大部分有机物、几乎所有酸、大多数非金属单质、所有非金属氢化物、部分非金属氧化物。
原子晶体:仅有几种,晶体硼、晶体硅、晶体锗、金刚石、金刚砂(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)、氧化铝(Al2O3)、石英等;金属晶体:金属单质、合金;离子晶体:含离子键的物质,多数碱、大部分盐、多数金属氧化物;2、不同晶体的熔沸点由不同因素决定:离子晶体的熔沸点主要由离子半径和离子所带电荷数(离子键强弱)决定,分子晶体的熔沸点主要由相对分子质量的大小决定,原子晶体的熔沸点主要由晶体中共价键的强弱决定,且共价键越强,熔点越高。
3晶体熔沸点高低的判断?(1)不同类型晶体的熔沸点:原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体;金属晶体熔沸点有的很高,如钨,有的很低,如汞(常温下是液体)。
(2)同类型晶体的熔沸点:①原子晶体:结构相似,半径越小,键长越短,键能越大,熔沸点越高。
如金刚石>氮化硅>晶体硅。
②分子晶体:组成和结构相似的分子,相对分子质量越大,分子间作用力越强,晶体熔沸点越高。
如CI4>CBr4>CCl4>CF4。
若相对分子质量相同,如互为同分异构体,一般支链数越多,熔沸点越低,特殊情况下分子越对称,则熔沸点越高。
若分子间有氢键,则分子间作用力比结构相似的同类晶体强,故熔沸点特别高。
③ 金属晶体:所带电荷数越大,原子半径越小,则金属键越强,熔沸点越高。
如Al >Mg >Na >K 。
④ 离子晶体:离子所带电荷越多,半径越小,离子键越强,熔沸点越高。
如KF >KCl >KBr >KI 。
1.60C 与现代足球(如图6-1)有很相似的结构,它与石墨互为 ( ) A .同位素 B .同素异形体 C .同分异构体 D .同系物2.下列物质为固态时,必定是分子晶体的是 ( )A .酸性氧化物B .非金属单质C .碱性氧化物D .含氧酸 3.金属的下列性质中,不能用金属晶体结构加以解释的是 ( ) A .易导电 B .易导热 C .有延展性 D .易锈蚀4.氮化硅(43N Si )是一种新型的耐高温耐磨材料,在工业上有广泛的用途,它属于 ( ) A .原子晶体 B .分子晶体 C .金属晶体 D .离子晶体5.水的状态除了气、液和固态外,还有玻璃态。

晶体初中物理归纳总结晶体是一种具有高度有序结构的物质,由原子、分子或离子按照规则排列而成。
在初中物理学中,对晶体的性质和特点进行了一系列的学习和总结。
本文将对晶体的结构、性质以及应用进行归纳总结。
一、晶体的结构晶体的结构是由具有高度有序排列的原子、分子或离子构成的。
根据晶体的结构,可以将其分为离子晶体、分子晶体和原子晶体三种类型。
1.离子晶体离子晶体是由常见的阴离子和阳离子按照一定的比例排列构成的。
离子晶体的结构特点是离子之间具有强烈的电吸引力,形成了稳定的晶体结构。
2.分子晶体分子晶体由分子按照一定的规则有序地排列而成。
分子晶体的结构特点是分子之间通过分子间力相互作用,形成了晶体的结构。
3.原子晶体原子晶体是由原子按照一定的规则有序地排列而成。
原子晶体的结构特点是原子之间通过键合作用相连,形成了晶体的结构。
二、晶体的性质晶体具有一系列特殊的物理性质,这些性质直接与晶体的结构密切相关。
1.透明性大部分晶体在物理上是透明的,能够通过更多的光线,对光线有较好的折射和反射效果。
2.折射性晶体的结构使其具有较高的折射率,能够将入射光线的路径发生弯曲。
不同类型的晶体对光线的折射程度有差异。
3.双折射性部分晶体具有双折射性,即入射光线经过晶体时会分为普通光和异常光两束。
4.脆性晶体的结构使其具有较强的脆性,容易在外力作用下发生断裂。
5.共振效应晶体中的原子或离子具有特定的振动频率,当外界电场频率接近晶体的振动频率时,晶体会表现出共振效应。
三、晶体的应用晶体具有独特的结构和性质,在许多领域中有广泛的应用。
1.光学器件由于晶体具有较高的折射率和透明性,被广泛应用于各种光学器件,如镜片、棱镜和透镜等。
2.半导体器件某些晶体具有半导体特性,可以用于制造半导体器件,如晶体管、二极管和光伏电池等。
3.电子钟晶体中的石英常被用于电子钟的制造,因其具有稳定的振荡频率,可以精确计时。
4.电子元件晶体的特殊性质使其成为电子元件的重要组成部分,如晶体振荡器、晶体滤波器和晶体谐振器等。

晶体结构与晶体的性质晶体是由具有周期性、有序排列的原子、离子或分子构成的固体物质。
晶体结构与晶体的性质密切相关,本文将探讨晶体结构对晶体性质的影响。
一、晶体结构的分类晶体结构可以分为离子晶体结构、共价晶体结构和金属晶体结构三种类型。
1. 离子晶体结构离子晶体结构是由正负离子相互排列而成。
离子晶体结构的特点是阵列有序、结构稳定、点阵规则,并且具有高熔点和脆性。
典型的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
2. 共价晶体结构共价晶体结构是由共价键相连的原子构成。
共价晶体结构的特点是强度高、硬度大、熔点高,且导电性能差。
经典的共价晶体有金刚石、硅等。
3. 金属晶体结构金属晶体结构是由金属离子组成。
它具有电子云海模型,金属结构中电子自由流动,因此具有良好的导电性和导热性。
典型的金属晶体有铜、铁等。
二、晶体结构对晶体性质的影响晶体结构对晶体的物理、化学性质产生重要影响。
1. 物理性质晶体的物理性质与其晶体结构紧密相关。
晶体结构的不同决定着晶体的硬度、电导率、光学性质等。
以硬度为例,离子晶体结构由于离子之间的强烈静电吸引力,使得晶体的结构相对稳定,因而具有较高的硬度。
金属晶体结构中由于存在金属键,金属之间的层状排列可以很容易滑动,故金属具有较低的硬度。
而共价晶体结构由于共用电子对,原子之间更加紧密结合,具有更高的硬度。
另外,晶体的电导率与晶体结构也有关。
金属晶体由于自由电子的存在,具有良好的导电性。
而离子晶体和共价晶体由于存在离子或共价键的束缚,电子不易流动,因此具有较差的导电性。
2. 化学性质晶体结构也会影响晶体的化学性质。
晶体结构中原子、离子或分子之间的距离和排列方式决定了晶体的化学反应活性。
以溶解性为例,离子晶体结构中离子间的静电吸引力较大,导致离子结构比较稳定,难于溶解。
而共价晶体结构中,原子之间的共价键相对较强,其溶解性较差。
金属晶体由于金属之间的自由电子,容易与外界发生化学反应。
此外,晶体结构对晶体的光学性质也有重要影响。
高中化学晶体知识点总结晶体是由原子、分子或离子按照一定的规律排列而成的固体,具有规则的几何形状和明显的面、棱、角。
晶体是化学中的重要概念,其研究对于理解物质的性质和反应机理具有重要意义。
本文将从晶体的结构、性质和制备等方面进行总结。
一、晶体的结构晶体的结构是由原子、分子或离子的排列方式决定的。
晶体的结构可以分为离子晶体、共价晶体和分子晶体三种类型。
1.离子晶体离子晶体是由阳离子和阴离子按照一定的比例排列而成的晶体。
离子晶体的结构可以分为简单离子晶体和复合离子晶体两种类型。
简单离子晶体的结构比较简单,如氯化钠晶体。
氯化钠晶体的结构是由钠离子和氯离子按照一定的比例排列而成的,钠离子和氯离子交替排列,形成一个立方晶系的晶体。
复合离子晶体的结构比较复杂,如硫酸铜晶体。
硫酸铜晶体的结构是由铜离子和硫酸根离子按照一定的比例排列而成的,铜离子和硫酸根离子交替排列,形成一个六方晶系的晶体。
2.共价晶体共价晶体是由原子之间共用电子形成的晶体。
共价晶体的结构可以分为分子共价晶体和网络共价晶体两种类型。
分子共价晶体的结构比较简单,如冰晶体。
冰晶体的结构是由水分子按照一定的方式排列而成的,水分子之间通过氢键相互连接,形成一个六方晶系的晶体。
网络共价晶体的结构比较复杂,如金刚石晶体。
金刚石晶体的结构是由碳原子按照一定的方式排列而成的,每个碳原子与周围四个碳原子通过共价键相互连接,形成一个立方晶系的晶体。
3.分子晶体分子晶体是由分子按照一定的方式排列而成的晶体。
分子晶体的结构比较简单,如葡萄糖晶体。
葡萄糖晶体的结构是由葡萄糖分子按照一定的方式排列而成的,葡萄糖分子之间通过氢键相互连接,形成一个六方晶系的晶体。
二、晶体的性质晶体具有一些特殊的性质,如光学性质、电学性质和热学性质等。
1.光学性质晶体具有双折射现象,即光线在晶体中传播时会分成两束光线,这两束光线的振动方向垂直于彼此。
双折射现象是由于晶体的结构不对称所引起的。
2.电学性质晶体具有电学性质,即晶体可以产生电场和电荷。
化学知识点总结——晶体晶体是一种具有规则的、有序排列的、有固定几何形状的固体物质。
晶体的研究是化学的一个重要分支,对于了解物质的性质以及在材料科学、地球科学等领域有着重要的应用价值。
以下是有关晶体的一些基本知识点。
1.晶体结构:晶体的结构通常由原子、离子或分子的有序排列方式决定。
常见的晶体结构有离子晶体、共价晶体和分子晶体。
其中,离子晶体由正负离子通过离子键互相结合而成;共价晶体由共享电子键互相结合而成;分子晶体由分子之间的分子键互相结合而成。
2.晶格:晶体的结构可以看作是由重复单元构成的三维排列方式。
这个重复单元称为晶胞,晶胞中的原子或离子称为晶格点。
晶格是由晶胞堆积而成的无限延伸的结构。
晶格的类型可以通过晶体的晶系来描述,包括立方晶系、四方晶系、正交晶系、单斜晶系、菱晶系和三斜晶系。
3.晶体的性质:晶体的性质受其结构和组成物质的性质的影响。
晶体的硬度、熔点、导电性、光学性质等都与其晶体结构有关。
例如,离子晶体的硬度通常较大,由于离子之间的离子键的强度较高;金属晶体的热导率较高,由于金属晶体中的电子具有较高的自由移动性。
4.晶体生长:晶体通过从溶液、熔融物或气态中沉淀出来进行生长。
晶体生长是一个既复杂又独特的过程,其中包括核化、电镀和扩散。
在理想情况下,晶体生长过程中的各个晶胞应具有相同的形状和尺寸,但在实际生长过程中,晶体的形状和尺寸可能会发生变化。
5.晶体缺陷:晶体中存在着各种缺陷,如点缺陷、线缺陷和面缺陷。
点缺陷是原子、离子或分子在晶格中的缺失、替代或附加,包括空位、间隙原子、杂质原子等。
线缺陷是在晶体中存在着位错,即晶格的错位或错配。
面缺陷是晶体表面的集合,包括平面缺陷和界面缺陷。
6.X射线衍射:X射线衍射是研究晶体结构的一种重要方法。
通过将X射线束照射到晶体上,并测量出X射线经过晶体后的衍射图案,可以推断出晶体的结构信息。
这是因为X射线与晶体中的原子、离子或分子发生相互作用,产生干涉现象,形成衍射峰。
初中化学晶体知识点总结初中化学中的晶体主要分为两大类:分子晶体和原子晶体。
晶体是由原子、离子或分子按照一定的规律排列形成的具有周期性结构的固体。
了解晶体的结构和性质对于深入理解化学知识至关重要。
一、分子晶体分子晶体是由分子通过分子间力(如范德华力、氢键等)相互结合形成的晶体。
这类晶体的特点是熔点和沸点较低,硬度较小,易挥发。
典型的分子晶体包括水、冰、盐等。
1. 分子间力- 范德华力:非共价性质的力,包括诱导力、取向力和色散力(伦敦力)。
- 氢键:一种特殊的偶极-偶极相互作用,当氢原子与电负性较大的原子(如氧、氮、氟)形成共价键时,会在分子间形成氢键。
2. 晶体结构- 分子晶体的排列通常是无规则的,但在某些情况下,分子可以按照特定的几何形状排列,形成规则的晶体结构。
- 水分子在冰晶体中的排列形成了六角形的结构,这是氢键作用的结果。
3. 物理性质- 熔点和沸点:分子晶体的熔点和沸点通常较低,因为分子间力相对于化学键较弱。
- 硬度:分子晶体的硬度较小,易于切割或破碎。
- 挥发性:分子晶体易挥发,尤其是那些分子间力较弱的物质。
二、原子晶体原子晶体是由原子通过共价键结合形成的晶体。
这类晶体的特点是熔点和沸点较高,硬度较大,不易挥发。
典型的原子晶体包括金刚石、硅晶体等。
1. 共价键- 共价键是由两个或多个原子共享电子对形成的化学键。
- 共价键的类型包括单键、双键和三键,它们的性质取决于共享电子的数量和排列方式。
2. 晶体结构- 原子晶体的结构可以是简单的立方、六方或四方晶系,也可以是更复杂的结构。
- 金刚石是一种典型的原子晶体,其碳原子以四面体结构排列,形成了非常稳定的晶体结构。
3. 物理性质- 熔点和沸点:原子晶体的熔点和沸点较高,因为共价键非常强。
- 硬度:原子晶体的硬度较大,例如金刚石是自然界中已知的最硬物质。
- 挥发性:原子晶体不易挥发,因为需要破坏强大的共价键才能使原子分离。
三、晶体的性质和应用1. 晶体的对称性- 晶体的对称性是指晶体结构在空间中的对称操作,如旋转对称、镜面对称等。
第一单元 晶体的类型与性质1.化学键:相邻的两个或多个原子之间的强烈的相互作用.化学键包括离子键和共价键等。
(1).离子键 概念:阴阳离子间通过静电作用所形成的化学键 特点:阴阳离子间的相互作用;形成条件:活泼金属与活泼非金属通过得失电子形成离子键 存在:离子化合物中(2).共价键 概念:原子通过共用电子对而形成的化学键 类型 :极性共价键和非极性共价键1)极性共价键 特点:共用电子对发生偏移 形成条件:不同非金属元素原子的电子对成键 存在:共价化合物及其某些离子化合物中2)非极性共价键 特点:共用电子对不发生偏移形成条件:相同非金属元素原子的电子配对成键 存在:非金属元素的单质及某些化合物中2.氢键、分子间作用力(2) 化学键用实线表示,用“···”表示氢键,以示区别。
如HF 分子:H ··氢键F H ···F(1) 强弱顺序:化学键>>氢键>分子间作用力(注意:氢键不属于化学键)注意:某些分子晶体反常的熔沸点(如HF 、H 2O 、NH 3等)、缔合分子的形成[如(H 2O )n 、(HF )n 等]、密度的反常变化(如冰的密度比水小)等都能用氢键解释。
(1)根据构成晶体的粒子和粒子间的作用力类别判断:(2)根据晶体的特征性质判断:4.物质熔沸点高低比较(1)不同晶体类型的物质:一般是原子晶体>离子晶体>分子晶体。
(2)同种晶体类型的物质:晶体内粒子间作用力越大,熔沸点越高。
A.原子晶体比较共价键的强弱(看键长和键能),一般原子半径越小,键能越大,键长越短,共价键越牢固,晶体的熔沸点越高。
如熔点:金刚石(C)>水晶(SiO2)>SiC>晶体硅(Si)。
B.离子晶体比较离子键的强弱,一般阴阳离子电荷数越多,离子半径越小,则离子间作用力越大,离子键越强,熔沸点越高。
如熔点:MgO>MgCl2>NaCl>CsCl。