化学平衡常数习题课
- 格式:ppt
- 大小:862.00 KB
- 文档页数:13

化学平衡常数练习【学习目标】:1、化学平衡常数的概念2、运用化学平衡常数对化学反应进行的程度判断3、运用化学平衡常数进行计算,转化率的计算一、化学平衡常数1、定义:在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度以系数为指数的幂的乘积与反应物浓度以系数为指数的幂的乘积的比值是一个常数。
这个常数就是该反应的化学平衡常数(简称平衡常数)2、表达式:对于一般的可逆反应,mA(g)+ nB(g)pC(g)+ qD(g)当在一定温度下达到平衡时,K==______________________________3、平衡常数的意义:(1)平衡常数的大小反映了化学反应进行的(也叫)。
K值越大,表示反应进行得,反应物转化率;K值越小,表示反应进行得,反应物转化率。
(2)判断正在进行的可逆是否平衡及反应向何方向进行:对于可逆反应:mA(g)+ nB(g)pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Q c=C p(C)·C q(D)/C m(A)·C n(B),叫该反应的浓度商。
Q c<K ,反应向进行Q c=K ,反应_____________________Q c>K ,反应向进行(3)利用K可判断反应的热效应若升高温度,K值增大,则正反应为反应(填“吸热”或“放热”)。
若升高温度,K值减小,则正反应为反应(填“吸热”或“放热”)。
二、使用平衡常数应注意的几个问题:1、化学平衡常数只与有关,与反应物或生成物的浓度无关。
2、在平衡常数表达式中:水(液态)的浓度、固体物质的浓度不写C(s)+H2O(g)CO(g)+H2(g),K= _________________Fe(s)+CO(g)Fe(s)+CO2(g),K=__________________3、化学平衡常数表达式与化学方程式的书写有关例如:N2(g)+3H2(g)2NH3(g)的平衡常数为K1,1/2N2(g)+3/2H2(g)NH3(g)的平衡常数为K2,NH3(g)1/2N2(g)+3/2H2(g)的平衡常数为K3;写出K1和K2的关系式:。

第4课时 化学平衡常数1.下列关于平衡常数K 的说法中,正确的是( )①平衡常数K 只与反应本身及温度有关 ②改变反应物浓度或生成物浓度都会改变平衡常数K ③加入催化剂不改变平衡常数K ④平衡常数K 只与温度有关,与反应的本身及浓度、压强无关A .①②B .②③C .③④D .①③2.可逆反应:C(s)+H 2O(g)CO(g)+H 2(g)在t ℃下达到平衡,其平衡常数可表示为( ) A .K =22(C)(H O)(CO)(H )c c c cB .K =22(CO)(H )(C)(H O)c c c cC .K =22(H O)(CO)(H )c c cD .K =22(CO)(H )(H O)c c c3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K 值分别是 ①H 2+F 22HF K =1047 ②H 2+Cl 22HCl K =1017 ③H 2+Br 22HBr K =109 ④H 2+I 22HI K =1比较K 值大小,可知各反应的正反应进行的程度由大到小的顺序是( ) A .①②③④ B .④②③① C .①④③②D .无法确定4.对于可逆反应:C(s)+CO 2(g)2CO(g),在一定温度下其平衡常数为K 。
下列条件的变化中,能使K 值发生变化的是( ) A .将C(s)的表面积增大 B .增大体系的压强 C .升高体系的温度D .使用合适的催化剂5.某温度下气体反应达到化学平衡,平衡常数K =22(A)(B)(E)(F)c c c c ,恒容时,若温度适当降低,F 的浓度增加。
下列说法中正确的是( ) A .增大c (A)、c (B),K 增大 B .降低温度,正反应速率增大 C .该反应的焓变为负值D .该反应的化学方程式为2E(g)+F(g)A(g)+2B(g)6.将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s)NH 3(g)+HI(g);②2HI(g)H 2(g)+I 2(g)。

化学平衡常数课后篇素养形成必备知识基础练1.关于平衡常数K,下列说法中正确的是()A.K值越大,反应速率越大B.对任一给定的可逆反应,温度升高,K值增大C.对任一给定的可逆反应,K值越大,反应物的平衡转化率越高D.加入催化剂或增大反应物浓度,K值将增大值与催化剂、反应物的浓度、化学反应速率的大小无关,所以A、D错误;与反应温度有关,但是温度升高,K值可能增大也可能减小,B也错误。
2.汽车尾气净化中的一个反应如下:N2(g)+CO2(g)ΔH=-373.4 kJ·mol-1NO(g)+CO(g)12在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是(),升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A项错误;同理升高温度,平衡逆向移动,CO的转化率减小,B项错误;平衡常数只受温度影响,与NO的物质的量无关,C项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D 项错误。
O2(g)SO3(g)的平衡常数K=50。
在同一温度下,反应2SO3(g)3.某温度时,反应SO2(g)+122SO2(g)+O2(g)的平衡常数K1应为()A.2 500B.100C.4×10-4D.2×10-2=c (SO 3)c (SO 2)·c 12(O 2),K 1=c 2(SO 2)·c (O 2)c 2(SO 3),K 1=1K2=4×10-4。
4.已知反应A(g)+2B(g)C(g),在密闭容器中充入A 、B 、C 三种气体,至建立化学平衡后,在温度不改变的前提下将体积缩小23,则该反应此时的平衡常数( ) A.增大为原来的3倍 B.增大为原来的2倍 C.增大为原来的9倍 D.不变,温度不变,则平衡常数不变。
5.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K 值分别是 ①H 2+F 22HF K =1047 ②H 2+Cl 22HCl K =1017 ③H 2+Br 22HBr K =109 ④H 2+I 22HI K =1比较K 值大小,可知各反应的正反应进行的程度由大到小的顺序是( ) A.①②③④ B.④②③① C.①④③② D.无法确定,表示该反应的正反应进行的程度越大,故A 正确。

第三节化学平衡第4课时化学平衡常数一.选择题。
1.在某温度下,可逆反应的平衡常数为K,下列说法不正确的是()A.K越大,达到平衡时反应进行得程度越大B.K越大,达到平衡时反应物的转化率越大C.K随反应物浓度的改变而改变D.K随温度的改变而改变2.对于可逆反应:C(s)+CO2(g)2CO(g),在一定温度下其平衡常数为K,下列条件的变化中能使K发生变化的是()A.将C(s)的表面积增大B.增大体系压强C.升高体系温度D.使用合适的催化剂O2(g)SO3(g)的平衡常数K=50,在同一温度下,反应2SO3(g) 3.某温度时,反应SO2(g)+122SO2(g)+O2(g)的平衡常数K'应为()A.2 500B.100C.4×10-4D.2×10-24.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是①H2+F22HF K=1047;②H2+Cl22HCl K=1017;③H2+Br22HBr K=109;④H2+I22HI K=1。
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是()A.①②③④B.④②③①C.①④③②D.无法确定5.25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是()A.往平衡体系中加入少量金属铅后,c(Pb2+)增大B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小C .升高温度,平衡体系中c (Pb 2+)增大,说明该反应ΔH >0D .25 ℃时,该反应的平衡常数K =2.2 6.下列有关平衡常数的说法中,正确的是( )A .改变条件,反应物的转化率增大,平衡常数也一定增大B .反应2NO 2(g)N 2O 4(g) ΔH <0,升高温度,该反应平衡常数增大C .对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等D .平衡常数为K =c (CO )·c (H 2O )c (CO2)·c (H 2)的反应,化学方程式为CO 2(g)+H 2(g)CO(g)+H 2O(g)7.已知298.15 K 时,可逆反应:Pb 2+(aq)+Sn(s)Pb(s)+Sn 2+(aq)的平衡常数K =2.2,若溶液中Pb 2+和Sn 2+的浓度均为0.10 mol/L ,则反应进行的方向是( ) A .向右进行B .向左进行C .处于平衡状态D .无法判断8.一定温度下,某气态平衡体系的平衡常数表达式为K =c (A )·c 2(B )c 2(C )·c 2(D ),有关该平衡体系的说法正确的是( )A .升高温度,平衡常数K 一定增大B .增大A 浓度,平衡向正反应方向移动C .增大压强,C 体积分数增加D .升高温度,若B 的百分含量减少,则正反应是放热反应 9.反应Fe(s)+CO 2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。

化学平衡课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1. 某一反应在定温、定压且无非体积功的条件下,当该反应的∆r G m <0时,则该反应能正向进行。
( )2. 如果某一化学反应的∆r H < 0,该反应的K 随着温度升高而减小。
( )3. 对理想气体反应:0 = ∑B νB B ,在定温定压下当∑B νB >0时,随着惰性气体的加入而平衡向左移动。
( )4. 对理想气体反应:0 = ∑B νB B ,在定温定压下当∑B νB >0时,随着惰性气体的加入而平衡向左移动。
(9. 如果某一化学反应的∆r H 不随温度变化,那么其∆r S 也不随温度变化,但是其∆r G 却与温度有关。
( )5. 对于真实气体混合物的反应,该反应的标准平衡常数K 仅仅是温度的函数。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. PCl 5的分解反应PCl 5(g) == PCl 3(g) + Cl 2(g) 在473 K 达到平衡时PCl 5(g) 有48.5%分解,在573 K 达到平衡时,有97 %分解,则此反应是( )(1)吸热反应; (2)放热反应;(3)反应的标准摩尔焓变为零的反应;(4)在这两个温度下标准平衡常数相等的反应。
2. 设反应 a A(g ) == y Y(g) + z Z(g),在101.325 kPa 、300 K 下,A 的转化率是600 K 的2倍,而且在300 K 下系统压力为101 325 Pa 的转化率是2×101 325 Pa 的2 倍,故可推断该反应 ( )(1)标准平衡常数与温度,压力成反比;(2)是一个体积增加的吸热反应 ;(3)是一个体积增加的放热反应;(4)标准平衡常数与温度成正比,与压力成反比。
3.理想气体反应N 2O 5(g )== N 2O 4(g )+1/2O 2(g )的∆r H 为41.84kJ ⋅mol -1,∑=0)(,B C mp B ν。

第4课时化学平衡常数1.化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )A.K越大,反应物的转化率越小B.K与反应物的浓度有关C.K与生成物的浓度有关D.K与温度有关2.某温度时,反应的平衡常数K=50。
在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K1应为( )A.2 500B.100C.4×10-4D.2×10-23.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是( )A.平均相对分子质量B.SO3(g)的转化率C. D.4.在淀粉-KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。
测得不同温度下该反应的平衡常数K如表所示:下列说法正确的是( )A.反应I2(aq)+I-(aq)I3-(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I3-)减小C.该反应的平衡常数表达式为D.25 ℃时,向溶液中加入少量KI固体,平衡常数K大于6895.某温度下,向容积为1 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数为( ) A.8.0×102 B.1.6×103C.3.2×103D.4.0×1026.在一定条件下,向一带活塞的密闭容器中充入 2 mol SO2和 1 mol O2发生如下反应:2SO2(g)+O2(g)2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不发生改变的是( )A.保持温度和容器体积不变,充入1 mol SO3(g)B.保持温度和容器压强不变,充入1 mol SO3(g)C.保持温度和容器压强不变,充入1 mol O2(g)D.保持温度和容器压强不变,充入1 mol Ar(g)7.汽车尾气净化中的一个反应如下:ΔH=-373.4 kJ·mol-1在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )8.两个恒容容器中分别发生反应A(g)2B(g)和2A(g)C(g),平衡时A的转化率分别为α1和α2。

第4课时化学平衡常数1.将4 mol SO2(g)与2 mol O2(g)放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的浓度为0.5 mol/L。
则此条件下的平衡常数K为() A.4B.0.25C.0.4D.0.22.某温度下反应H2(g)+I2(g)2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是() A.反应正好达平衡B.反应向左进行C.反应向某方向进行一段时间后K<57.0D.反应向某方向进行一段时间后c(H2)<0.2 mol/L3.在1 100 ℃时,一定容积的密闭容器中发生反应:FeO(s)+CO(g)Fe(s)+CO2(g)ΔH =a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是()A.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.026 3 mol/LB.若要提高CO的转化率,则可以加入过量FeOC.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态D.若生成56 g Fe,则吸收的热量小于a kJ4.在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g)2C(g),达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的5 6,则A的转化率为()A.67%B.50%C.25%D.5%5.[双选]在容积为2 L的密闭容器中进行反应:CO(g)+2H2(g)CH3OH(g),其他条件不变,在300 ℃和500 ℃时,物质的量n(CH3OH)随着反应时间t的变化曲线如图所示,下列说法正确的是()A.该反应的ΔH<0B.其他条件不变,升高温度反应的平衡常数增大C.300 ℃时,0~t1 min内CH3OH的平均生成速率为n12t1mol/(L·min)D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时n(H2)n(CH3OH)减小6.汽车尾气净化中的一个反应如下:NO(g)+CO(g) 12N2(g)+CO2(g)ΔH=-373.4 kJ/mol在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是()7.在密闭容器中,反应X2(g)+Y2(g)2XY(g)ΔH<0达到甲平衡,仅改变某一条件后,达到乙平衡。


化学平衡练习题平衡常数与影响因素化学平衡练习题:平衡常数与影响因素化学平衡是指反应物转化为生成物的速率相等时的状态。
在平衡状态下,反应物和生成物的浓度不再发生明显变化,而达到一种动态平衡。
平衡常数是描述平衡反应物浓度与生成物浓度之间关系的指标。
在这篇文章中,我们将探讨平衡常数的定义、计算方法以及影响平衡常数的各种因素。
1. 平衡常数的定义和计算方法平衡常数(Kc)是指在给定温度下,动态平衡反应体系中各组分物质浓度的稳定关系。
它的计算方法根据平衡反应式中物质的摩尔系数及浓度定义,通常以浓度为计量单位。
平衡常数的表达式为:Kc = [生成物1]^m * [生成物2]^n / [反应物1]^x * [反应物2]^y其中,方括号表示物质的浓度,上标表示物质的摩尔系数,m、n、x、y分别对应生成物和反应物的摩尔系数。
2. 影响平衡常数的因素平衡常数的大小决定了反应体系达到平衡时生成物和反应物的浓度比例。
以下是一些影响平衡常数的因素:2.1 温度的影响温度是一个重要的因素,当温度升高时,平衡常数有可能增大或减小。
对于放热反应,温度的升高将减小平衡常数;而对于吸热反应,温度的升高将增大平衡常数。
这是因为增加温度会导致反应体系吸热或放热,从而影响反应速率和平衡位置。
2.2 压力的影响对于气体反应体系,压力的变化会对平衡常数产生影响。
按照Le Chatelier原理,增加压力会使平衡位置向反应物浓度较低的方向移动,从而增大平衡常数。
相反,降低压力会使平衡位置向反应物浓度较高的方向移动,导致平衡常数减小。
2.3 初始物质浓度的影响初始物质浓度也会对平衡常数产生影响。
在反应初期,物质浓度较高,反应速率较快,但随着反应的进行,浓度逐渐减小,反应速率下降。
当达到平衡时,平衡常数由初始物质浓度决定。
2.4 添加催化剂的影响催化剂是一种物质,能够改变反应的速率但本身并不参与反应。
添加催化剂后,反应体系的平衡位置不发生改变,但反应速率增加。
化学平衡常数课堂练习:1.正误判断,正确的划“√”,错误的划“×”(1)平衡常数表达式中,可以是物质的任一浓度( )(2)催化剂能改变化学反应速率,也能改变平衡常数( )(3)平衡常数发生变化,化学平衡不一定发生移动( )(4)化学平衡发生移动,平衡常数不一定发生变化( )2.书写下列化学平衡的平衡常数表达式。
(1)2SO2+O22SO3(2)C(s)+H2O(g)CO(g)+H2(g)(3)2CH3OH(g)CH3OCH3(g)+H2O(g)(4)CO2-3+H2O HCO-3+OH-(5)Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)(6)CaCO3(s)CaO(s)+CO2(g)3.甲醇是重要的化学工业基础原料和清洁液体燃料。
工业上可利用CO或CO2来生产燃料甲醇。
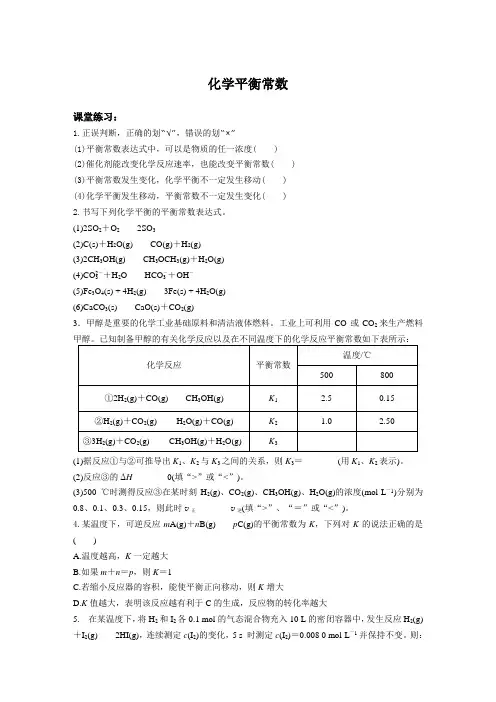
已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:①2H2(g)+CO(g)CH3OH(g)②H2(g)+CO2(g) H2O(g)+CO(g)③3H2(g)+CO2(g) CH3OH(g)+H2O(g)(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH________0(填“>”或“<”)。
(3)500 ℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
4.某温度下,可逆反应m A(g)+n B(g)p C(g)的平衡常数为K,下列对K的说法正确的是()A.温度越高,K一定越大B.如果m+n=p,则K=1C.若缩小反应器的容积,能使平衡正向移动,则K增大D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大5. 在某温度下,将H2和I2各0.1 mol的气态混合物充入10 L的密闭容器中,发生反应H2(g)+I2(g)2HI(g),连续测定c(I2)的变化,5 s 时测定c(I2)=0.008 0 mol·L-1并保持不变。

第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态化学平衡常数培优第一阶——基础过关练1.下列关于平衡常数的说法正确的是A.在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示B.可逆反应中,反应物的转化率增大,一定导致化学平衡常数增大C.可以用化学平衡常数来定量描述化学反应的限度D.平衡常数的大小与温度、浓度、压强、催化剂有关2.已知下列反应的平衡常数:H2(g) +S(s)=H2S(g),K1;S(s)+ O2(g)=SO2(g),K2;则反应H2(g) +SO2(g)=O2(g) +H2S(g)的平衡常数是A.K1+K2B.K1-K2C.K1 ×K2D.K1/K23.在恒容密闭容器中反应:2NO(g)+2CO(g) N2 (g)+2CO 2(g)ΔH=-373.4 kJ·mol-1达到平衡状态,以下说法不正确...的是A.及时分离出CO2,使Q减小,Q<K,因此平衡正向移动B.及时分离出N2,使Q减小,Q<K,因此平衡正向移动C.加入催化剂可增大反应速率,从而增大一段时间内的反应物转化率D.降低温度,使Q减小,Q<K,因此平衡正向移动4.(2022·广西贵港·高二期末)在某恒容密闭容器中充入一定量的O2(g)和O3(g),发生反应2O3(g)3O2(g) △H<0,下列说法正确的是A.若混合气体的密度不再随时间而改变,则该反应达到平衡B.加入合适的催化剂,反应达到平衡后,O2的体积分数增大C.该反应的生成物的总能量大于反应物的总能量D.若起始时充入少量的稀有气体,则该反应的反应速率保持不变5.(2022·陕西省汉中中学高二阶段练习)下列描述的化学反应状态,不一定是平衡状态的是A.3H2(g)+N2(g)2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1B.2NO2(g) N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变C.CaCO3(s) O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变D.H2(g)+Br2(g) 2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变6.(2022·河北正中实验中学高二开学考试)已知:X(g)+2Y(g)3Z(g) ΔH=-akJ·mol-1(a>0),下列说法不正确的是A.0.1mol X和0.2mol Y充分反应生成Z的物质的量一定小于0.3molB.达到化学平衡状态时,X、Y、Z的浓度不再发生变化C.反应生成3mol Z(g)时,反应放出的总热量为a kJD.升高反应温度,逆反应速率增大,正反应速率减小7.(2022·重庆八中高二阶段练习)对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是A.达到化学平衡时,NO的浓度保持不变B.加入合适的催化剂,可使平衡正向移动C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大D.保持容器容积不变,向其中加入1molHe,化学反应速率增大8.(2022·辽宁·本溪市第二高级中学高二期末)对于反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)的平衡常数,(注意:用[H2]表示氢气的浓度,其他物质浓度也是这样表示)下列说法正确的是A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小B.改变反应的温度,平衡常数不一定变化C.K =4234 342c(H)c(Fe O) c(Fe)c(H O)D .K=4242c(H) c(H O)9.(2022·上海交大附中高二阶段练习)一定温度下,在容积不变的密闭容器中进行如下可逆反应:SiF4 (g) +2H2O(g) SiO2(s)+4HF(g),下列能表明该反应已达到化学平衡状态的是①v正(H2O) =2v逆(HF)②SiF4的体积分数不再变化③容器内气体压强不再变化④4 molH-O键断裂的同时,有2molH- F 键断裂⑤混合气体的体积不再变化A.①②③B.②④⑤C.②③D.③④⑤10.(2022·四川·射洪中学高二阶段练习)一定温度下,向恒容容器中充入1molA和2molB发生反应A(g)+2B(g)⇌3C(g)+D(s)。
第三节 化学平衡 第4课时 化学平衡常数一.选择题。
1.2 000 K 时,反应CO(g)+12O 2(g) CO 2(g)的平衡常数为K ,则相同温度下反应2CO 2(g)2CO(g)+O 2(g)的平衡常数K ′为( ) A.1K B .K 2 C.1K2 D.121K2.已知:C(s)+CO 2(g)2CO(g),正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是 ( ) A .升温 B .加压 C .使用催化剂D .降温3.放热反应CO(g)+H 2O(g)CO 2(g)+H 2(g)在温度t 1时达到平衡,c 1(CO)=c 1(H 2O)=1.0 mol·L -1,其平衡常数为K 1。
升高反应体系的温度至t 2时,反应物的平衡浓度分别为c 2(CO)和c 2(H 2O),平衡常数为K 2,则( ) A .K 2和K 1的单位均为mol·L -1 B .K 2<K 1C .c 2(CO)>c 2(H 2O)D .c 1(CO)>c 2(CO)4.已知298.15 K 时,可逆反应:Pb 2+(aq)+Sn(s)Pb(s)+Sn 2+(aq)的平衡常数K=2.2,若溶液中Pb 2+和Sn 2+的浓度均为0.10 mol·L -1,则反应进行的方向是 ( ) A .向右进行 B .向左进行 C .处于平衡状态D .无法判断5.298 K 时,各反应的平衡常数如下: ①N 2(g)+O 2(g) 2NO(g) K =1×10-30;②2H 2(g)+O 2(g) 2H 2O(g) K =2×1081; ③2CO 2(g)2CO(g)+O 2(g) K =4×10-92,则常温下,NO 、H 2O 、CO 2这三个化合物分解放氧的倾向最大的是 ( ) A .① B .② C .③D .无法判断6.已知反应①:CO(g)+CuO(s) CO 2(g)+Cu(s)和反应②:H 2(g)+CuO(s)Cu(s)+H 2O(g)在相同的某温度下的平衡常数分别为K 1和K 2,该温度下反应③:CO(g)+H 2O(g)CO 2(g)+H 2(g)的平衡常数为K 。
高考化学复习 化学平衡常数及其计算1.随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。
反应:2NO(g)+2CO(g)2CO 2(g)+N 2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K 时平衡常数为1×1059。
下列说法正确的是( )A .提高尾气净化效率的最佳途径是研制高效催化剂B .提高尾气净化效率的常用方法是升高温度C .装有尾气净化装置的汽车排出的气体中不再含有NO 或COD .570 K 时,及时抽走CO 2、N 2,平衡常数将会增大,尾气净化效率更佳解析:提高尾气净化效率的最佳途径是研制高效催化剂,加快反应速率,A 正确,B 错误;题中反应为可逆反应,装有尾气净化装置的汽车排出的气体中仍然含有NO 或CO ,C 错误;改变浓度对平衡常数无影响,平衡常数只与温度有关,D 错误。
答案:A2.在淀粉KI 溶液中存在下列平衡:I 2(aq)+I -(aq)I -3(aq)。
测得不同温度下该反应的平衡常数K 如表所示。
下列说法正确的是( )t /℃ 5 15 25 35 50 K1 100841689533409A.反应I 2(aq)+I -(aq)I -3(aq)的ΔH >0B .其他条件不变,升高温度,溶液中c (I -3)减小C .该反应的平衡常数表达式为K =c (I 2)·c (I -)c (I -3)D .25 ℃时,向溶液中加入少量KI 固体,平衡常数K 小于689解析:A 项,温度升高,平衡常数减小,因此该反应是放热反应,ΔH <0,错误;B 项,温度升高,平衡逆向移动,c (I -3)减小,正确;C 项,K =c (I -3)c (I 2)· c (I -),错误;D 项,平衡常数仅与温度有关,25 ℃时,向溶液中加入少量KI 固体,平衡正向移动,但平衡常数不变,仍然是689,错误。
答案:B3.(2019·深圳质检)对反应:a A(g)+b B(g)c C(g)+d D(g) ΔH ,反应特点与对应的图象的说法不正确的是( )A.图①中,若P1>P2,则该反应在较低温度下有利于自发进行B.图②中,若T2>T1,则ΔH<0 且a+b=c+dC.图③中t1时刻改变的条件一定是使用了催化剂D.图④中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率解析:A项,由分析图①可知,温度升高,A%增大,说明平衡逆移动,则正反应为放热反应,若P1>P2,P1时A%低于P2,压强增大,平衡正向移动,则反应前气体分子数小于反应后气体分子数,ΔS<0,则该反应在较低温度下有利于自发进行,正确;B项,图②中,压强增大,A的转化率不变,平衡不移动,则a+b=c+d,若T2>T1,A的转化率降低,平衡逆移动,则正反应为放热反应,ΔH<0,正确;C项,图③中t1时刻改变的条件可能是使用了催化剂,也可能是增大压强(当a+b=c+d时),错误;D项,图④中,T1>T2,若ΔH<0,升高温度平衡逆向移动,转化率减小,则纵坐标不可能表示的是反应物的转化率,D正确。
《化学平衡与化学平衡常数》1、在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t℃700 800 830 1000 1200K 0.6 0.9 1.0 1.7 2.6请回答下列问题:(1)该反应的化学平衡常数K = 。
(2)该反应为反应。
(填“吸热”或“放热”)(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =0.01mol/L, c(H2O) =0.03mol/L, c(CO2) =0.01mol/L, c(H2) =0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率(填"大""小"或"不能确定")(4)830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后CO2的转化率为, H2的转化率为 .2.已知可逆反应:M(g)+N(g) P (g)+Q(g) ,△H>0 请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为__________ ;(2)若反应温度升高,M的转化率______(填“增大”“减小”或“不变”;)(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________(4)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b mol·L-1,达到平衡后,M的转化率为________。
3.加热时,N2O5可按下列分解:N2O5 N2O3+ O2、N2O3又可按下列分解: N2O3 N2O + O2。
今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。
高三化学平衡练习题在高三化学学习的过程中,平衡是一个重要的概念和知识点。
理解和掌握平衡反应的原理和计算方法对于化学学习的深入和应用至关重要。
下面将通过几个练习题来加深对化学平衡的理解。
1. 对于下列化学平衡反应N2(g) + 3H2(g) ↔ 2NH3(g)(1) 写出正向反应和逆向反应的反应物和产物。
(2) 写出平衡常数表达式并给出其计算公式。
(3) 当反应物的初始摩尔浓度分别为[N2] = 0.5 mol/L,[H2] = 0.8 mol/L时,平衡时氨气的摩尔浓度是多少?2. 对于下列化学平衡反应CO(g) + H2O(g) ↔ CO2(g) + H2(g)(1) 写出正向反应和逆向反应的反应物和产物。
(2) 写出平衡常数表达式并给出其计算公式。
(3) 当反应物的初始摩尔浓度分别为[CO] = 1.0 mol/L,[H2O] = 0.5 mol/L时,平衡时氢气的摩尔浓度是多少?3. 对于下列化学平衡反应N2O4(g) ↔ 2NO2(g)(1) 写出正向反应和逆向反应的反应物和产物。
(2) 写出平衡常数表达式并给出其计算公式。
(3) 当反应物的初始压强分别为[P(N2O4)] = 2.0 atm时,平衡时NO2的压强是多少?4. 对于下列化学平衡反应N2(g) + O2(g) ↔ 2NO(g)(1) 写出正向反应和逆向反应的反应物和产物。
(2) 写出平衡常数表达式并给出其计算公式。
(3) 当反应物的初始压强分别为[P(N2)] = 1.5 atm,[P(O2)] = 0.8 atm时,平衡时NO的压强是多少?在解答这些问题之前,我们首先要明确平衡常数的含义。
平衡常数(K)是描述平衡体系中浓度(或压强)的一个指标,它与反应物和产物的浓度(或压强)之间的关系密切相关。
对于一般的反应方程式:aA + bB ↔ cC + dD平衡常数的表达式可以表示为:K = [C]^c[D]^d / [A]^a[B]^b1. (1) 正向反应的反应物是N2和H2,产物是NH3;逆向反应的反应物是NH3,产物是N2和H2。
第25讲 化学平衡常数及其计算1.对于化学反应方向的确定,下列说法正确的是( )A .在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向B .温度、压强一定时,放热的熵增加的反应不一定能自发进行C .反应焓变是决定反应能否自发进行的唯一因素D .能够自发进行的反应就一定能够发生并完成2.(2017·衡水模拟)某温度下,在一个2 L 的密闭容器中,加入4 mol A 和2 mol B 进行如下反应:3A(g)+2B(g)4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C ,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( ) A .该反应的化学平衡常数表达式是K =c 4(C )c 2(D )c 3(A )c 2(B )B .此时,B 的平衡转化率是40%C .增大该体系的压强,平衡向右移动,化学平衡常数增大D .增加B ,B 的平衡转化率不变3.(2017·红塔区期中)在一定体积的密闭容器中,进行如下化学反应:CO 2(g)+H 2(g)CO(g)+H 2O(g) ΔH =a kJ·mol -1其化学平衡常数K 和温度t 的关系如下表所示。
下列说法中正确的是( )t /℃ 700 800 830 1 000 1 200 K0.60.91.01.72.6A .该反应的正反应为放热反应,即a <0B .当平衡浓度符合c (CO 2)·c (H 2)=c (CO)·c (H 2O)时的温度为830 ℃C .当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动D .当v (H 2)=v (H 2O)时该反应达到化学平衡状态4.80 ℃时,在2 L 密闭容器中充入0.40 mol N 2O 4,发生反应N 2O 4===2NO 2 ΔH =+Q kJ·mol-1(Q >0),获得如下数据:时间/s 0 20 40 60 80 100 c (NO 2)/(mol·L -1)0.000.120.200.260.300.30下列判断正确的是( )A .升高温度该反应的平衡常数K 减小B .20~40 s 内,v (N 2O 4)=0.004 mol·L -1·s -1 C .反应达平衡时,吸收的热量为0.30Q kJD .100 s 时再通入0.40 mol N 2O 4,达新平衡时N 2O 4的转化率增大5.在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)===2Z(g)ΔH<0,一段时间后达到平衡。