15蛋白质结构与功能
- 格式:ppt
- 大小:4.28 MB
- 文档页数:22


isg15蛋白结构摘要:1.ISG15蛋白简介2.ISG15蛋白的结构特征3.ISG15蛋白的功能与应用4.总结正文:ISG15蛋白是一种广泛存在于生物体内的蛋白质,其在细胞生物学、分子生物学等领域具有重要的研究价值。
本文将对ISG15蛋白的结构、功能及其应用进行详细介绍,以期为相关研究提供有益的参考。
一、ISG15蛋白简介ISG15(Interferon-stimulated gene 15)蛋白,又称为干扰素诱导基因15,是在干扰素作用下诱导产生的蛋白质。
ISG15蛋白广泛存在于哺乳动物、鸟类、昆虫等多种生物体内,其含量在不同物种和组织中有所差异。
二、ISG15蛋白的结构特征ISG15蛋白的结构特征是其保守的C端结构域,该结构域具有较高的氨基酸序列相似性。
ISG15蛋白的N端结构域具有较高的多样性,但功能相似。
通过对ISG15蛋白结构的分析,研究人员发现其具有以下特点:1.氨基酸序列保守:ISG15蛋白的C端结构域在不同物种间具有高度保守的氨基酸序列,有助于研究其功能和作用机制。
2.蛋白质结构稳定:ISG15蛋白的结构稳定,有利于其在细胞内发挥作用。
3.翻译后修饰:ISG15蛋白在翻译后可发生糖基化、泛素化等修饰,影响其功能和稳定性。
三、ISG15蛋白的功能与应用1.抗病毒作用:ISG15蛋白在抗病毒感染过程中发挥重要作用。
研究发现,ISG15蛋白可以通过多种途径抑制病毒复制,如直接作用于病毒蛋白、调节细胞信号通路等。
2.抗肿瘤作用:ISG15蛋白在抗肿瘤方面具有潜在的应用价值。
研究发现,ISG15蛋白可以抑制肿瘤细胞的增殖、迁移和侵袭,进而抑制肿瘤生长。
3.免疫调节作用:ISG15蛋白具有调节免疫功能的作用。
通过对免疫细胞的分化和活化,ISG15蛋白可以调节宿主对病毒、肿瘤等病原体的免疫应答。
4.应用前景:基于ISG15蛋白的抗病毒、抗肿瘤等生物学功能,研究人员正在开发相关药物和疫苗,以期为治疗病毒感染和肿瘤提供新的治疗手段。

蛋白质结构与功能的关系摘要:蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。
天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。
由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强!现而今关于蛋白质功能研究还有待发展,一门新兴学科正在发展,血清蛋白组学,生物信息学等!本文仅就蛋白质结构与其功能关系进行粗略阐述。
关键词:蛋白质分子一级结构、空间结构、折叠/功能关系、蛋白质构象紊乱症;分子伴侣正文:1、蛋白质分子一级结构和功能的关系蛋白质分子中关键活性部位氨基酸残基的改变,会影响其生理功能,甚至造成分子病(molecular disease)。
例如镰状细胞贫血,就是由于血红蛋白分子中两个β亚基第6位正常的谷氨酸变异成了缬氨酸,从酸性氨基酸换成了中性支链氨基酸,降低了血红蛋白在红细胞中的溶解度,使它在红细胞中随血流至氧分压低的外周毛细血管时,容易凝聚并沉淀析出,从而造成红细胞破裂溶血和运氧功能的低下。
另一方面,在蛋白质结构和功能关系中,一些非关键部位氨基酸残基的改变或缺失,则不会影响蛋白质的生物活性。
例如人、猪、牛、羊等哺乳动物胰岛素分子A链中8、9、10位和B链30位的氨基酸残基各不相同,有种族差异,但这并不影响它们都具有降低生物体血糖浓度的共同生理功能。
蛋白质一级结构与功能间的关系十分复杂。
不同生物中具有相似生理功能的蛋白质或同一种生物体内具有相似功能的蛋白质,其一级结构往往相似,但也有时可相差很大。
如催化DNA复制的DNA聚合酶,细菌的和小鼠的就相差很大,具有明显的种族差异,可见生命现象十分复杂多样。
2、蛋白质分子空间结构和功能的关系蛋白质分子空间结构和其性质及生理功能的关系也十分密切。
不同的蛋白质,正因为具有不同的空间结构,因此具有不同的理化性质和生理功能。
如指甲和毛发中的角蛋白,分子中含有大量的α-螺旋二级结构,因此性质稳定坚韧又富有弹性,这是和角蛋白的保护功能分不开的;而胶原蛋白的三股π螺旋平行再几股拧成缆绳样胶原微纤维结构,使其性质稳定而具有强大的抗张力作用又如细胞质膜上一些蛋白质是离子通道,就是因为在其多肽链中的一些α-螺旋或β-折叠二级结构中,一侧多由亲水性氨基酸组成,而另一侧却多由疏水性氨基酸组成,因此是具有“两亲性”(amphipathic)的特点,几段α-螺旋或β-折叠的亲水侧之间就构成了离子通道,而其疏水侧,即通过疏水键将离子通道蛋白质固定在细胞质膜上。


蛋白质结构与功能的关系蛋白质的结构包括一级结构、二级结构、三级结构、四级结构。
一级结构是蛋白质的一级结构指在蛋白质分子从N-端至C-端的氨基酸排列顺序。
一级结构是蛋白质空间构象和特异生物学功能的基础,但不是决定蛋白质空间构象的唯一因素。
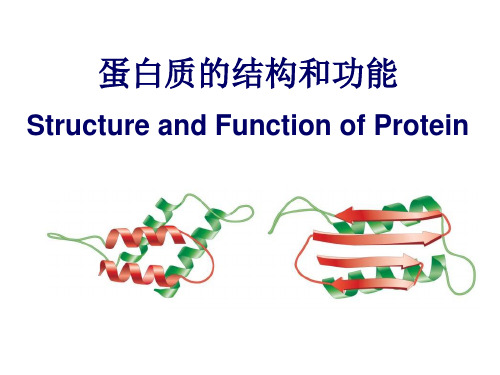
蛋白质的二级结构是指多肽链的主链骨架本身在空间上有规律的折叠和盘绕,它是由氨基酸残基非侧链基团之间的氢键决定的。
常见的二级结构有α螺旋、三股螺旋、β折叠、β转角、β凸起和无规卷曲。
α螺旋中肽链骨架围绕一个轴以螺旋的方式伸展,它可能是极性的、疏水的或两亲的。
β折叠是肽链的一种相当伸展的结构,有平行和反平行两种。
如果β股交替出现极性残基和非极性残基,那么就可以形成两亲的β折叠。
β转角指伸展的肽链形成180°的U形回折结构而改变了肽链的方向。
β凸起是由于β折叠股中额外插入一个氨基酸残基而形成的,它也能改变多肽链的走向。
无规卷曲是在蛋白质分子中的一些极不规则的二级结构的总称。
无规卷曲无固定走向,有时以环的形式存在,但不是任意变动的。
从结构的稳定性上看,右手α螺旋>β折叠> U型回折>无规卷曲,但在功能上,酶与蛋白质的活性中心通常由无规卷曲充当,α右手螺旋和β折叠一般只起支持作用。
蛋白质的三级结构是指多肽链在二级结构的基础上,进一步盘绕、卷曲和折叠,形成主要通过氨基酸侧链以次级键以及二硫键维系的完整的三维结构。
三级结构通常由模体和结构域组成。
稳定三级结构的化学键包括氢键、疏水键、离子键、范德华力、金属配位键和二硫键。
模体可用在一级结构上,特指具有特殊生化功能的序列模体,也可被用于功能模体或结构模体,相当于超二级结构。
结构模体是结构域的组分,基本形式有αα、βαβ和βββ等。
常见的模体包括:左手超螺旋、右手超螺旋、卷曲螺旋、螺旋束、α螺旋-环-α螺旋、Rossmann卷曲和希腊钥匙模体。
结构域是在一个蛋白质分子内的相对独立的球状结构和/或功能模块,由若干个结构模体组成的相对独立的球形结构单位,它们通常是独自折叠形成的,与蛋白质的功能直接相关。
蛋白质的结构及其功能蛋白质为生物高分子物质之一,具有三维空间结构,因而执行复杂的生物学功能。
蛋白质结构与功能之间的关系非常密切。
在研究中,一般将蛋白质分子的结构分为一级结构与空间结构两类。
一、蛋白质的一级结构蛋白质的一级结构(primary structure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。
它是由基因上遗传密码的排列顺序所决定的。
各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。
迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。
蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子。
二、蛋白质的空间结构蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。
蛋白质的生物学活性和理化性质主要决定于空间结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。
例如球状蛋白质(多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。
蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。
(一)蛋白质的二级结构蛋白质的二级结构(secondary structure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
1.肽键平面(或称酰胺平面,amide plane)。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X 线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知:(1)中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。
蛋白质结构与功能A型题1. 下列氨基酸中,其Cα不为不对称碳原子的是╳正确答案:AA. 甘氨酸B. 丙氨酸C. 异亮氨酸D. 酪氨酸E. 蛋氨酸2. 维持蛋白质一级结构的化学键主要是╳正确答案:BA. 离子键B. 肽键C. 次级键D. 氢键E. 二硫键3. 在pH为8.6的缓冲溶液中,下列哪种氨基酸带正电荷?╳正确答案:DA. 异亮氨酸B. 丙氨酸C. 酪氨酸D. 赖氨酸E. 蛋氨酸4. 下列关于蛋白质结构的叙述,错误的?╳正确答案:DA. 蛋白质的三级结构是单体蛋白质或亚基的空间结B. 蛋白质的空间结构主要靠次级键维持C. 蛋白质的一级结构在决定高级结构方面是重要因素之一D. 氨基酸的疏水侧链很少埋在分子的中心部位E. 带电荷的氨基酸侧链常在分子的外侧,面向水相5.蛋白质中多肽链形成β-折叠时,主要靠下列哪种键╳正确答案:DA. 二硫键B. 疏水键C. 离子键D. 氢键E. 范德华键6. 下列哪一类氨基酸只含非必需氨基酸╳正确答案:BA. 碱性氨基酸B. 酸性氨基酸C. 芳香氨基酸D. 分枝氨基酸E. 含S氨基酸7. 在PH6.0时,带正净电荷的氨基酸是╳正确答案:DA. 色氨酸B. 丙氨C. 谷氨酸D. 精氨酸E. 亮氨酸8. 蛋白质变性不引起下列哪种变化╳正确答案:EA. 生物学活性丧失B. 氢键断裂C. 疏水作用的破坏D. 亚基的解聚E. 分子量减小9. 蛋白质溶液pH在等电点时所带电荷╳正确答案:CA. 不带电荷B. 看蛋白含氨基酸种类而定,如碱性氨基酸多则带正电荷,酸性氨基酸多则带负电荷。
C. 带等量的正、负电荷D. 正电荷E. 负电荷10. 天然蛋白质中不存在的氨基酸是╳正确答案:AA. 鸟氨酸B. 丝氨酸C. 蛋氨酸D. 半胱氨酸E. 胱氨酸11. 将蛋白质溶液pH值调节到其等电点时╳正确答案:CA. 可使蛋白质表面的净电荷不变B. 可使蛋白质表面的净电荷增加C. 可使蛋白质稳定性降低,易于沉淀析出D. 对蛋白质无影响E. 可使蛋白质稳定性增加12.下列哪个是蛋白质二级结构的结构基础╳正确答案:AA. 肽单元B. α-螺旋C. 氢键D. 肽键E. 双螺旋13. 镰刀状红细胞贫血的发病机理为血红蛋白的╳正确答案:AA. β链碱基突变B. α链Glu→ValC. 一级结构的改变, 空间结构没变D. β链上Val→GluE. α链碱基突变14. 蛋白质中多肽链形成β-折叠时,主要靠下列哪种键╳正确答案:EA. 疏水键B. 二硫键C. 范德华键D. 离子键E. 氢键15. 能够参与合成蛋白质的氨基酸的构型为╳正确答案:AA. 除甘氨酸外均为L型B. 均只含α-氨基C. 除丝氨酸外均为L型D. 旋光性均为左旋E. 以上说法均不对16. 稳定蛋白质分子二级结构的化学键是╳正确答案:AA. 氢键B. 疏水键C. 二硫键D. 离子键E. 以上全对17. 蛋白质变性时不应出现的变化是╳正确答案:DA. 蛋白质的溶解度降低B. 蛋白质分子中各种次级键被破坏C. 失去原有的生理功能D. 蛋白质分子个别肽键被破坏E. 蛋白的天然构象破坏18. 血红蛋白和肌红蛋白都含有血红素辅基,前者输氧,后者贮氧。