金属和化合物化学方程式
- 格式:doc
- 大小:67.50 KB
- 文档页数:8

金属与金属化合物溶液的化学方程式
金属与金属化合物溶液是一种常见的化学反应,它可以用来制造各种金属化合物,如金属氧化物、金属氢化物和金属硫化物等。
金属与金属化合物溶液的化学方程式可以用来描述这种反应的化学变化。
金属与金属化合物溶液的化学方程式可以表示为:M + H2O → M(OH)2 + H2。
其中,M表示金属,H2O表示水,M(OH)2表示金属氧化物,H2表示氢气。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属氧化物和氢气。
金属与金属化合物溶液的化学方程式也可以用来描述金属与金属氢化物的反应,即M +
H2O → M(H2)2 + H2O。
其中,M表示金属,H2O表示水,M(H2)2表示金属氢化物,
H2O表示水。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属氢化物和水。
金属与金属化合物溶液的化学方程式还可以用来描述金属与金属硫化物的反应,即M +
H2O → M(S)2 + H2O。
其中,M表示金属,H2O表示水,M(S)2表示金属硫化物,H2O表示水。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属硫化物和水。
以上就是金属与金属化合物溶液的化学方程式,它可以用来描述金属与金属氧化物、金属氢化物和金属硫化物的反应。
这些反应可以用来制造各种金属化合物,为我们的生活提供便利。

铁及其化合物的化学方程式和离子方程式答案铁及其化合物的化学方程式和离子方程式总结铁是一种常见的金属元素,它在不同条件下可以与氧气、氯气、硫、水蒸气等反应。
其中,铁在氧气中燃烧的化学方程式为3Fe+2O2→2Fe3O4,而在氯气中燃烧的方程式为2Fe+3Cl2→2FeCl3.此外,常温条件下铁锈的形成是由4Fe+3O2+2H2O→2Fe2O3·H2O引起的。
氧化亚铁是铁的一种氧化物,它也可以与一氧化碳、铝粉等物质发生反应。
例如,氧化亚铁在空气中加热会发生6FeO +O2→2Fe3O4的反应,而与一氧化碳高温反应的方程式为FeO+CO→Fe+CO2.此外,氧化亚铁与铝粉在高温下反应的方程式为3FeO+2Al→Al2O3+3Fe。
铁和硫的共热反应的方程式为Fe+S→FeS,而铁和水蒸气在高温条件下反应的方程式为3Fe+4H2O→Fe3O4+4H2.铁还可以与稀硫酸、浓硫酸、稀硝酸、浓硝酸等酸性物质反应,生成不同的产物和离子。
例如,铁与稀硫酸反应的方程式为Fe+H2SO4→FeSO4+H2↑,而少量的铁与浓硝酸共热的方程式为Fe+6HNO3(浓)→Fe(NO3)3+3NO2↑+3H2O。
需要注意的是,有些段落中出现了格式错误和明显有问题的内容,需要删除或修改。
例如,第10段中的化学方程式和离子方程式之间的符号错误,需要进行修改。
铁的化学性质1.氢氧化亚铁与浓硫酸反应,生成二价铁离子和二氧化硫气体,反应式为:2Fe(OH)2 + 4H2SO4 → Fe2+ + 2H2O +4SO2↑。
2.氢氧化亚铁与浓硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:Fe(OH)2 + 4HNO3 → Fe2+ + 2NO↑ + 3H2O。
3.氢氧化亚铁与稀硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:3Fe(OH)2 + 10HNO3 → 3Fe2+ + 2NO↑ +8H2O。
4.氢氧化亚铁在空气中被氧化,生成三价铁离子和水,反应式为:4Fe(OH)2 + O2 + 2H2O → 4Fe3+ + 4OH^-。

高一必修一铁及其化合物的化学反应方程式
铁及其化合物是当今世界中相当重要的物质,自史前以来就被大量使用。
这种稀有金属由于其易于锻造及耐腐蚀而十分受人们欢迎,用于建造桥梁和房屋,也曾在很多国家发行货币。
铁在单质状态下是黑色的,与氧及其他元素化合会形成有色,重量较轻的化合物。
铁及其化合物的化学反应方程式主要有以下几种:
1、铁与硫化氢的反应:Fe + H2S → FeS + H2
2、铁与四氧化三铁的反应:Fe + Fe2O3 → 3FeO
3、铁与硫酸的反应:Fe + H2SO4 → FeSO4 + H2
4、铁与氧气的反应:4Fe + 3O2 → 2Fe2O3
5、铁与氧的反应:4Fe + 3O2 → 2Fe2O3
铁及其化合物在人们的生活中占据了非常重要的地位,它们可以高效地把资源转化为实用的物资。
通过上述化学反应方程式可以看出,铁与其他元素在反应中表现出了明显的不同性质。
实验表明,铁是一种非常可靠的建造材料,因此,它在建筑、桥梁、货币制作和发电等领域都有着极大的应用价值。

铁铜及其化合物重要方程式汇总金属及其化合物重要方程式汇总(三)铁、铜及其化合物1、铁与非金属单质反应:(1)Fe在纯O2中燃烧:化学方程式:;(2)Fe与S的反应:化学方程式:(3)Fe与Cl2点燃:化学方程式:;(4)Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。
原电池反应:负极:正极:总反应:后续反应:3、铁与酸反应:(1)与非氧化性酸①铁和稀盐酸:化学方程式:;②铁和稀硫酸:化学方程式:;离子方程式:;(2)与氧化性酸(与浓硫酸、稀硝酸、浓硝酸)①常温下,浓硫酸和浓硝酸会使、钝化,加热反应。
②铁与浓硫酸:化学方程式:;③铁与足量浓硝酸:化学方程式:;离子方程式:;④少量铁与稀硝酸:化学方程式:;离子方程式:;⑤过量Fe与稀硝酸:化学方程式:;离子方程式:;4.铁与盐溶液反应:(1)铁和氯化铜溶液:化学方程式:离子方程式:;(2)除去FeCl2溶液中的FeCl3:化学方程式:;离子方程式:;第1页,共2页5.Fe3O4粉末和稀盐酸:化学方程式:;离子方程式:;6.CO还原磁性氧化铁(工业炼铁):化学方程式:;7.CO还原氧化铁(工业炼铁):化学方程式:;8.氧化铁和Al做铝热剂的铝热反应:化学方程式:9.向FeCl2溶液中通Cl2:化学方程式:;离子方程式:;10.向Fe(NO3)2溶液中滴加稀硝酸:化学方程式:;离子方程式:;11.向硫酸亚铁溶液滴加过量氨水,生成白色沉淀,迅速变灰绿色,最终变成红褐色:生成白色沉淀化学方程式:;离子方程式:;白色沉淀迅速变灰绿色最终变成红褐色,化学方程式_______________________________12.用氯化铁溶液制作铜制印刷电路板:化学方程式:;离子方程式:;13.Fe3+和I-不能大量共存,离子方程式_____________________________________________14.Fe3+和S2-不能大量共存,离子方程式____________________________________________15.Fe3+的检验:(1)常用硫氰化钾溶液:离子方程式:;(2)高浓度时加氢氧化钠溶液:离子方程式:;16.Fe2+的检验:(1)常用:先滴加硫氰化钾溶液,观察后,再加氯水:现象:;化学方程式:①;②;离子方程式:①;②;(2)高浓度时可以加氢氧化钠溶液:现象:;化学方程式:①;②;(3)当Fe2+和Fe3+共存时,用酸性高锰酸钾,现象是_______________________配平离子方程式:Fe2++MnO4-+H+=Fe3++Mn2++H2O第2页,共2页。

常见金属非金属及其化合物的化学方程式好嘞,今天我们来聊聊那些常见的金属和非金属,还有它们的化合物。
这些东西可真是咱们日常生活中随处可见,搞得我一想到就忍不住想笑。
先说说金属吧,听起来高大上,其实它们在我们生活中可真是亲民啊。
比如说铁,咱们的“铁哥们”,不管是做成铁钉还是锅,都是陪伴着我们。
铁和氧气一旦碰上,哎呀,锈就来了,这可不是好事。
我们说“铁锈生锈”,这个道理大家都懂。
化学方程式上写成这样:4Fe + 3O₂ →2Fe₂O₃,听起来挺复杂,其实就是铁在空气中和氧气玩捉迷藏,最后变成了铁锈。
再说说铝,很多人都知道铝箔吧,包食物、烤东西,真是个好帮手。
铝和氧气结合成氧化铝,这可真是个有趣的过程。
化学方程式是4Al + 3O₂ → 2Al₂O₃。
铝在高温下和氧气反应,就像在炫技一样,真是个调皮捣蛋的小家伙。
然后是铜,铜的电线可是咱们家电的“命根子”。
铜和氧结合后也能产生氧化铜,这化学式写成2Cu + O₂ →2CuO。
真是简单明了,铜就像是在和氧气进行一场“贴贴”的游戏。
转过头来聊聊非金属,别看它们不如金属那样“闪闪发光”,其实也是个“厉害角色”。
像氯,这家伙可真调皮,单独一个氯气是绿色的,跟小绿人似的。
氯跟钠结合成氯化钠,就是咱们平常用的盐,听说过“盐能治百病”吧,这可不是说说而已。
氯和钠反应的方程式是2Na + Cl₂ → 2NaCl。
简简单单就把两个元素结合在一起,成就了咱们的美味。
还有硫,硫可是一位“火山之神”,在自然界中可是个大忙人。
硫和氧反应,生成了二氧化硫,这化学方程式是S + O₂ → SO₂。
听说这个东西一多就会造成酸雨,大家可得注意,别让它把咱们的屋顶给腐蚀了。
然后再说说碳,碳是个万用的元素,能跟很多东西“搭伙”。
比如说,碳和氧结合成二氧化碳,化学式是C + O₂ → CO₂。
这个小家伙可是我们呼吸时的“老朋友”,虽然有时候也被人说成“坏蛋”,但其实它在植物的光合作用中可是个“大功臣”。

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。

★☆钠及其重要化合物☆★一、金属钠1。
钠与氧气反应常温: 4Na + O2 = 2Na2O (白色)点燃: 2Na + O2Na2O2(淡黄色)或:2Na + O2Na2O2(淡黄色) 2。
钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3。
钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4。
钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5。
钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH— + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7。
钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH—2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、苏打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na2CO3 + HCl = NaHCO3 + NaClCO32— + H+ = HCO3-Na2CO3 + 2HCl = 2NaCl +CO2↑+ H2OCO32— + 2H+ = CO2↑+ H2O⑵碳酸钠溶液与足量醋酸反应Na2CO3+2CH3COOH=2CH3COONa+CO2↑+H2OCO32—+2CH3COOH=2CH3COO-+CO2↑+H2O⑶碳酸钠溶液中通入二氧化碳气体Na2CO3 + H2O + CO2 = 2NaHCO3CO32- + H2O + CO2 = 2HCO3-过量....CO2通入饱和..Na2CO3溶液:析出NaHCO3晶体*Na2CO3 + H2O + CO2 = 2NaHCO3↓2Na++CO32- + H2O + CO2 = 2NaHCO3↓⑷***碳酸钠溶液中通入二氧化碳气体*Na2CO3 + SO2 = Na2SO3 + CO2↑*Na2CO3 + H2O + 2SO2 = 2NaHSO3 + CO2↑2。

al及其化合物的化学方程式aluminum (Al)是一种常见的金属元素,化学符号为Al,原子序数为13。
它是一种轻质、耐腐蚀和导电性能良好的金属,广泛应用于工业和日常生活中。
在化学方程式中,Al通常以离子的形式存在,即Al3+。
Al3+是一种具有3个正电荷的阳离子,它与其他阴离子或分子结合形成化合物。
其中,最常见的化合物是氧化铝(aluminum oxide,Al2O3)。
氧化铝是一种白色固体,具有高熔点和高硬度,被广泛用作陶瓷材料、砂纸和研磨剂等。
氧化铝的化学方程式为:2Al + 3O2 → 2Al2O3这个方程式表示了氧化铝的合成反应,其中2个Al原子与3个O2分子反应生成2个Al2O3分子。
这个反应是一个氧化反应,Al原子失去电子形成Al3+离子,而氧气分子接受电子形成氧化物离子(O2-)。
Al2O3是一种离子化合物,其中Al3+离子和O2-离子通过离子键结合在一起。
Al还可以与非金属元素形成其他化合物,如与氯(Cl)形成氯化铝(aluminum chloride,AlCl3)。
氯化铝是一种白色晶体,具有强烈的吸湿性,可用作催化剂和制造其他化学品的原料。
氯化铝的化学方程式为:2Al + 3Cl2 → 2AlCl3这个方程式表示了氯化铝的合成反应,其中2个Al原子与3个Cl2分子反应生成2个AlCl3分子。
这个反应是一个氧化还原反应,Al 原子失去电子形成Al3+离子,而氯气分子接受电子形成氯离子(Cl-)。
AlCl3是一种离子化合物,其中Al3+离子和Cl-离子通过离子键结合在一起。
Al还可以与氧气和盐酸等物质反应生成不同的化合物。
例如,当Al 与氧气反应时,可以生成氧化铝(Al2O3),而当Al与盐酸反应时,可以生成氯化铝(AlCl3)。
这些化合物在工业生产和实验室研究中都有广泛的应用。
总结起来,Al及其化合物的化学方程式描述了Al原子与其他元素或化合物之间的反应过程,通过失去或接受电子形成不同的离子化合物。

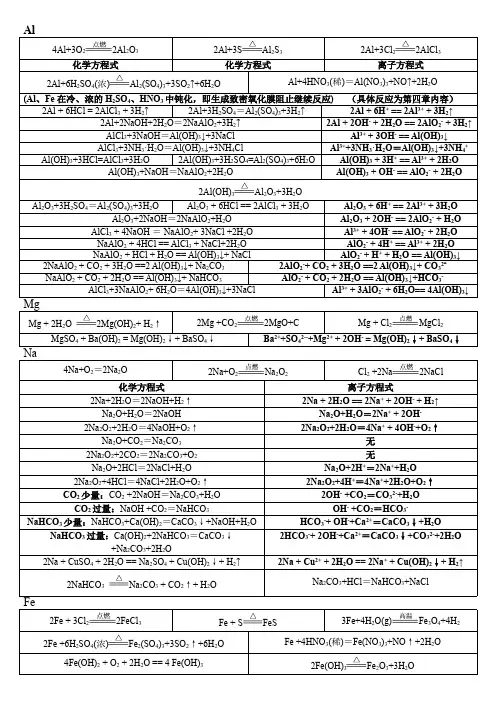
高中化学元素及化合物所有化学方程式非金属单质(F2 ;Cl2 ; O2 ; S; N2 ; P ; C ; Si)1;氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2;Cl2;Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23;(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化;加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热;浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二;金属单质(Na;Mg;Al;Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al;Fe在冷;浓的H2SO4;HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下;不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三;非金属氢化物(HF;HCl;H2O;H2S;NH3) 1;还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22;酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3;碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打;苏打)4;不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四;非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg;Ca;Ba;Na;K等燃烧的火灾) SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3;与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水;可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34;与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2;再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥;SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五;金属氧化物1;低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2;氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO;Al2O3几乎没有氧化性;很难被还原为Mg;Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3;与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4;与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷;稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六;含氧酸1;氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4;但浓;热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2;还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2;Br2;I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3;酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S;HI;HBr;(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4;不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七;碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OAl(OH)3+NH4Cl 不溶解3;不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八;盐1;氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22;还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43;与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4;与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35;不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。

高三化学金属及其化合物化学方程式大全在高三化学的学习中,金属及其化合物的化学方程式是非常重要的知识点。
熟练掌握这些方程式,对于理解化学反应的本质、解决化学问题以及在考试中取得好成绩都具有关键作用。
下面我们就来一起梳理一下常见的金属及其化合物的化学方程式。
一、钠及其化合物1、钠与氧气反应常温下:4Na + O₂= 2Na₂O加热时:2Na + O₂= Na₂O₂2、钠与水反应2Na + 2H₂O = 2NaOH + H₂↑3、钠与盐酸反应2Na + 2HCl = 2NaCl + H₂↑4、钠在空气中燃烧2Na + Cl₂= 2NaCl5、氧化钠与水反应Na₂O + H₂O = 2NaOH6、过氧化钠与水反应2Na₂O₂+ 2H₂O = 4NaOH + O₂↑7、过氧化钠与二氧化碳反应2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂8、碳酸钠与盐酸反应Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑9、碳酸氢钠与盐酸反应NaHCO₃+ HCl = NaCl + H₂O + CO₂↑10、碳酸氢钠受热分解2NaHCO₃= Na₂CO₃+ H₂O + CO₂↑11、碳酸钠溶液中通入二氧化碳Na₂CO₃+ H₂O + CO₂= 2NaHCO₃二、铝及其化合物1、铝与氧气反应4Al + 3O₂= 2Al₂O₃2、铝与盐酸反应2Al + 6HCl = 2AlCl₃+ 3H₂↑3、铝与氢氧化钠溶液反应2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑4、氧化铝与盐酸反应Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O5、氧化铝与氢氧化钠溶液反应Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O6、氢氧化铝与盐酸反应Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O7、氢氧化铝与氢氧化钠溶液反应Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O8、实验室制取氢氧化铝AlCl₃+ 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄Cl9、偏铝酸钠溶液中通入二氧化碳(少量)2NaAlO₂+ CO₂+ 3H₂O = 2Al(OH)₃↓ + Na₂CO₃偏铝酸钠溶液中通入二氧化碳(过量)NaAlO₂+ CO₂+ 2H₂O = Al(OH)₃↓ + NaHCO₃三、铁及其化合物1、铁与氧气反应3Fe + 2O₂= Fe₃O₄2、铁与盐酸反应Fe + 2HCl = FeCl₂+ H₂↑3、铁与硫酸铜溶液反应Fe + CuSO₄= FeSO₄+ Cu4、氧化亚铁与盐酸反应FeO + 2HCl = FeCl₂+ H₂O5、氧化铁与盐酸反应Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O6、四氧化三铁与盐酸反应Fe₃O₄+ 8HCl = FeCl₂+ 2FeCl₃+ 4H₂O 7、氯化亚铁溶液中通入氯气2FeCl₂+ Cl₂= 2FeCl₃8、氯化铁溶液中加入铁粉2FeCl₃+ Fe = 3FeCl₂9、氯化铁溶液中加入铜粉2FeCl₃+ Cu = 2FeCl₂+ CuCl₂10、氢氧化亚铁在空气中被氧化4Fe(OH)₂+ O₂+ 2H₂O = 4Fe(OH)₃11、氢氧化铁受热分解2Fe(OH)₃= Fe₂O₃+ 3H₂O四、铜及其化合物1、铜在空气中加热2Cu + O₂= 2CuO2、铜与硝酸反应(浓硝酸)Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O (稀硝酸)3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O 3、氧化铜与盐酸反应CuO + 2HCl = CuCl₂+ H₂O4、氢氧化铜受热分解Cu(OH)₂= CuO + H₂O5、硫酸铜溶液与氢氧化钠溶液反应CuSO₄+ 2NaOH = Cu(OH)₂↓ + Na₂SO₄掌握这些金属及其化合物的化学方程式,不仅需要死记硬背,更要理解反应的本质和规律。
金属及其化合物重要方程式汇总(一)钠及其化合物1.刚切开钠的断面很快变暗:化学方程式:;2.钠在空气中燃烧:化学方程式:;3.过量钠投入稀盐酸中:化学方程式:①;②;离子方程式:①;②;4.钠投入硫酸铜溶液中:化学方程式:;离子方程式:;5.氧化钠受热氧化:化学方程式:;6.氧化钠与二氧化碳:化学方程式:;7.氧化钠投入水中:化学方程式:;离子方程式:;8.氧化钠投入稀盐酸中:化学方程式:;离子方程式:;9.过氧化钠投入水中:化学方程式:;离子方程式:;10.呼吸面具中常用过氧化钠做供氧剂的原因:化学方程式:;11.向碳酸钠溶液中滴入几滴澄清石灰水:化学方程式:;离子方程式:;12.向碳酸钠溶液中滴入几滴氯化钡溶液:化学方程式:;离子方程式:;13.除去碳酸氢钠溶液中混有的少量碳酸钠:化学方程式:;离子方程式:;14.除去碳酸钠固体中混有的少量碳酸氢钠:化学方程式:;15.碳酸氢钠溶液与稀盐酸:化学方程式:;离子方程式:;16.碳酸氢钠溶液与烧碱:化学方程式:;离子方程式:;17.碳酸钠溶液与醋酸(CH3COOH)溶液:化学方程式:;离子方程式:;18.用大理石与稀盐酸制取二氧化碳:化学方程式:;离子方程式:;19.氢氧化钡溶液和稀硫酸:化学方程式:;离子方程式:;20.氢氧化钡溶液和硫酸铜溶液:化学方程式:;离子方程式:;21.向烧碱溶液中通入少量二氧化碳:化学方程式:;离子方程式:;22.向烧碱溶液中通入过量二氧化碳:化学方程式:;离子方程式:;23.向纯碱溶液中滴加几滴稀盐酸:化学方程式:;离子方程式:;24.向稀盐酸中滴加几滴纯碱溶液:化学方程式:;离子方程式:;25.碳酸氢钠与足量氢氧化钙溶液:离子方程式:26.碳酸氢钠与少量氢氧化钙溶液:离子方程式:(二)铝及其化合物1.表面被氧化的铝片溶于过量氢氧化钠溶液:化学方程式:①;②;离子方程式:①;②;2.表面被氧化的铝片溶于过量稀盐酸:化学方程式:①;②;离子方程式:①;②;3.制备氢氧化铝(1)往氯化铝溶液中加过量氨水:离子方程式:;(2)往偏铝酸钠溶液中通过量二氧化碳:离子方程式:;4.氢氧化铝受热分解:化学方程式:;5.铝盐的性质往氯化铝溶液中逐滴滴加烧碱溶液,先产生白色胶状沉淀,后沉淀逐渐溶解,最后得到无色透明溶液。
完整版)初三化学方程式大全化学资料以下是常见的化学元素和化合物的化学式:1.镁Mg、铁Fe、铜Cu、锌Zn、汞Hg;氦气He、氖气Ne、氩气Ar;氢气H2、氧气O2、氮气N2、氯气Cl2、臭氧O3、碳C、磷P、硫S2.水H2O、过氧化氢H2O2、一氧化碳CO、二氧化碳CO2、五氧化二磷P2O5、氧化钠Na2O、氧化镁MgO、氧化钙CaO、氧化铝Al2O3、二氧化锰MnO2、氧化铁Fe2O3、四氧化三铁Fe3O4、氧化亚铁FeO、氧化铜CuO、氧化汞HgO3.氯酸钾KClO3、高锰酸钾KMnO4、锰酸钾K2MnO4、氯化钠NaCl、硫酸H2SO4、硝酸HNO3、盐酸HCl、硫酸铜CuSO4、硫酸亚铁FeSO4、碳酸钠Na2CO3、硫酸钠Na2SO4、氢氧化铜Cu(OH)2、氢氧化钠NaOH化合价口诀和根的化合价:化合价口诀:一价氯氢钾钠银,二价氧钙镁钡锌,三铝四硅五价磷,一二铜汞二三铁,二四六硫二四碳,单质化合价为零。
根的化合价:铵根离子NH4+、碳酸根离子CO32-、高锰酸根离子MnO4-、锰酸根离子MnO42-、硝酸根离子NO3-、氯酸根离子ClO3-、硫酸根离子SO42-、氢氧根离子OH-金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au酸、碱和盐溶液组成、指示剂和pH:组成:酸H+ + 酸根离子、碱金属离子 + OH-、盐金属离子 + 酸根离子指示剂:酸溶液能使紫色石蕊溶液变红色,碱溶液能使紫色石蕊溶液变蓝色;酸溶液能使无色酚酞溶液不变色,碱溶液能使无色酚酞溶液变红色。
pH:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7.酸、碱和盐的溶解性:可溶于水的物质:NH4OH(挥发性)、KOH、NaOH、Ba(OH)2、Ca(OH)2、Mg(OH)2、Al(OH)3、Mn(OH)2、Zn(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2不易溶于水的物质:OH-、NH4+、CO32-、PO43-、SO42-、ClO3-、MnO4-、FeSO4、CuSO4、Na2SO4、Na2CO3以上是化学中常见的元素、化合物和相关知识点。
高中化学元素化合物化方程式汇总(一)金属及其化合物一、钠及其化合物(37)1.钠与氧气常温反应:4Na+O2=2Na2O(白色)2.钠与氧气加热反应:2Na+O2≜Na2O2(淡黄色)3.钠和水反应:2Na+2H2O=2NaOH+H2↑(2Na+2H2O=2Na++2OH-+H2↑)4.钠与硫酸铜溶液反应:{2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(不能置换出金属,先水后盐的原则)5.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑(2Na+ 2H+=2Na++H2↑)6.钠与氯气反应:2Na+Cl2点燃→2NaCl(白烟)7.钠与硫反应:2Na+S=Na2S8.氢化钠与水反应:NaH(s)+H2O=NaOH+H2↑9.氧化钠与水反应:Na2O+H2O=2NaOH10.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO311.氧化钠与盐酸溶液反应:Na2O+2HCl=2NaCl+H2O12.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑13.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O214.过氧化钠与盐酸溶液反应:2Na2O2+4HCl=4NaCl +2H2O+O2↑15.过氧化钠与氢气反应(“白吃”):Na2O2+H2氧气→2NaOH16.过氧化钠与一氧化碳反应(“白吃”):Na2O2+CO= Na2CO317.氢氧化钠与二氧化碳1:1反应:NaOH +CO2 =NaHCO318.氢氧化钠与二氧化碳2:1反应:2NaOH+CO2=Na2CO3+H2O19.氢氧化钠与二氧化碳反应(1:1与1:2总方):5NaOH+4CO2=3 NaHCO3+Na2CO3+H2O20.碳酸钠与水反应:CO32-+ H2O⇔HCO3-+OH-21.碳酸钠与少量酸反应:CO32-+H+= HCO3-22.碳酸钠与酸(1:1)反应:CO32-+H+= HCO3-23.碳酸钠与酸(1:2)反应:CO32-+2H+=H2O+CO2↑24.碳酸钠与氢氧化钠溶液反应:——25.碳酸钠与石灰水反应:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(CO32-+Ca2+=CaCO3↓)26.碳酸钠与氯化钡溶液反应:Na2CO3+BaCl2=2NaCl+BaCO3↓(CO32-+Ba2+=BaCO3↓)27.碳酸钠与二氧化碳反应:Na2CO3 +CO2+H2O =2NaHCO3↓28.碳酸氢钠与水反应:HCO3-+ H2O⇔H2CO3+OH-29.碳酸氢钠与盐酸溶液反应:NaHCO3+HCl=NaCl+H2O+CO2↑(HCO3-+H+=H2O+CO2↑)30.碳酸氢钠与氢氧化钠溶液反应:NaHCO3+NaOH=Na2CO3+H2O(HCO3-+OH-=CO32-+H2O)31.少量碳酸氢钠与石灰水反应:NaHCO3+ Ca(OH)2= NaOH+ CaCO3↓+H2O32.过量碳酸氢钠与石灰水反应:2NaHCO3+ Ca(OH)2= Na2CO3+ CaCO3↓+2H2O33.碳酸氢钠与氯化钡溶液反应:——34.碳酸氢钠与二氧化碳反应:——35.碳酸氢钠受热分解:2NaHCO3≜Na2CO3+H2O+CO2↑36.侯德榜制碱法:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓37.钠长期放在空气中的反应:Na+O2=Na2O+H2O→NaOH(固)+H2O→NaOH(液)+CO2→Na2CO3·10H2O→Na2CO3二、铝及其化合物(22)38.铝与水常温反应:2Al+6H2O= 2Al(OH)3+3H2↑39.铝与氧气加热反应:4Al+3O2≜2Al2O340.铝与氯气加热反应:2Al+3Cl2点燃→2AlCl341.铝与硫加热反应:2Al+3S≜Al2S342.铝与三氧化二铁反应:2Al+Fe2O3高温→2Fe+Al2O343.三硫化二铝与水:Al2S3+6H2O=2Al(OH)3↓+3H2S↓44.铝与盐酸溶液反应:2Al+6HCl=2AlCl3+3H2↑(2Al+6H+=2Al3++3H2↑)45.铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑)46.铝与稀硝酸溶液的钝化反应:Al+4HNO3(稀) =Al(NO3)3 + NO↑+ 2H2O47.铝离子与偏铝酸根反应:Al3++3AlO2-+6H2O= 4Al(OH)3↓48.铝离子与氢氧根(1:3)反应:Al3++3OH-=Al(OH)3↓49.铝离子与氢氧根(1:4)反应:Al3++4OH-=AlO2-+2H2O50.铝离子与水反应:Al3++ H2O= Al(OH)3↓(胶体)+3H+51.偏铝酸根与酸(1:1)反应:AlO2-+H++H2O= Al(OH)3↓52.偏铝酸根与酸(1:4)反应:AlO2-+4H+= Al3++2H2O53.氧化铝与盐酸溶液反应:Al2O3+6HCl=2AlCl3+3H2O (Al2O3+6H+=2Al3++3H2O)54.氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3+2OH-=2AlO2-+H2O)55.氢氧化铝与酸反应:Al(OH)3+3H+=Al3++3H2O56.氢氧化铝与碱反应:Al(OH)3+OH-=AlO2-+2H2O57.氢氧化铝的制备方法1:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4[Al23++3NH3·H2O=Al(OH)3↓+3NH4+]58.氢氧化铝的制备方法2:AlO2-+CO2+2H2O= Al(OH)3↓+ HCO3-2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-59.氢氧化铝受热分解:2Al(OH)3≜Al2O3+3H2O三、镁及其化合物(11)60.镁与氧气反应:2Mg+O2点燃→2MgO61.镁与二氧化碳反应:2Mg+CO2点燃→2MgO+C62.镁与氮气反应:3Mg+N2点燃→Mg3N263.二氮化三镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑64.镁与水反应:Mg+2H2O≜Mg(OH)2+H2↑65.镁与酸反应:Mg+2H+=Mg2++H2↑66.氧化镁与酸反应:MgO+2H+=Mg2++H2O67.镁离子与碱反应(氢氧化镁的制备):Mg2++2OH-=Mg(OH)2↓68.镁离子与氨水反应(氢氧化镁的制备):Mg2++2 NH3·H2O=Mg(OH)2↓+ 2NH4+69.氢氧化镁与酸反应:Mg(OH)2+2H+=Mg2++2H2O70.氢氧化镁受热分解:Mg(OH)2≜MgO+H2O四、铁及其化合物(24)71.铁与氧气反应:3Fe+2O2点燃→Fe3O472.铁与氯气反应:2Fe+3Cl2点燃→FeCl3(棕色烟)73.铁与硫反应:Fe+S≜FeS74.铁与酸反应:Fe+2H+=Fe2++H2↑75.铁与稀硝酸反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O76.铁与硝酸铁反应:Fe+ Fe(NO3)3=3Fe(NO3)277.过量铁与稀硝酸反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O注:序号为75、76是二次反应,77为这个二次反应的总方。
第三章金属及其化合物化学方程式(四)铜及其化合物1、铜分别与O2、Cl2、S、I2反应化学反应方程式:2Cu+O22CuO(黑色固体)Cu+Cl2CuCl2(棕黄色烟)2Cu+S Cu2S(黑色固体) 2Cu+I22CuI2、铜和浓硫酸反应化学方程式:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O3.铜和浓硝酸反应化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O4.铜和稀硝酸反应化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2N O↑+4H2O;离子方程式: 3Cu+8H++2NO3-= 3Cu2++2N O↑+4H2O5、铜与硝酸银溶液反应化学方程式:Cu+2AgNO3===Cu(NO3)2+2Ag离子方程式:Cu+2Ag+===Cu2++2Ag6、氯化铁溶液腐蚀印刷电路板化学方程式:Cu+2FeCl3=CuCl2+2FeCl2离子方程式:Cu+2Fe3+=Cu2++2Fe2+7、铜在空气中生锈化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。
8、Cu2(OH)2CO3(碱式碳酸铜、铜绿、孔雀石)受热分解化学方程式:Cu2(OH)2CO32CuO + H2O+ CO2↑9、碱式碳酸铜溶于盐酸化学方程式:Cu2(OH)2CO3+4HCl= 2Cu Cl2+3H2O+ CO2↑10、Cu2O在非氧化性酸中,不稳定,发生歧化反应化学方程式:Cu2O+H2SO4=CuSO4+Cu+H2O离子方程式:Cu2O+2H+=Cu2++Cu+H2O11、Cu2O溶于稀硝酸化学方程式: 3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O 离子方程式:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O12、Cu2S溶于稀硝酸化学方程式:3Cu2S +16HNO3(稀)=6Cu(NO3)2+3S+4NO↑+8H2O离子方程式:3Cu2S +16H++4NO3-=6Cu2++3S+4NO↑+8H2O13、CuS溶于稀硝酸化学方程式:3CuS + 8HNO3(稀)= 3S+3Cu(NO3)2+2NO↑+4H2O)离子方程式:3CuS +8H++2NO3- =3Cu2++3S +2NO↑+4H2O14、氧化铜氧化氨气化学方程式:3CuO+2NH33Cu+N2+3H2O15、氧化铜受热10000C以上分解化学方程式:4CuO 2Cu2O +O2↑16、SO2通入氯化铜溶液中反应离子方程式:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-17、将铜粉加入氯化铜溶液中反应离子方程式:Cu2++2Cl-+Cu= CuCl↓18、将KI溶液加入到氯化铜溶液中反应离子方程式:2Cu2++4l-= 2Cul↓+ l219、氢氧化铜溶于强酸离子方程式:Cu(OH)2+2H+=Cu2++2H2O20、氢氧化铜溶于氨水离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++ 2OH-+4H2O21、氢氧化铜受热分解化学方程式:Cu(OH)2 CuO+ H2O。
九年级上册化学必须记住的化学式和化学方程式化合价九年级上册化学必须记住的化学式以下是必须记住的单质和化合物的化学式:一、单质的化学式:(24个)1、氧气:O22、氮气:N23、氢气:H24、氯气:Cl25、固态非金属单质:碳:C、磷:P、硫:S、硅:Si6、稀有气体单质:氦:He、氖:Ne、氩:Ar7、金属单质:铁:Fe、铜:Cu、锌:Zn、铝:Al、银:Ag、镁:Mg、钡:Ba、金:Au、汞:Hg、钾:K、钙:Ca、锰:Mn、钠:Na二、化合物的化学式:(37个)1、氧化物:水:H2O、二氧化碳:CO2、过氧化氢:H2O2、二氧化锰:MnO2、一氧化碳:CO、二氧化硫:SO2、二氧化氮:NO2、氧化铜:CuO、氧化铁:Fe2O3、四氧化三铁:Fe3O4、氧化镁:MgO、氧化钙:CaO、五氧化二磷:P2O5、氧化铝:Al2O3、二氧化硅:SiO2、氧化汞:HgO、特殊:氨气:NH32、酸:硫酸:H2SO4、碳酸:H2CO3、盐酸:HCl、硝酸:HNO33、碱:氢氧化钠:NaOH、氢氧化钙:Ca(OH)2、氢氧化钾:KOH4、盐:氯化钠:NaCl、氯化钾:KCl、硫酸铜:CuSO4、碳酸钠:Na2CO3、氯酸钾:KClO3、高锰酸钾:KMnO4、锰酸钾:K2MnO4、碳酸钙:CaCO3、硫酸亚铁:FeSO4、硫酸铁:Fe2(SO4)35、有机物:甲烷:CH4、乙醇(俗名酒精):C2H5OH九年级上册化学必须记住的化学方程式(34个)以下是必须记住的化学方程式:1、镁燃烧:2Mg+O2→2MgO2、铁燃烧:3Fe+2O2→2Fe3O43、铝燃烧:4Al+3O2→2Al2O34、氢气燃烧:2H2+O2→2H2O5、红磷燃烧:4P+5O2→2P2O56、硫粉燃烧:S+O2→SO27、碳充分燃烧:C+O2→CO28、碳不充分燃烧:2C+O2→2CO9、一氧化碳不完全燃烧:2CO+O2→2CO210、一氧化碳燃烧:2CO+O2→2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O→H2CO3(溶液变红)12、生石灰溶于水:CaO+H2O→Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O→CuSO4·5H2O14、氢氧化钠和盐酸反应:XXX→NaCl+H2O15、氢氧化钠和硫酸反应:2NaOH+H2SO4→Na2SO4+2H2O16、氢氧化钙和盐酸反应:Ca(OH)2+2HCl→CaCl2+2H2O17、氢氧化钙和硫酸反应:Ca(OH)2+H2SO4→CaSO4+2H2O18、氢氧化钾和盐酸反应:XXX→KCl+H2O19、氢氧化钾和硫酸反应:XXX→K2SO4+2H2O20、氯化铁和氢氧化钠反应:FeCl3+3NaOH→Fe(OH)3+3NaCl21、氯化铜和氢氧化钠反应:CuCl2+2NaOH→Cu(OH)2+2NaCl22、硫酸铜和氢氧化钠反应:Cu SO4+2NaOH→Cu(OH)2+Na2SO423、硫酸铁和氢氧化钠反应:XXX→Fe(OH)2+Na2SO424、氯化钠和硫酸银反应:XXXNaNO325、氢氧化钡和硫酸反应:Ba(OH)2+H2SO4→BaSO4↓+2H2O26、氯化钾和硫酸反应:2KCl+H2SO4→K2SO4+2HCl27、碳酸钠和盐酸反应:Na2CO3+2HCl→2NaCl+H2O+CO228、碳酸钠和硫酸反应:Na2CO3+H2SO4→Na2SO4+H2O+CO229、氯酸钾和硫酸反应:KClO3+H2SO4→KHSO4+HClO330、高锰酸钾和盐酸反应:XXX→KCl+MnCl2+2H2O+Cl231、高锰酸钾和氢氧化钠反应:2KMnO4+2NaOH→K2MnO4+2MnO2+2H2O+O2↑32、二氧化碳通过灼热碳层:C+CO2→2CO33、硫酸和锌反应:Zn+H2SO4→ZnSO4+H2↑34、碳酸钙和盐酸反应:XXX→CaCl2+H2O+CO2↑1.实验室使用双氧水制取氧气,反应式为2H2O2 → 2H2O + O2.2.高锰酸钾加热反应,反应式为2KMnO4 → K2MnO4 + MnO2 + O2.3.水在直流电的作用下发生分解,反应式为2H2O → 2H2 + O2.4.碳酸不稳定,分解产生水和二氧化碳,反应式为H2CO3 → H2O + CO2.5.高温煅烧石灰石可以用于制取二氧化碳,反应式为CaCO3 → CO2 + CaO。
铁及其化合物的化学方程式一、铁的化学方程式1. 铁的氧化反应:2Fe(s) + O2(g) → 2FeO(s)2. 铁的还原反应:FeO(s) + CO(g) → Fe(s) + CO2(g)3. 铁的酸性氧化反应:Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)4. 铁的碱性氧化反应:Fe(s) + 2NaOH(aq) + H2O(l) → Na2FeO2(aq) + 2H2(g) 5. 铁的硫化反应:Fe(s) + S(s) → FeS(s)6. 铁的卤素化合物反应:Fe(s) + 2Br2(l) → FeBr4(s)二、铁的化合物化学方程式1. 氢化亚铁反应:FeCl2 + 2NaBH4 → FeB2H6 + 2NaCl + 2H22. 氢氧化铁反应:FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl3. 氢氧化铁沉淀反应:Fe2+ + 2OH- → Fe(OH)2Fe3+ + 3OH- → Fe(OH)34. 亚硫酸铁反应:FeSO4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O5. 碘化铁反应:FeSO4 + 2KI → FeI2 + K2SO46. 硫酸铁反应:FeS + H2SO4 → FeSO4 + H2S7. 硫酸铁氧化反应:4FeSO4 + O2 + 2H2SO4 → 2Fe2(SO4)3 + 2H2O8. 偏铁酸钾反应:2KFeO4 + H2SO4 → K2SO4 + Fe2O3 + H2O + O29. 铁氰化钾反应:FeCl2 + 2K4[Fe(CN)6] → Fe[Fe(CN)6] + 4KCl三、铁的物理性质铁的原子结构:铁元素的原子序数为26,电子布局为[Ar]3d6 4s2。
铁的晶体结构:铁的晶体结构属于针铁矿结构,每个铁原子周围都有六个氧原子形成八面体。
铁的颜色:铁的颜色为灰白色。
铁的密度:铁的密度为7.87g/cm³。
★☆钠及其重要化合物☆★一、金属钠1.钠与氧气反应常温:4Na + O2 = 2Na2O (白色)点燃:2Na + O2 Na2O2(淡黄色)或:2Na + O2 Na2O2 (淡黄色) 2.钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3.钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4.钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5.钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH- + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7.钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH-2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na2CO3 + HCl = NaHCO3 + NaClCO 32- + H + = HCO 3-Na 2CO 3 + 2HCl = 2NaCl +CO 2↑+ H 2OCO 32- + 2H + = CO 2↑+ H 2O⑵碳酸钠溶液与足量醋酸反应Na 2CO 3+2CH 3COOH=2CH 3COONa+CO 2↑+H 2OCO 32-+2CH 3COOH=2CH 3COO -+CO 2↑+H 2O ⑶碳酸钠溶液入二氧化碳气体Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3CO 32- + H 2O + CO 2 = 2HCO 3-过量..CO 2通入饱和..Na 2CO 3溶液:析出NaHCO 3晶体.. *Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3↓ 2Na ++CO 32- + H 2O + CO 2 = 2NaHCO 3↓ ⑷***碳酸钠溶液入二氧化碳气体*Na 2CO 3 + SO 2 = Na 2SO 3 + CO 2↑*Na 2CO 3 + H 2O + 2SO 2 = 2NaHSO 3 + CO 2↑2.碳酸钠与某些盐(CaCl 2、BaCl 2、AgNO 3、NaHSO 4)的反应Na 2CO 3+ CaCl 2=CaCO 3↓+2NaClCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ 2AgNO 3=Ag 2CO 3↓+2NaNO 3CO 32-+ 2Ag +=Ag 2CO 3↓*Na 2CO 3+ 2NaHSO 4=2Na 2SO 4+CO 2↑+H 2O CO 32-+ 2H +=CO 2↑+H 2O3.碳酸钠溶液与某些碱[Ca(OH)2、Ba(OH)2]溶液的反应Na 2CO 3+ Ca(OH)2=CaCO 3↓+2NaOHCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ Ba(OH)2=BaCO 3↓+2NaOHCO 32-+ Ba 2+=BaCO 3↓五、碳酸氢钠(小打)1.碳酸氢钠受热分解2NaHCO 3Na 2CO 3+H 2O+CO 2↑2.碳酸氢钠分别与盐酸、醋酸的反应NaHCO 3 + HCl = NaCl+CO 2↑+ H 2OHCO 3-+H+ =CO 2↑+H 2ONaHCO 3+CH 3COOH=CH 3COONa+CO 2↑+H 2O HCO 3-+CH 3COOH=CH 3COO -+CO 2↑+H 2O3.用饱和..NaHCO 3溶液除去CO 2中混有的SO 2气体:*2NaHCO 3 + SO 2 = Na 2SO 3 + 2CO 2↑+H 2O4.碳酸氢钠溶液与某些碱的反应NaHCO 3 + NaOH = Na 2CO 3 + H 2OHCO 3-+OH-=CO 32-+H 2O*** NaHCO 3溶液与Ca(OH)2溶液的反应: *a .足量NaHCO 3溶液与少量澄清石灰水时: 2NaHCO 3+Ca(OH)2=CaCO 3↓+Na 2CO 3+2H 2O 2HCO 3-+Ca 2++2OH -=CaCO 3↓+CO 32-+2H 2O*b.少量NaHCO3溶液与足量澄清石灰水时:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+2H2O5.碳酸氢钠与某些盐的反应NaHCO3 + NaHSO4 = Na2SO4 + CO2↑+H2OHCO3-+H+=CO2↑+H2O六、氢氧化钠(烧碱、火碱、苛性钠)1.氢氧化钠与酸性氧化物(CO2、SO2)的反应2NaOH + CO2 = Na2CO3 + H2O2OH- + CO2 = CO32- + H2ONa2CO3 + H2O + CO2 = 2NaHCO3CO32-+ H2O + CO2 = 2HCO3-总反应:NaOH + CO2 = NaHCO3OH- + CO2 = HCO3-2.氢氧化钠分别与盐酸、醋酸的反应NaOH +HCl =NaCl+ H2OOH-+H+=H2ONaOH + CH3COOH = CH3COONa+H2OOH- + CH3COOH = CH3COO-+H2O3.氢氧化钠与某些盐的反应2NaOH+CuSO4=Na2SO4+ Cu(OH)2↓2OH-+Cu2+=Cu(OH)2↓*** NaOH溶液与Ca(HCO3)2溶液的反应:*a.少量NaOH溶液与足量Ca(HCO3)2溶液时:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-=CaCO3↓+H2O*b.足量NaOH溶液与少量Ca(HCO3)2溶液时:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O七、氯化钠1.氯化钠与某些盐的反应NaCl+AgNO3=AgCl↓+ NaNO3Cl-+Ag+=AgCl↓2.氯化钠固体与浓硫酸反应NaCl + H2SO4(浓)NaHSO4+HCl↑2NaCl + H2SO4(浓)Na2SO4+2HCl↑3.电解熔融的氯化钠2NaCl(熔融)2Na+Cl2↑★☆镁及其重要化合物☆★1.镁与氧气反应2Mg + O22MgO(耀眼白光、大量白烟)2.镁与氯气反应Mg + Cl2MgCl23.镁与氮气反应3Mg + N2Mg3N24.镁与CO2反应2Mg + CO22MgO +C5.镁与H2O反应(与冷水很缓慢、与沸水较迅速反应)Mg + 2H2O = Mg(OH)2 +H2↑6.镁与盐酸反应Mg + 2HCl =MgCl2 +H2↑Mg + 2H+=Mg2+ +H2↑7.镁与某些盐的反应Mg + CuCl2 = MgCl2 + CuMg + Cu2+ = Mg2+ + Cu8.氧化镁与酸反应MgO + 2HCl =MgCl2 + H2OMgO + 2H+=Mg2+ + H2O9.氢氧化镁与酸反应Mg(OH)2 + 2HCl =MgCl2 + 2H2OMg(OH)2 + 2H+=Mg2+ + 2H2O10.氢氧化镁受热分解Mg(OH)2MgO + H2O11.氯化镁与碱反应⑴氯化镁溶液与氢氧化钠溶液反应MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaClMg2+ + 2OH- = Mg(OH)2↓⑵氯化镁溶液与氨水反应MgCl2 + 2NH3·H2O = Mg(OH)2↓+ 2NH4ClMg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+12.氯化镁与某些盐(Na2CO3)的反应MgCl2 + Na2CO3 = MgCO3↓+ 2NaClMg2+ + CO32- = MgCO3↓13.电解熔融的氯化镁MgCl2(熔融)Mg+Cl2↑★☆铝及其重要化合物☆★一、金属铝1.铝与氧气反应4Al + 3O22Al2O32.铝与氯气反应2Al + 3Cl22AlCl33.铝与硫的反应2Al + 3SAl2S34.铝热反应2Al+Fe2O3Al2O3+2Fe(剧烈反应,火星四射,有红热的熔融物生成)5.铝与强酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ = 2Al3+ + 3H2↑6.铝与强碱的反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑或:2Al+2NaOH+6H2O = 2Na[Al(OH)4] + 3H2↑2Al+2OH-+6H2O = 2[Al(OH)4]- + 3H2↑四羟基合铝酸钠7.铝与某些盐的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu2Al + 3Cu2+ = 2Al3+ + 3Cu二、氧化铝1.与强酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O2.与强碱反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O三、氢氧化铝1.Al(OH)3的两性:①与强酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O2.Al(OH)3的不稳定性: 受热易分解2Al(OH)3Al2O3+3H2O四、氯化铝1.氯化铝溶液与氢氧化钠溶液反应氢氧化钠不足时:AlCl3+3NaOH = Al(OH)3↓+3NaClAl3++3OH- = Al(OH)3↓氢氧化钠过量后:Al(OH)3+NaOH = NaAlO2+2H2OAl(OH)3+OH- = AlO2-+2H2O ☆总反应:AlCl3+4NaOH = NaAlO2+3NaCl +2H2OAl3++4OH- = AlO2-+2H2O2.氯化铝溶液与氨水反应AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4ClAl3++3NH3·H2O=Al(OH)3↓+ 3NH4+3.氯化铝溶液与偏铝酸钠溶液反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓五、偏铝酸钠1.偏铝酸钠溶液与盐酸的反应盐酸不足时:NaAlO2+HCl+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓盐酸过量后:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O☆总反应:NaAlO2+4HCl=AlCl3+NaCl +2H2OAlO2-+4H+=Al3++2H2O2.偏铝酸钠溶液与CO2的反应NaAlO2溶液入少量CO2气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-NaAlO2溶液入过量CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-3.偏铝酸钠溶液与氯化铝溶液的反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓六、硫酸铝钾—KAl(SO4)2——复盐明矾:KAl(SO4)2·12H2O(十二水合硫酸铝钾)明矾净水:溶于水时产生Al(OH)3胶体,能吸附水中悬浮的杂质而沉淀。