高等工程热力学
- 格式:ppt
- 大小:4.89 MB
- 文档页数:2

高等工程热力学教案一、教学目标1.掌握高等工程热力学的基本概念和基本原理。
2.理解热力学系统和热力学过程的基本特征。
3.掌握热力学第一定律和第二定律的表述和应用方法。
4.能够应用热力学知识解决实际工程问题。
二、教学内容1.高等工程热力学简介(1)高等工程热力学的定义和研究对象。
(2)热力学系统的基本概念和分类。
(3)热力学平衡和非平衡态。
2.热力学基本概念和基本原理(1)热力学过程和过程的分类。
(2)内能和焓的概念及其性质。
(3)热力学第一定律的表述和应用。
(4)克拉珀龙方程和基尔霍夫循环定理。
3.熵和热力学第二定律(1)熵的引入和熵增定理。
(2)热力学第二定律的表述和应用。
(3)熵的计算方法和热力学性能的描述。
4.理想气体和理想气体混合物的热力学性质(1)理想气体状态方程和气体定律。
(2)理想气体的内能、焓和熵的计算方法。
(3)理想气体混合物的理论计算方法。
5.热力学循环和工质使用(1)热力学循环的分类和性能参数。
(2)理想循环和实际循环。
(3)工质选择和工质性能参数。
三、教学方法1.理论讲授:通过课堂讲解,将高等工程热力学的基本概念、基本原理和应用方法传授给学生。
2.实例分析:提供一些实际工程问题,并引导学生应用热力学知识解决问题,加强实际应用能力的培养。
3.讨论引导:组织学生开展小组讨论,让学生在讨论中相互启发,共同思考和解决问题。
四、教学工具1.讲义和教材:准备高等工程热力学的讲义和教学参考教材,便于学生学习和复习。
2.多媒体设备:利用多媒体设备播放示意图、实验视频等,直观地展示热力学原理和实验过程。
3.计算工具:提供计算软件或计算器,方便学生进行数值计算。
五、教学过程1.导入:通过提问和讲解,引入高等工程热力学的概念和研究对象。
2.知识讲解:逐步讲解热力学的基本概念、基本原理和应用方法。
3.实例分析:提供一些实际工程问题,引导学生应用热力学知识解决问题。
4.小组讨论:组织学生进行小组讨论,让学生相互启发、共同思考和解决问题。


高等工程热力学介绍热力学是研究能量转化和热效应的科学。
而高等工程热力学则是在原有的基础上针对工程领域的应用进行深入研究的学科。
本文将介绍高等工程热力学的基本概念、原理和应用,以及相关的一些实例。
热力学基本概念热力学的基本概念有热力学系统、热力学过程、热力学性质等。
一个热力学系统是指进行能量交换的物理系统,可以是封闭系统、开放系统或者孤立系统。
热力学过程是指系统从一种状态变换到另一种状态的过程,可以是等温过程、绝热过程、等压过程等。
热力学性质是指描述热力学系统的特性,比如温度、压力、体积等。
热力学原理高等工程热力学基于热力学原理进行研究。
其中,热力学第一定律是能量守恒原理,它表明能量不能被创造或者毁灭,只能从一种形式转换为另一种形式。
热力学第二定律是能量传递的方向性原理,它表明热量自然地从高温物体流向低温物体,而不会反向流动。
熵增原理是热力学第二定律的数学表述,它描述了系统熵的增加趋势。
熵是一个衡量系统有序程度的指标,它的增加代表了能量的不可逆损失。
高等工程热力学应用高等工程热力学的应用十分广泛,涉及到多个工程领域。
以下是一些常见的应用实例:热力学循环分析高等工程热力学经常用于分析热力学循环,如蒸汽动力循环、制冷循环等。
通过对循环中各个组成部分的能量转换和损失进行研究,可以优化循环的效率和性能。
热传导计算在工程中,热传导是一个重要的问题。
高等工程热力学可以通过研究热传导的原理和机制,优化工程中的热传导问题,提高热传导的效率。
热力学系统优化通过对热力学系统进行优化设计,可以提高能量转换效率,降低能量消耗。
高等工程热力学可以通过分析系统的热力学性质,找到最优化的设计方案。
新能源开发高等工程热力学也可以应用于新能源的开发。
通过对新能源的高温特性、热力学性质进行研究,可以优化新能源的利用方式,提高能源利用效率。
结论高等工程热力学是热力学在工程领域中的应用和发展。
它通过研究热力学原理和原理的应用,优化工程中的能量转换和热效应问题。



《高等工程热力学》课程教学大纲课程编号:学分: 3 总学时:54大纲执笔人:杜爱民大纲审核人:一、课程性质与目的二、课程基本要求三、课程基本内容大纲内容及学时分配:第一章绪论(4学时)高等工程热力学课程的背景知识、热力学的发展史;介绍课程性质、课程主要内容、课程的基本要求等,复习基本概念。
第二章温度与热力学第零定律(4学时)温度测量与温标概念,热力学第零定律与国际温标(ITS-90)。
第三章热力学第一定律(4学时)热力学基本概念、热力学第一定律、系统的能量的概念、热力学第一定律的应用。
第四章热力学第二定律与熵(4学时)卡诺原理、热力学第二定律、热力学温标与熵、孤立系统熵增原理、能量贬值原理、极值原理、亥姆霍兹函数与吉布斯函数。
第五章火用与能量分析(6学时)火用与能、能分析与火用分析、热量火用与冷量火用、稳流工质的物理火用与焓火用第六章纯净流体的热力学性质(4学时)热力学曲面与相图、流体的比体积、维里方程、三次型状态方程、其他状态方程、压缩因子的通用化关联、固定组元物质的热力学微分关系式、热力学微分关系式的推导方法、纯净流体热力性质的计算。
第七章均匀混合物系的热力性质(4学时)变组元均匀混合物系的热力学基本关系式、气体混合物的热力性质、混合物中组元的逸度和逸度系数、液体混合物的热力性质、理想溶液、非理想溶液、活度与活度系数、二元混合物的相依性、浓溶液与稀溶液、混合过程热力参数的变化第八章多元系的相平衡(自学)相平衡概述、二元互溶系气液平衡相图。
第九章化学热力学基础(8学时)热力学第一定律应用于化学反应、化学平衡、反应平衡时理想气体的热容、多个反应的平衡、燃料的化学火用,、燃料电池、热力学第三定律等考试(2学时)四、实验或上机内容五、前修课程要求六、学时分配七、教材与主要参考书。


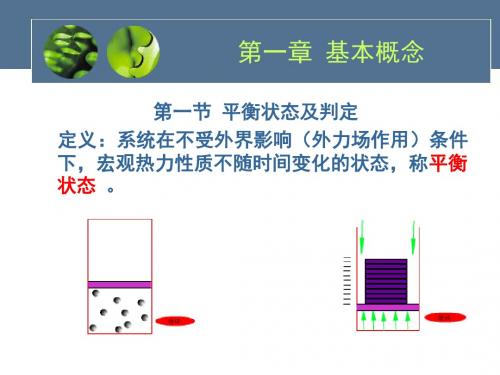
高等工程热力学第一讲热力学绪论工程热力学的研究内容与意义三个基本研究物理量:温度——研究热现象引进的物理量平衡态与可逆过程——经典热力学的研究前提。
第二讲本科基本概念复习第三讲热力学定律简述四个热力学定律的内容,并说明各个定律对热力学研究发展的重要性。
热力学第零定律1931年T热力学第一定律1840~1850年E热力学第二定律1854~1855年S热力学第三定律1906年S基准1、温度与热力学第零定律温度与热量的区别与联系分析几类温标,相互之间的联系∙热力学温标(绝对温标)Kelvin scale(Britisher, L. Kelvin, 1824-1907)∙摄氏温标Celsius scale (Swedish, A.Celsius, 1701-1744)∙华氏温标Fahrenheit scale (German,G. Fahrenheit, 1686-1736)∙朗肯温标Rankine scale (W. Rankine,1820-1872)2、能量与热力学第一定律计算3、熵与热力学第二定律孤立系统熵增原理计算火用的计算:1) 热量火用、冷量火用、热力学能火用、焓火用2) 封闭系统的火用平衡方程、稳定流动系统的火用平衡方程4、熵的基准与热力学第三定律第四讲纯净流体的热力学性质1、纯净流体的热力学曲面和相图;2、纯净流体的状态方程式;1)分析实际气体与理想气体之间的宏观与微观差别;2)介绍几类实际气体状态方程以及其相应的适用条件;3、纯净流体的热力学关系式;热力学一般关系式1)4个热力学基本方程(吉布斯方程)意义:是重要的热力学基本方程式,将简单可压缩系在平衡状态发生微变化时各种参数的变化联系起来。
2)偏导数关系和麦克斯韦关系式3)热力学微分关系式的推导方法 (1)数学基础:(2)偏导数的一般推导过程和数学技巧:du Tds pdvdh Tds vdpdf sdT pdv dg sdT vdp=-=+=--=-+热力学恒等式()()()()()()v p s T v p s T u h T s s u fp v v f gs T T h gv p p ∂∂⎛⎫⎛⎫== ⎪ ⎪∂∂⎝⎭⎝⎭∂∂==-∂∂∂∂==-∂∂∂∂==∂∂偏导数关系()()()()()()()()s v s pT vT pTp v s T v p s s p v T s v p T ∂∂=-∂∂∂∂=∂∂∂∂=∂∂∂∂=∂∂麦克斯韦关系式()()1z z x yy x ∂∂=∂∂ 倒数式循环关系式((()1z x y x y zy z x ∂∂∂=-∂∂∂链式关系式()()()1w w w x y zy z x∂∂∂=∂∂∂不同下标关系式()((()z y w z x x x y w w y w∂∂∂∂=+∂∂∂∂du Tds pdv dh Tds vdp df sdT pdvdg sdT vdp=-=+=--=-+热力学恒等式4)熵、焓和热力学能的一般关系式4、 纯净物热力性质的计算。




1、简述温度的定义、物理意义及温度测量的工程应用意义。
温度是表征物体冷热程度的物理量,是物质微粒热运动的宏观体现。
根据热力学第零定律说明,物质具备某种宏观性质,当各物体的这一性质不同时,它们若相互接触,其间将有净能流传递;当这一性质相同时,它们之间达到热平衡。
人们把这一宏观物理性质称为温度。
物理意义:从微观上看,温度标志物质分子热运动的剧烈程度。
温度和热平衡概念直接联系,两个物系只要温度相同,它们间就处于热平衡,而与其它状态参数如压力、体积等的数值是否相同无关,只有温度才是热平衡的判据。
温度测量的工程应用意义:温度是用以判别它与其它物系是否处于热平衡状态的参数。
被测物体与温度计处于热平衡,可以从温度计的读书确定被测物体的温度。
2简述热与功的联系与区别区别:功是系统与外界交换的一种有序能,有序能即有序运动的能量,如宏观物体(固体和流体)整体运动的动能,潜在宏观运动的位能,电子有序流动的电能,磁力能等。
在热力学中,我们这样定义功:“功是物系间相互作用而传递的能量。
当系统完成功时,其对外界的作用可用在外间举起重物的单一效果来代替。
”一般来说,各种形式的功通常都可以看成是由两个参数,即强度参数和广延参数组成,功带有方向性。
功的方向由系统与外界的强度量之差来决定,当系统对外界的作用力大于外界的抵抗力时,系统克服外界力而对外界做功。
功的大小则由系统与外界两方的较小强度量的标值与广延量的变化量的乘积决定,而功的正号或负号就随广延量的变化量增大或减小而自然决定。
热量是一种过程量,在温差作用下,系统以分子无规则运动的热力学能的形式与外界交换的能量,是一种无序热能,因此和功一样热量也可以看成是由两个参数,即强度参数和广延参数组成的量。
传递热量的强度参数是温度,因此有温差的存在热量传递才可以进行。
热量的大小也可以由系统的与外界两方的较小强度量的标量与广延量变化量的乘积决定。
热量也有方向性。
热量的方向由系统与外界的温度之差来决定,当外界的温度高于系统的温度时,外界对系统传热。
