最新国家食品药品监督管理局药物临床试验机构资格认定公告-汇总
- 格式:doc
- 大小:440.00 KB
- 文档页数:60

国家食品药品监督管理总局关于公开征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知文章属性•【公布机关】国家食品药品监督管理总局•【公布日期】2015.07.23•【分类】征求意见稿正文国家食品药品监督管理总局关于公开征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知为了加强和规范医疗器械临床试验管理,控制试验风险,保护受试者及相关人员权益和生命安全,保证临床试验的科学性和可靠性,根据《医疗器械监督管理条例》,国家食品药品监督管理总局起草了《医疗器械临床试验机构资质认定管理办法》(征求意见稿),现向社会公开征求意见。
有关单位和公众可通过以下途径和方式提出反馈意见:1.登录中国政府法制信息网(网址:),进入首页左侧的“部门规章草案意见征集系统”提出意见。
2.通过信函方式将意见寄至:北京市西城区宣武门西大街26号院2号楼(邮编100053)国家食品药品监督管理总局法制司,并在信封上注明“《医疗器械临床试验机构资质认定管理办法》征求意见”字样。
3.通过电子邮件方式将意见发送至:*************.cn,邮件主题请注明“《医疗器械临床试验机构资质认定管理办法》征求意见”字样。
4.通过传真方式将意见传至:************。
意见反馈截止时间为2015年8月22日。
医疗器械临床试验机构资质认定管理办法(征求意见稿)第一章总则第一条为了加强和规范医疗器械临床试验管理,控制试验风险,保护受试者及相关人员权益和生命安全,保证临床试验的科学性和可靠性,根据《医疗器械监督管理条例》制定本办法。
第二条国家对医疗器械临床试验机构实行资质认定制度。
资质认定分为首次资质认定、增加专业资质认定和延续资质认定三种情形。
第三条医疗器械临床试验机构资质认定(以下简称资质认定)是指资质认定管理部门依照法定要求对申请承担医疗器械临床试验的医疗机构(以下简称申请机构)所具备的医疗器械临床试验实施条件、组织管理能力、伦理审查能力等进行系统评价,做出其是否具有承担医疗器械临床试验资质的决定过程。

国家市场监管总局关于发布《特殊医学用途配方食品注册临床试验现场核查要点及判定原则》的公告
文章属性
•【制定机关】国家市场监督管理总局
•【公布日期】2024.10.24
•【文号】国家市场监管总局公告2024年第48号
•【施行日期】2024.10.24
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】食品安全
正文
总局公告
2024年第48号
关于发布《特殊医学用途配方食品注册临床试验
现场核查要点及判定原则》的公告为进一步规范特殊医学用途配方食品注册临床试验现场核查工作,依据《特殊医学用途配方食品注册管理办法》《特殊医学用途配方食品临床试验质量管理规范》,市场监管总局制定了《特殊医学用途配方食品注册临床试验现场核查要点及判定原则》,现予公告,自发布之日起施行。
市场监管总局
2024年10月24日。

综合法律门户网站国家食品药品监督管理总局关于药物临床试验数据自查情况的公告按照国家食品药品监督管理总局《关于开展药物临床试验数据自查核查工作的公告》(2015年第117号)要求,药物临床试验数据自查和报告工作于2015年8月25日24时结束。
现将自查结果公告如下:一、本次药物临床试验自查涉及1622个品种。
其中,申请人提交自查资料的注册申请为1094个,占 67%;主动撤回的注册申请317个,占20%;申请减免临床试验等不需要提交的注册申请193个,占12%。
二、申请人既未提交自查资料也未主动撤回的注册申请10个,分别是:北京银建药业有限公司申报的盐酸舍曲林分散片(受理号:CXHS1000009)、北京国医堂制药有限公司申报的强龙益肾片(受理号:CXZS0600096)、湖南星剑药业集团有限公司申报的降糖宁片(受理号:CXZS0601661)、江苏延申生物科技股份有限公司申报的纯化甲型肝炎灭活疫苗(Vero细胞)(受理号:CXSS0700056、CXSS0700057)、华兰生物工程(苏州)有限公司申报的人免疫球蛋白(受理号:CXSS0800010、CXSS0800011)、南通慧英药业有限公司申报的罗红霉素片(受理号:CYHS0690372)、陕西金维沙药业有限公司申报的通脉片(受理号:CXZS0504345)、中国高科集团有限公司和重庆西南合成制药有限公司申报的陀螺银屑胶囊(受理号:CXZS0502251,烟台中洲制药有限公司已退出申报)。
上述品种视为临床试验真实性存疑,依据《药品注册管理办法》第一百五十四条有关规定,国家食品药品监督管理总局对其注册申请不予批准。
三、多个申请人共同申报但撤回意见不一致的注册申请8个,分别是:金草止咳口服液(受理号:CXHS1000009),北京长城制药厂申请撤回,北京万业工贸发展有限公司不同意撤回;富马酸卢帕他定片(受理号:CXHS0900004)和富马酸卢帕他定胶囊(受理号:CXHS0900005),南京恒生制药有限公司和江苏万川医疗健康产业集团有限公司(原南京万川医疗科技发展有限公司)申请撤回,北京福瑞康正医药技术研究所和西藏天行生物药业有限公司未回复;盐酸美金刚口服溶液(受理号:CXHS1000119),烟台荣昌制药有限公司申请撤回,北京万全阳光医疗器械有限公司(原北京德众万全医药科技有限公司)不同意撤回;阿折地平胶囊(受理号:CXHS1100259)、匹伐他汀钙胶囊(受理号:CXHS1100261)、米格列奈钙胶囊(受理号:CXHS1200075),迪沙药业集团申请撤回,珠海亿邦制药股份有限公司未回复;注射用重组抗肿瘤坏死因子α人鼠嵌合单克隆抗体(受理号:CXSS1200005),上海百迈博制药有限公司申请撤回,上海张江生物技术有限公司不同意撤回。

医疗机构所在地医疗机构名称广东爱尔眼科医院广东东莞市人民医院广东东莞市人民医院广东佛山市第一人民医院(中山大学附属佛山医院)广东佛山市顺德区第一人民医院广东佛山市中医院广东广东省第二人民医院广东广东省第二中医院广东广东省第二中医院广东广东省妇幼保健院(广东省妇产医院、广东省儿童医院)广东广东省人民医院广东广东省人民医院广东广东省中医院(广州中医药大学第二附属医院)广东广东药科大学附属第一医院(广东药学院附属第一医院)广东广东医学院附属医院广东广西医科大学第一附属医院广东广州军区广州总医院广东广州市第八人民医院广东广州市第一人民医院广东广州市第一人民医院广东广州市番禺区中心医院(广州市番禺区人民医院)广东广州市番禺区中心医院(广州市番禺区人民医院)广东广州市妇女儿童医疗中心广东广州市红十字会医院广东广州市精神病医院(广州市脑科医院)广东广州市中医医院广东广州医科大学附属第五医院广东广州医科大学附属第五医院广东广州医学院第二附属医院广东省国家食品药品监督管理 根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试临床试验机构资格并颁发证书,现予以公告。
至2017年12月广东广州医学院第二附属医院广东广州医学院第三附属医院广东广州医学院第一附属医院广东广州医学院第一附属医院广东广州中医药大学第一附属医院广东广州中医药大学第一附属医院广东广州中医药大学附属骨伤科医院广东暨南大学附属第一医院广东江门市五邑中医院广东南方医科大学第三附属医院广东南方医科大学南方医院广东南方医科大学南方医院广东南方医科大学珠江医院广东汕头大学-香港中文大学联合汕头国际眼科中心广东汕头大学医学院第二附属医院广东汕头大学医学院第二附属医院广东汕头大学医学院第一附属医院广东汕头大学医学院附属肿瘤医院广东汕头市中心医院广东深圳市第三人民医院广东深圳市东湖医院广东深圳市儿童医院广东深圳市康宁医院广东深圳市人民医院(暨南大学第二临床医学院)广东深圳市中医院广东香港大学深圳医院广东中山大学附属第二医院广东中山大学附属第六医院广东中山大学附属第三医院广东中山大学附属第三医院广东中山大学附属第五医院广东中山大学附属第五医院广东中山大学附属第一医院广东中山大学附属第一医院广东中山大学附属第一医院广东中山大学孙逸仙纪念医院广东中山大学中山眼科中心(中山大学附属眼科医院)广东中山大学肿瘤防治中心广东中山大学肿瘤防治中心广东中山市博爱医院(中山市妇幼保健院)广东中山市人民医院(中山大学附属中山医院)广东中山市中医院广东省广州医学院附属肿瘤医院广东省深圳市第二人民医院督管理局认定药物临床试验机构汇总表(至2017年12月)临床试验机构资格认定办法(试行)》,经资料审查和现场检查,具备承担药物月认定专业眼科心血管、神经内科肿瘤、内分泌、呼吸内科、医学影像(诊断)、肾病、消化内科、放射治疗感染、肾病、神经内科、呼吸、肿瘤、心血管、消化心血管内科、肾病、内分泌、呼吸内科、肿瘤、血液内科、感染性疾病、普通外科中医神经内科、中医肿瘤、中医内分泌、中医骨伤血液病、风湿与临床免疫、肿瘤内科、神经内科、心血管内科、器官移植中医心血管、中医神经内科、中医消化、中医骨伤中医呼吸、中医内分泌、中医肿瘤、中医妇科妇科、产科、小儿呼吸、中医儿科、普通外科、麻醉、生殖健康与不孕症心血管、肿瘤、皮肤、风湿免疫、呼吸、内分泌、血液、烧伤、肾病、医学影像(诊断)专业神经内科、消化、麻醉、耳鼻喉科、小儿呼吸、感染、精神、普通外科中医眼科、中医消化、中医外科、中医骨科、中医妇科、中医肛肠、中医皮肤、中医心血管、中医神经内科、中医呼吸、中医肾病、中医内分泌、中医肿瘤、中医耳鼻咽喉、中医儿科、心血管内科、消化内科、神经内科、免疫、老年病、肾病、口腔、肿瘤、康复医学、中医老年病肾病、心血管、肿瘤、消化、神经内科、普通外科、呼吸、皮肤、麻醉心血管、内分泌、消化、血液、皮肤、耳鼻咽喉、感染、神经内科、肾病、烧伤、呼吸、骨科、泌尿、眼科专业心血管、消化、呼吸、神经内科、肿瘤、血液、麻醉、皮肤艾滋、肝病消化、呼吸、心血管、肾病、血液、神经内科、妇产、麻醉、皮肤、烧伤、骨科、泌尿普外科、神经外科、耳鼻喉、风湿免疫、内分泌、老年心血管、重症医学、肿瘤、精神心理、疼痛、中医脑血管妇科、呼吸、消化、心血管、血液、肿瘤内分泌妇科、小儿呼吸、小儿消化、小儿普通外科、小儿胸心外科、小儿血液、小儿神经病学心血管、内分泌、消化、呼吸、烧伤精神、戒毒中医肿瘤、中医心血管、中医神经内科、中医消化、中医骨科肿瘤、康复医学、神经内科、呼吸内科、肾内科泌尿外科神经内科、心血管、风湿免疫、麻醉、医学影像(诊断)血液、呼吸、普通外科、神经外科、泌尿、皮肤、变态反应妇产、骨科、心血管、肿瘤、神经内科、呼吸、内分泌、肾病呼吸心血管、神经内科、妇产、胸外科、普通外科、肿瘤、泌尿、中医呼吸中医骨科、中医消化、中医外科、中医肛肠、中医妇科、中医眼科、中医肿瘤、中医心血管、中医呼吸、中医肾病、中医耳鼻咽喉、中医神经内科中医内分泌、中医风湿病、中医血液、中医儿科中医骨伤心血管、神经内科、皮肤、精神、麻醉、眼科、呼吸、肾病、普通外科、骨科、妇科、产科中医心血管、中医神经内科、中医肾病、中医消化、中医妇科骨科、妇科、内分泌、神经内科、心血管内科、肾病、免疫、呼吸内科、血液内科、泌尿外科、医学影像(诊断)、普通外麻醉、重症医学、神经内科、普通外科、神经外科、骨科、妇科、产科、小儿血液消化、肾病、血液、感染、肿瘤、心血管、内分泌、呼吸、中医肾病、中医类风湿、中医脑血管、中医心血管、医学影像肿瘤、心血管、神经外科、中医肾病眼科骨科、内分泌、妇产、泌尿儿科(小儿血液病、小儿肾病、小儿消化、小儿呼吸、小儿神经病、小儿心脏病)、小儿外科(小儿普通外科、小儿泌尿外科)、心血管内科、消化内科、肝病、肾病、神经外科、血液内科、普通外科、急诊医学(中毒和创伤急救)、胸外、烧伤肿瘤、呼吸、风湿、普通外科肿瘤心血管、肿瘤肝病肝病、结核、艾滋小儿血液、小儿呼吸、小儿神经病学、中医儿科、医学影像(超声诊断)精神卫生呼吸、心血管、肿瘤、感染(肝炎)、神经内科、肾病中医肝病、中医肾病、中医心血管、中医内分泌、中医骨伤、中医消化、中医神经内科、中医妇科呼吸内科、肾病、肿瘤、生殖健康与不孕症、骨科、消化内科、皮肤心血管、内分泌、消化、皮肤、妇产、骨科、呼吸、神经内科、医学影像(诊断)普通外科(胃肠、结直肠)、肿瘤、中西医结合(肛肠)、消化、生殖健康与不孕症感染、风湿免疫、呼吸、妇产、神经内科、内分泌、精神、皮肤专业麻醉肾病、肿瘤心血管、内分泌、呼吸、血液、消化、传染心血管、血液、消化、烧伤、心血管外科、移植(肾移植)、麻醉、骨科、内分泌、肾病、神经内科、呼吸普通外科耳鼻咽喉、泌尿外科、皮肤、肿瘤、超声波(超声诊断、超声介入)、急诊医学(急性感染、创伤、休克复苏)、妇产、小儿血液与肿瘤、小儿内分泌、重症医学、风湿、核医学、医学影像(介入)、肝移植、神经外科普通外科(乳腺、肝胆)、泌尿、血液、耳鼻喉、眼科、麻醉、肾病、风湿眼科肿瘤医学影像(CT诊断、核医学、超声诊断)、麻醉妇科、生殖健康与不孕症、计划生育、肿瘤、小儿肾病、小儿神经病、小儿呼吸、小儿消化心血管、肿瘤、神经内科、血液、内分泌、妇科、骨科、普通外科中医心血管内科、中医消化内科、中医呼吸内科、中医肾病、中医肿瘤、中医骨伤、中医耳鼻咽喉、中医肛肠、中医泌尿外科、中医神经内科、中医眼科、中医急诊肿瘤血液、内分泌、肾病学、呼吸、骨科、神经外科、泌尿、普通外科(甲乳、肝胆)、烧伤科、胸外科、中西医结合、重症医2017年12月)担药物临床试验的条件,同意认定其具有药物证书69703807930270689831696006302766910174033801346950352016320040006003800527966878333900248028101366928320067517 0344 00940277 0137794 0065446686693525 2004000820040009 0056 0092792 0054 0051 0083798 0105556564 0291 0314694 0223406 0181497 0036536 0215434797 5620082 0188 795 690 0327688 424 431。

《药物临床试验机构资格认定办法》是一份2004年颁布的法律法规。
中文名药物临床试验机构资格认定办法根据中华人民共和国药品管理法申请标准已取得医疗机构执业许可效力级别法律施行时间2004年3月1日负责单位由国家食品药品监督管理局办法全文第一章总则第一条为加强药物临床试验的监督管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本办法。
第二条药物临床试验机构资格认定(以下简称“资格认定”)是指资格认定管理部门依照法定要求对申请承担药物临床试验的医疗机构所具备的药物临床试验条件,药物临床试验机构的组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,作出其是否具有承担药物临床试验资格决定的过程。
第三条国家食品药品监督管理局与卫生部共同制定和修订《药物临床试验机构资格认定办法》。
第四条国家食品药品监督管理局主管全国资格认定管理工作。
卫生部在其职责范围内负责资格认定管理的有关工作。
第五条省、自治区、直辖市食品药品监督管理局(药品监督管理局)和卫生厅(局)负责本行政区域内资格认定的初审和形式审查及日常监督管理工作。
第二章资格认定的申请第六条申请资格认定的医疗机构应具备以下条件:(一)已取得医疗机构执业许可;(二)申请资格认定的专业应与医疗机构执业许可诊疗科目一致;(三)具有与药物临床试验相适应的设备设施;(四)具有与承担药物临床试验相适应的诊疗技术能力;(五)具有与承担药物临床试验相适应的床位数和受试者人数;(六)具有承担药物临床试验的组织管理机构和人员;(七)具有能够承担药物临床试验的研究人员并经过药物临床试验技术与法规的培训;(八)具有药物临床试验管理制度和标准操作规程;(九)具有防范和处理药物临床试验中突发事件的管理机制和措施。
第七条申请资格认定的医疗机构应根据所具备的药物临床试验的技术要求及设施条件和专业特长,申请相应的药物临床试验专业资格认定。
第八条申请资格认定的医疗机构,应填写《药物临床试验机构资格认定申请表》(附件1),并向所在地省级卫生厅(局)报送资格认定申请的书面资料及电子软盘。

国家食品药品监督管理总局关于认可中国食品药品检定研究院医疗器械产品和项目检测资格的通知
文章属性
•【制定机关】国家食品药品监督管理总局(已撤销)
•【公布日期】2013.12.30
•【文号】食药监科[2013]260号
•【施行日期】2013.12.30
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】健康促进
正文
国家食品药品监督管理总局关于认可中国食品药品检定研究院医疗器械产品和项目检测资格的通知
(食药监科〔2013〕260号)
中国食品药品检定研究院:
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法(试行)》(国药监械〔2003〕125号)的规定,2013年10月30日至31日,国家食品药品监督管理总局组织专家组对你院的医疗器械检测能力进行了现场评审。
经审查,认可你院医用电气设备等163个医疗器械产品和项目(见附件)检测资格,有效期5年。
附件:医疗器械检测资格认可范围及限制要求
国家食品药品监督管理总局
2013年12月30日附件
医疗器械检测资格认可范围及限制要求
名称:中国食品药品检定研究院。

解读《药物临床试验机构资格认定检查细则》(试行)2014年9月5日,国家食品药品监督管理局颁布了《药物临床试验机构资格认定检查细则(试行)》征求意见稿,该文件是总局审核查验中心根据《药物临床试验质量管理规范》以及药物临床试验机构管理的有关规定,对《药物临床试验机构资格认定标准》的相关条款进行全面细化而产生。
本文将主要从《药物临床试验机构资格认定检查细则》(试行)的制定意义、检查内容、检查方法以及存在问题等几个方面进行阐述,为药物临床试验机构迎接资格认定检查工作及规范管理提供一定参考。
标签:药物临床试验机构资格认定;解读2014年9月初,国家食品药品监督管理局为进一步提高药物临床试验质量,强化受试者权益和安全保障,加强药物临床试验机构的现场检查,审核查验中心根据《药物临床试验质量管理规范》[1]以及药物临床试验机构管理的有关规定,对《药物临床试验机构资格认定标准》[2]的相关条款进行了细化,制定了《药物临床试验机构资格认定检查细则(试行)》[3](以下简称《细则》),本文将对《细则》的制定意义、检查内容、检查方法以及存在问题等进行细致阐述,希望机构人员及研究者等其相关人员充分理解检查要求,以进一步指导机构资格认定检查工作并规范机构及项目管理。
1意义药物临床试验机构资格认定是指政府主管部门依照法定要求,对申请承担药物临床试验的医疗机构所具备的条件、组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,做出其是否具有承担药物临床试验资格决定的过程。
2004年2月29日,国家食品药品监督管理局(SFDA)发布”关于印发《药物临床试验机构资格认定办法(试行)》的通知”(国食药监安[2004]44号),并同时颁发了该局与卫生部共同制定的《药物临床试验机构资格认定办法(试行)》[3]。
按照该办法的要求,我国政府主管部门自2004年3月1日开始对全国药物临床试验机构的资格进行认定。
规定明确提出:”已取得药物临床试验机构资格的医疗机构每3年进行一次资格认定复核检查”。

药物临床试验机构资格认定标准药物临床试验机构资格认定标准1. 概述药物临床试验是指将新药物或已上市药物进行全面、系统、规范和科学的试验,以评价其安全性、有效性和药效学特征,进而为临床应用提供准确、可靠的临床数据。
药物临床试验机构是进行药物临床试验的重要场所,其资格认定标准的制定和实施对保障试验数据的准确性、有效性以及被试验者的安全和权益具有重要意义。
2. 药物临床试验机构资格认定标准的制定背景众所周知,药物研发是一项高风险、高投入、高回报的工作。
药物研发的每一个环节都需要严格遵循规范和标准,因为一旦出现问题,不仅仅是资金的损失,更是可能对人类的健康和生命造成危害。
药物研发的监管环节非常重要,其中,药物临床试验机构资格认定标准就是其中之一。
制定并实施资格认定标准可以确保试验机构的合法性和规范性,进一步保障试验数据和参与者的合法权益。
3. 药物临床试验机构资格认定标准的内容(1)法律法规:药物临床试验机构资格认定标准首先需要符合国家相关法律法规的规定,如《药品管理法》、《临床试验质量管理规范》等。
(2)机构条件:试验机构必须具备相应的实验室设施、试验设备,以及合格的人员配置,包括临床医生、研究协调员等。
(3)试验流程:试验机构应具备规范的试验流程和管理制度,包括试验方案的制定、实验数据的收集和记录、试验过程的监测和数据分析等。
(4)试验伦理:试验机构必须遵循伦理原则,尊重被试验者的权益和隐私,确保试验的合法性和道德性。
(5)试验质量:试验机构应建立完善的质量管理体系,确保试验数据的真实性和有效性。
4. 药物临床试验机构资格认定标准的执行和监管在制定了上述的资格认定标准后,相关部门需要建立健全的执行和监管机制,包括:(1)认定程序:设立明确的认定流程和程序,对试验机构进行全面评估,确保其符合资格认定标准。
(2)监督检查:建立定期的监督检查机制,对试验机构的资质和试验过程进行定期监督和检查。
(3)处罚机制:对违规行为及时采取相应的处罚措施,确保试验机构按照规范进行药物临床试验。
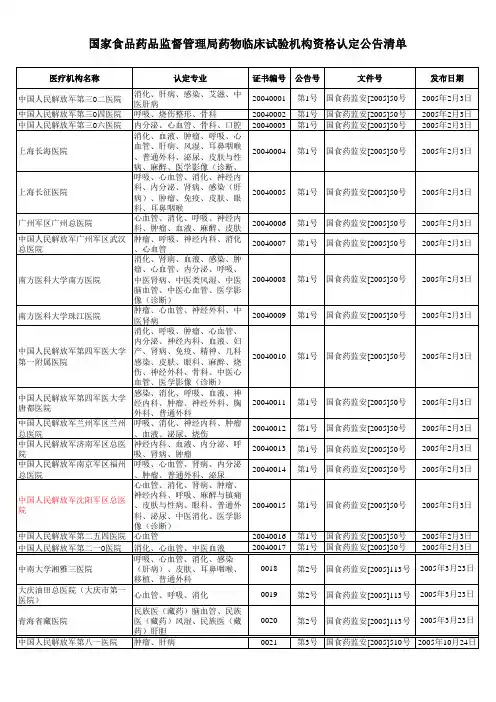
国家食品药品监督管理局药物临床试验机构资格认定公告(第1号)国食药监安[2005]50号2005年02月03日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,中国人民解放军第三○二医院等17家医疗机构基本具备承担药物临床试验的条件,同意认定其具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年二月三日国食药监安[2005]113号2005年03月23日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,中南大学湘雅三医院、大庆油田总医院(大庆市第一医院)、青海省藏医院基本具备承担药物临床试验的条件,同意认定其具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年三月二十三日国食药监安[2005]510号2005年10月24日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军第八一医院等37家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年十月二十四日国家食品药品监督管理局药物临床试验机构资格认定公告(第4号)国食药监安[2005]552号2005年11月21日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定苏州大学附属第三医院等18家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年十一月二十一日国家食品药品监督管理局药物临床试验机构资格认定公告(第5号)国食药监安[2005]646号2005年12月29日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国医科大学附属第一医院等18家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
目录一、各专业组的问题 (3)1、什么是GCP? GCP的核心(宗旨、目的〉是什么? (3)2、GCP的适用范围是什么? 包括多少章?多少条?多少附录?每一章的内容是什么? 2个附录分别是什么? (3)3、药物临床试验质量管理规范-GCP,这个名称和旧版相比有何变化,为什么? (3)4、原来称"药物临床试验基地",为什么现在称为"药物临床试验机构"? [A类] (3)5、什么是临床试验? 以及试验中应遵循的原则? (3)6、什么是生物利用度? (3)7、什么是生物等效性试验? (3)8、临床试验药物的制备应符合什么规范? (4)9、试验开始前(机构办公室秘书)研究者应须对申办者哪些资料进行审核? (4)10、临床试验批件的有效期是多少? (4)11、化学药物的注册分类? (4)12、什么是新药? [B类] (4)13、如何确定样本量? 临床试验各期的意义及最低样本数? (4)14、药物临床研究的伦理学基本原则是什么? (5)15、受试者的权益包括哪些? (5)16、知情同意书应包括那些主要内容(至少5项)? 设计原则是什么?一般几份?分别交给谁? (5)17、知情同意书在哪些情况下可不由受试者本人签字? (5)18、执行签署知情同意书、伦理委员会审批、受试者筛选的顺序应如何安排? (5)19、什么是弱势群体?什么是无行为能力者? (6)20、当受试者是儿童和未成年人肘,如何征求知情同童? [B类] (6)21、关于紧急情况下的知情同意,我国GCP有何规定? (6)22、临床试验方案由谁制定?包括什么内容?设计的基本原则是什么? (6)23、在药物临床试验中随机一般如何操作? (7)24、随机化试验有何意义? (7)25、受试者入选年龄界限? (7)26、临床试验常用设计方案包括哪些? (7)27、试验设计中假设检验的类型有哪些?常用的是哪些? (8)28、药物临床试验的有效性评价中什么是痊愈、显效、进步、无效?有效率如何计算? (8)29、什么是盲法试验?双盲双模拟、开放(不设盲)、交叉、平行、配对的定义,试验设计类型分哪几类? (8)30、什么是导入期和清洗期? (8)31、GCP对于双盲试验终止和失效是如何规定的? (9)32、入选、排除、剔除、脱落的区别是什么?中止研究的标准是什么? (9)33、脱落病例如何处理? (9)34、阐述受试者的筛选过程? (9)35、四期药物临床试验中哪些需设盲?哪些不设盲,为开放性试验? (10)36、什么是紧急破盲表?破盲表应如何保存?在什么情况下允许破盲? (10)37、盲底如何保存? 什么时候揭盲?GCP对于双盲试验终止和失效是如何规定的? (10)38、选择对照药的原则?阳性药、阴性药对照的优缺点? (10)39试验方案中设立对照的原则是什么?包括哪两类? (10)40、什么是安慰剂?在何种情况下,不能使用安慰剂作为对照组? 在不能选择安慰剂对照的情况下应如何选择阳性对照? (10)41、主要研究者(PI)在临床时应签署哪些文件? (11)42、什么是原始资料? (11)43、什么是病例报告表?如何填写病例报告表?如何更正病例报告表中的错误? (11)44、什么是稽查?什么是视察?什么是监查? (11)45、监查的目的是什么? (11)46、临床试验总结报告内容有哪些?谁应负责撰写试验总结报告?谁负责向SFDA递交总结报告? (12)47、什么是不良事件?什么是严重不良事件?如何报告严重不良事件?不良反应与不良事件有什么区别? (12)48、药物不良反应(ADR)包括哪些类型? (12)49、判断不良事件与试验用药的关系有那五条标准? (13)50、受试者出现严重不良事件的逐级报告流程是什么? (13)51、如果门诊患者出现严重不良事件应如何应对? (13)52、女性受试者,出现意外怀孕时,如何处理?如何避免这种情况发生? (13)53、专业科室的急救药物如何管理? (13)54、什么叫质疑表?由谁传送?能不能通过电话传达质疑表的内容? (14)55、什么是ITT/FAS/PP人群? (14)56、什么叫结果锁定? (14)57、什么叫二级设盲?什么叫二级揭盲? (14)非紧急揭盲在何时? (14)59、专业科室如何管理临床试验的物资?(研究护士重点准备) (15)60、专业科室如何管理临床试验药物?(药品管理员) (15)61、试验中对试验用药品应如何管理?(何时才允许将试验用药品发送至医院?) (15)62、对试验用药品的标签有何规定? (15)63、剩余试验药物能否给其他相关患者使用?为什么? [E类] (15)64、专业科室如何保证参加研究者均接受过GCP培训? (15)65、专业科室如何保证临床试验的质量? (16)66、什么是研究者手册?研究者手册包括哪些内容? (16)67、什么是受试者入组/筛选表? (16)68、如果有厂家来找你们科室合作临床试验,你该如何处理? (16)69、专业科室如何保证受试者权益? (16)二、新申请专业组人员考核的基本要求 (17)三、检查专业组的基本要求: (17)1、硬件情况 (17)2、专业组的文档资料管理 (17)3、专业组临床试验的相关设施 (17)4、专业组临床试验用药管理 (17)5、临床试验实施与记录情况 (18)四、药物临床试验专业资格认定标准(评分版) (18)五、规范用语含义 (20)一、各专业组的问题1、什么是GCP? GCP的核心(宗旨、目的〉是什么?答: GCP是英文good clinic practice的缩写,在中文中应该理解成药物临床试验质量管理规范。
卫生部、国家食品药品监督管理局关于开展药物临床试验机构资格认定复核检查工作的通知文章属性•【制定机关】卫生部(已撤销),国家食品药品监督管理局(已撤销)•【公布日期】2009.05.05•【文号】国食药监注[2009]203号•【施行日期】2009.05.05•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文卫生部、国家食品药品监督管理局关于开展药物临床试验机构资格认定复核检查工作的通知(国食药监注[2009]203号)各省、自治区、直辖市卫生厅(局)、食品药品监督管理局(药品监督管理局)、新疆生产建设兵团卫生局,解放军总后勤部卫生部:为进一步加强药物临床研究监督管理,切实提高药物临床研究质量,确保受试者权益和安全,根据《药物临床试验资格认定办法(试行)》(国食药监安〔2004〕44号)的规定,国家食品药品监督管理局(以下简称国家局)会同卫生部将于近期启动药物临床试验资格认定复核检查工作。
现将《药物临床试验机构资格认定复核检查工作方案》(以下简称工作方案)印发给你们,并将有关事项通知如下:一、具有药物临床试验资格的医疗机构(以下简称机构)如在《药物临床试验资格认定证书》有效期届满后继续开展药物临床试验,应向所在地省级卫生行政部门提出药物临床试验机构资格认定复核检查申请。
复核检查期间暂不受理新增专业申请,被检查机构通过复核检查后方可提出新增专业申请。
二、2007年1月1日之前国家局公告的药物临床试验机构,应于2009年6月10日之前提出复核检查申请,国家局会同卫生部于2009年对以上机构进行集中检查;2007年1月1日之后国家局公告的机构,应于《药物临床试验资格认定证书》有效期届满6个月前提出复核检查申请,国家局将结合品种检查计划,及时安排复核检查。
未按以上时限要求申请复核检查的机构,将不再具有承担药物临床试验的资格。
三、申请复核检查的机构除需书面提交药物临床试验机构资格认定复核检查申请资料以外,还需进行网上申报。
国家食品药品监督管理局关于印发药物Ⅰ期临床试验管理指导原则(试行)的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2011.12.02•【文号】国食药监注[2011]483号•【施行日期】2011.12.02•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于印发药物Ⅰ期临床试验管理指导原则(试行)的通知(国食药监注[2011]483号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后卫生部药品监督管理局:为加强药物Ⅰ期临床试验的管理,有效的保障受试者的权益与安全,提高药物Ⅰ期临床试验的研究质量与管理水平,根据《中华人民共和国药品管理法》、《药品注册管理办法》和《药物临床试验质量管理规范》等有关规定,国家局组织制定了《药物Ⅰ期临床试验管理指导原则(试行)》,现予印发。
请你局组织本行政区域内药物临床试验机构学习,参照执行。
附件:《药物Ⅰ期临床试验管理指导原则(试行)》起草说明国家食品药品监督管理局二○一一年十二月二日药物Ⅰ期临床试验管理指导原则(试行)第一章总则第一条为加强药物Ⅰ期临床试验(以下简称I期试验)的管理,有效地保障受试者的权益与安全,提高Ⅰ期试验的研究质量与管理水平,根据《中华人民共和国药品管理法》、《药品注册管理办法》、《药物临床试验质量管理规范》等相关规定,参照国际通行规范,制定本指导原则。
第二条本指导原则适用于Ⅰ期试验,旨在为Ⅰ期试验的组织管理和实施提供指导。
人体生物利用度或生物等效性试验应参照本指导原则。
第二章职责要求第三条申办者应建立评价药物临床试验机构的程序和标准,选择、委托获得资格认定的I期试验研究室进行Ⅰ期试验。
第四条申办者应建立质量保证体系,对I期试验的全过程进行监查和稽查,确保临床试验的质量,保障受试者的权益与安全。
第五条申办者可以委托合同研究组织(CRO)执行I期试验中的某些工作和任务。
国家食品药品监督管理局关于《国家药品临床研究基地目录》的通告文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2004.04.05•【文号】国食药监械[2004]97号•【施行日期】2004.04.05•【效力等级】部门规范性文件•【时效性】失效•【主题分类】药政管理正文*注:本篇法规已被《国家食品药品监督管理局关于清理规章和规范性文件的公告》(发布日期:2007年3月22日实施日期:2007年3月22日)宣布失效或废止(原因:该文件是配合《医疗器械临床试验规定》(国家食品药品监督管理局第5号令)发布,对当时已符合国家食品药品监督管理局第5号令第21条“承担医疗器械临床试验的医疗机构”情况的说明。
此后,药品临床研究基地逐渐增加,机构名录以国家食品药品监督管理局药物临床试验机构资格认定公告为准)国家食品药品监督管理局关于《国家药品临床研究基地目录》的通告(国食药监械[2004]97号)根据《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)第二十一条“承担医疗器械临床试验的医疗机构,是指经过国务院食品药品监督管理部门会同国务院卫生行政部门认定的药品临床试验基地”的规定,现将《国家药品临床研究基地目录》予以通告。
该目录亦可在国家食品药品监督管理局网站或者中国医疗器械信息网查询。
国家食品药品监督管理局二00四年四月五日附:国家药品临床研究基地目录(西药)┏━━┯━━━━━━━┯━━━━━━┯━━━━━━━━━━━━━━━┓┃地区│序号│单位│基地专业┃┠──┼───────┼──────┼───────────────┨┃北京│JDX1999001│北京医科大学│第一附属医院:心血管、呼吸、消┃┃│││化、肝病、肾病、泌尿、内分泌、┃┃│││神经、麻醉、放射、妇产及生育调┃┃│││节、皮肤┃┃│││人民医院:心血管、血液、呼吸、┃┃│││肝病┃┃│││第三附属医院:心血管、呼吸、消┃┃│││化、神经、妇产及生育调节、血液┃┃│││口腔医院:口腔┃┃│││临床药理研究所:抗生素┃┃│││药物依赖所:戒毒、镇痛┃┃│││精神卫生研究所:精神┃┠──┼───────┼──────┼───────────────┨┃│JDX1999008│中国医学科学│抗感染、变态反应、兔疫、神经、┃┃││院北京协和医│心血管、眼科、肾病、呼吸、消┃┃││院│化、胃肠外营养、放射、麻醉、血┃┃│││液、内分泌、耳鼻喉、妇产及生育┃┃│││调节、皮肤┃┠──┼───────┼──────┼───────────────┨┃│JDX1999009│中国医学科学│心血管┃┃││院阜外心血管│┃┃││医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999010│中国医学科学│肿瘤┃┃││院肿瘤医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999011│首都医科大学│心血管、消化、神经、肾病┃┃││附属北京友谊│┃┃││医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999012│中日友好医院│心血管、内分泌、肿瘤、肾病、免┃┃│││疫、呼吸、妇产及生育调节┃┠──┼───────┼──────┼───────────────┨┃│JDX1999013│卫生部北京医│心血管、呼吸、胃肠外营养┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999014│首都医科大学│心血管、呼吸、妇产及生育调节┃┃││附属北京红十│┃┃││字朝阳医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999015│首都医科大学│心血管、周围血管、皮肤、神经┃┃││北京宣武医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999016│首都医科大学│心血管、神经┃┃││附属北京天坛│┃┃││医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999017│首都医科大学│精神、戒毒┃┃││北京安定医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999018│北京肿瘤医院│肿瘤┃┠──┼───────┼──────┼───────────────┨┃│JDX1999019│北京结核病胸│抗结核、肺癌┃┃││部肿瘤研究所│┃┠──┼───────┼──────┼───────────────┨┃天津│JDX1999020│中国医学科学│血液┃┃││院血液病医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999021│天津医科大学│第二附属医院:心血管、抗感染┃┃│││总医院:心血管、呼吸、消化、内┃┃│││分泌、神经┃┠──┼───────┼──────┼───────────────┨┃│JDX1999022│天津市肿瘤医│肿瘤┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃河北│JDX1999023│河北医科大学│心血管、呼吸、消化、血液、妇产┃┃││第二医院│及生育调节┃┠──┼───────┼──────┼───────────────┨┃│JDX1999024│河北省人民医│心血管、神经、呼吸┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃辽宁│JDX1999025│辽宁省人民医│心血管、皮肤┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999026│中国医科大学│第一临床学院:消化、肾病、神┃┃│││经、麻醉、心血管、呼吸、血液┃┃│││第二临床学院:妇产及生育调节、┃┃│││抗感染┃┠──┼───────┼──────┼───────────────┨┃│JDX1999027│大连医科大学│第一附属医院:心血管、肿瘤┃┃│││第二附属医院:肿瘤、心血管、抗┃┃│││感染┃┠──┼───────┼──────┼───────────────┨┃吉林│JDX1999028│白求恩医科大│消化、神经┃┃││学第一临床学│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999029│白求恩医科大│皮肤、妇产及生育调节┃┃││学第二临床学│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999030│白求恩医科大│妇产及生育调节、心血管┃┃││学第三临床学│┃┃││院中日联谊医│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃黑龙│JDX1999031│哈尔滨医科大│心血管、呼吸、神经┃┃江││学第一临床学│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999032│哈尔滨医科大│心血管、呼吸、神经、免疫┃┃││学第二临床学│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃上海│JDX1999033│上海医科大学│放射、心血管、内分泌、皮肤、血┃┃││中山医院│液、呼吸、肾病、消化┃┠──┼───────┼──────┼───────────────┨┃│JDX1999034│上海医科大学│抗感染、神经、心血管、放射、内┃┃││华山医院│分泌、皮肤、消化、血液、泌尿、┃┃│││药物不良反应监测┃┠──┼───────┼──────┼───────────────┨┃│JDX1999035│上海医科大学│肿瘤┃┃││肿瘤医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999036│上海医科大学│妇产及生育调节┃┃││妇产医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999037│上海医科大学│耳鼻喉、眼科┃┃││眼耳鼻喉医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999038│上海第二医科│瑞金医院:高血压、内分泌、烧┃┃││大学│伤、消化、血液、骨科、心血管┃┃│││仁济医院:免疫┃┃│││第九医院:口腔┃┠──┼───────┼──────┼───────────────┨┃│JDX1999039│上海市消化疾│消化、肝病┃┃││病研究所│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999040│上海市精神卫│精神┃┃││生中心│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999041│上海市静安区│泌尿、肝病┃┃││中心医院│┃┠──┼───────┼──────┼───────────────┨┃江苏│JDX1999042│南京医科大学│抗感染、心血管、内分泌、呼吸、┃┃││第一附属医院│妇产及生育调节、神经、皮肤、血┃┃│││液、医学影像、泌尿、消化┃┠──┼───────┼──────┼───────────────┨┃│JDX1999043│中国医学科学│皮肤┃┃││院皮肤病研究│┃┃││所│┃┠──┼───────┼──────┼───────────────┨┃浙江│JDX1999044│浙江大学医学│心血管、眼科、血液、抗感染、泌┃┃││院附属第一医│尿┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999045│浙江大学医学│呼吸、肿瘤、神经、心血管┃┃││院附属第二医│┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999046│浙江省医学科│生育调节┃┃││学院计划生育│┃┃││研究所│┃┠──┼───────┼──────┼───────────────┨┃安徽│JDX1999047│安徽医科大学│临床药理研究所:免疫┃┃│││第一附属医院:消化、内分泌┃┠──┼───────┼──────┼───────────────┨┃│JDX1999048│皖南医学院弋│皮肤、血液┃┃││矶山医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999049│蚌埠医学院附│肿瘤┃┃││属医院--安徽│┃┃││省肿瘤医院│┃┠──┼───────┼──────┼───────────────┨┃福建│JDX1999050│福建医科大学│第一附属医院:心血管、耳鼻喉、┃┃│││肿瘤、眼科、神经┃┃│││附属协和医院:泌尿、心血管、耳┃┃│││鼻喉、肿瘤、血液┃┠──┼───────┼──────┼───────────────┨┃│JDX1999051│福建省肿瘤医│肿瘤┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999052│福建省立医院│心血管、消化┃┠──┼───────┼──────┼───────────────┨┃江西│JDX1999053│江西医学院│第一附属医院:消化、烧伤┃┃│││第二附属医院:心血管、神经、血┃┃│││液┃┠──┼───────┼──────┼───────────────┨┃山东│JDX1999054│山东医科大学│消化、泌尿、皮肤、呼吸、肿瘤、┃┃││附属医院│神经、心血管、血液、骨科、免┃┃│││疫、内分泌、妇产及生育调节┃┠──┼───────┼──────┼───────────────┨┃│JDX1999055│山东省立医院│眼科、泌尿、呼吸、妇产及生育调┃┃│││节、血液、消化、心血管、神经┃┠──┼───────┼──────┼───────────────┨┃│JDX1999056│青岛市立医院│心血管、眼科、耳鼻喉、消化、麻┃┃│││醉┃┠──┼───────┼──────┼───────────────┨┃│JDX1999057│青岛大学医学│骨科、内分泌、神经┃┃││院附属医院│┃┠──┼───────┼──────┼───────────────┨┃河南│JDX1999058│河南医科大学│第一附属医院:血液、妇产及生育┃┃│││调节、皮肤、心血管┃┃│││第二附属医院:消化┃┃│││河南医学科学研究所:肝病┃┠──┼───────┼──────┼───────────────┨┃│JDX1999059│河南省眼科研│眼科┃┃││究所│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999060│河南省人民医│心血管、消化┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃湖北│JDX1999061│同济医科大学│同济医院:心血管、消化、肾病┃┃│││协和医院:心血管、消化、抗感┃┃│││染、皮肤、血液┃┃│││计划生育研究所:生育调节┃┠──┼───────┼──────┼───────────────┨┃│JDX1999062│湖北医科大学│第一附属医院:神经、心血管、消┃┃│││化┃┃│││第二附属医院:抗感染┃┠──┼───────┼──────┼───────────────┨┃湖南│JDX1999063│湖南省肿瘤医│肿瘤┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999064│湖南医科大学│心血管┃┃││湘雅医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999065│湖南医科大学│精神、戒毒┃┃││第二附属医院│┃┠──┼───────┼──────┼───────────────┨┃广东│JDX1999066│中山医科大学│第一附属医院:肾病、神经、抗感┃┃│││染、内分泌┃┃│││第三附属医院:抗寄生虫、肝病、┃┃│││免疫┃┃│││孙逸仙纪念医院:皮肤、心血管、┃┃│││消化、内分泌┃┃│││肿瘤医院防治中心:肿瘤┃┃│││中山眼科中心:眼科┃┠──┼───────┼──────┼───────────────┨┃│JDX1999067│广州市精神病│精神┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999068│广州市呼吸病│呼吸┃┃││研究所│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999069│广东省人民医│心血管┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃广西│JDX1999070│广西医科大学│心血管、血液、药物依赖、消化、┃┃││第一附属医院│内分泌┃┠──┼───────┼──────┼───────────────┨┃海南│JDX1999071│海南省人民医│心血管、肝病、呼吸┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃重庆│JDX1999072│重庆医科大学│抗感染、寄生虫、呼吸、结核、神┃┃││第一附属医院│经┃┠──┼───────┼──────┼───────────────┨┃│JDX1999073│重庆医科大学│肝病、妇产及生育调节、消化┃┃││第二附属医院│┃┠──┼───────┼──────┼───────────────┨┃四川│JDXZ1999074│华西医科大学│抗感染、心血管、呼吸、消化、血┃┃││第一附属医院│液、神经、精神、肿瘤、内分泌、┃┃│││戒毒、皮肤┃┠──┼───────┼──────┼───────────────┨┃│JDX1999075│华西医科大学│妇产及生育调节┃┃││第二附属医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999076│华西医科大学│口腔┃┃││口腔医院│┃┠──┼───────┼──────┼───────────────┨┃云南│JDX1999077│昆明医学院第│精神、神经、肝病┃┃││一附属医院│┃┠──┼───────┼──────┼───────────────┨┃陕西│JDX1999078│西安医科大学│心血管、肝胆外科、肿瘤、精神、┃┃││第一附属医院│呼吸、神经┃┠──┼───────┼──────┼───────────────┨┃│JDX1999079│西安医科大学│眼科、皮肤、消化┃┃││第二附属医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999080│陕西省人民医│神经、肝胆外科、消化、血液、耳┃┃││院│鼻喉┃┠──┼───────┼──────┼───────────────┨┃甘肃│JDX1999081│兰州医学院第│血液、心血管、抗感染┃┃││一附属医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999082│兰州医学院第│心血管、泌尿┃┃││二附属医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999083│甘肃省人民医│心血管、呼吸┃┃││院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999084│解放军总院│肿瘤、心血管、消化、内分泌、皮┃┃│││肤、血液、免疫、神经、创伤、泌┃┃│││尿、妇产及生育调节、耳鼻喉、呼┃┃│││吸、抗感染┃┠──┼───────┼──────┼───────────────┨┃北京│JDX1999085│军事医学科学│抗辐射、抗毒、肿瘤及肿瘤镇痛、┃┃││院附属医院│戒毒、血液┃┠──┼───────┼──────┼───────────────┨┃│JDX1999086│北京军区总院│神经、消化、肝病┃┠──┼───────┼──────┼───────────────┨┃│JDX1999087│空军总院│呼吸、皮肤┃┠──┼───────┼──────┼───────────────┨┃│JDX1999088│白求恩国际和│心血管、消化、肾病┃┃││平医院│┃┠──┼───────┼──────┼───────────────┨┃上海│JDX1999089│第二军医大学│皮肤、血液、消化、肿瘤┃┃││上海长海医院│┃┠──┼───────┼──────┼───────────────┨┃南京│JDX1999090│南京军区南京│胃肠外营养、心血管、肾病、呼吸┃┃││总医院│┃┠──┼───────┼──────┼───────────────┨┃重庆│JDX1999091│第三军医大学│烧伤、消化、皮肤、肝病、呼吸┃┃││西南医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999092│第三军医大学│心血管、呼吸┃┃││新桥医院│┃┠──┼───────┼──────┼───────────────┨┃│JDX1999093│第三军医大学│创伤┃┃││大坪医院│┃┠──┼───────┼──────┼───────────────┨┃西安│JDX1999094│第四军医大学│消化、骨科、神经、肿瘤、呼吸、┃┃││西京医院│血液、妇产及生育调节┃┠──┼───────┼──────┼───────────────┨┃│JDX1999095│第四军医大学│口腔┃┃││口腔医院│┃┠──┼───────┼──────┼───────────────┨┃广州│JDXZ1999096│第一军医南方│抗感染、肾病、血液、医学影像、┃┃││医院│消化┃┗━━┷━━━━━━━┷━━━━━━┷━━━━━━━━━━━━━━━┛国家药品临床研究基地目录(中药)┏━━━┯━━━━━━━┯━━━━━━━┯━━━━━━━━━━━━━┓┃地区│序号│单位│基地专业┃┠───┼───────┼───────┼─────────────┨┃北京│JDZ1999001│中国中医研究院│心血管、血液、呼吸、消化、┃┃││西苑医院│外科、妇科、儿科、神经、内┃┃│││分泌┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999002│中国中医研究院│肿瘤、皮肤、泌尿、肛肠、眼┃┃││广安门医院│科、心血管、肾病、糖尿病、┃┃│││风湿、妇科、呼吸┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999003│北京中医药大学│心血管、肾病、呼吸、消化、┃┃││东直门医院│脑血管、内分泌(乳腺)、儿┃┃│││科、外科、妇科、抗感染┃┠───┼───────┼───────┼─────────────┨┃天津│JDZ1999004│天津中医学院第│心血管、儿科、外科┃┃││一附属医院│┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999005│天津中医学院第│妇科、心血管┃┃││二附属医院│┃┠───┼───────┼───────┼─────────────┨┃辽宁│JDZ1999006│辽宁中医学院附│血液、外科、妇科、骨科、肾┃┃││属医院│病、肝病┃┠───┼───────┼───────┼─────────────┨┃吉林│JDZ1999007│吉林省中医中药│心血管、呼吸┃┃││研究院│┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999008│长春中医学院附│脑血管、心血管、消化、妇┃┃││属医院│科、糖尿病、抗感染┃┠───┼───────┼───────┼─────────────┨┃黑龙江│JDZ1999009│黑龙江中医药大│第一附属医院:呼吸、消┃┃││学│化、外科┃┃│││第二附属医院:脑血管┃┠───┼───────┼───────┼─────────────┨┃山西│JDZ1999010│山西省中医药研│消化、肾病┃┃││究院│┃┠───┼───────┼───────┼─────────────┨┃上海│JDZ1999011│上海中医药大学│曙光医院:肝病、骨科┃┃│││龙华医院:外科(疮疡)、肿┃┃│││瘤┃┃│││岳阳医院:血液┃┠───┼───────┼───────┼─────────────┨┃江苏│JDZ1999012│南京中医药大学│抗感染、肾病、消化、耳鼻┃┃││附属医院│喉、儿科┃┠───┼───────┼───────┼─────────────┨┃浙江│JDZ1999013│浙江省中医院│肿瘤、消化┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999014│浙江中医药研究│肿瘤┃┃││院│┃┠───┼───────┼───────┼─────────────┨┃安徽│JDZ1999015│安徽中医学院第│心血管、肾病、神经、骨伤┃┃││一附属医院│┃┠───┼───────┼───────┼─────────────┨┃福建│JDZ1999016│福建省中医药研│骨科、心血管、呼吸、脑血┃┃││究院│管、消化、肾病┃┠───┼───────┼───────┼─────────────┨┃江西│JDZ1999017│江西中医学院附│呼吸、消化、肾病、骨伤┃┃││属医院│┃┠───┼───────┼───────┼─────────────┨┃山东│JDZ1999018│山东中医药大学│心血管、血液、内分泌、风┃┃││附属医院│湿、妇科┃┠───┼───────┼───────┼─────────────┨┃河南│JDZ1999019│河南省中医学院│心血管、消化、儿科、肾病、┃┃││第一附属医院│肛肠、周围血管┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999020│河南省中医药研│脑血管、心血管、消化、呼吸┃┃││究院│┃┠───┼───────┼───────┼─────────────┨┃湖北│JDZ1999021│湖北省中医药研│骨科、肾病、风湿┃┃││究院│┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999022│湖北中医学院附│肝病、妇产科、儿科、呼吸、┃┃││属医院│心血管、外科(肝胆病)、脑┃┃│││血管、口腔┃┠───┼───────┼───────┼─────────────┨┃湖南│JDZ1999023│湖南省中医药研│肿瘤、肝病、心血管、脑血┃┃││究院附属医院│管、肾病┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999024│湖南中医学院第│肝病、呼吸、心血管、眼科、┃┃││一附属医院│骨伤、糖尿病┃┠───┼───────┼───────┼─────────────┨┃广东│JDZ1999025│广州中医药大学│消化、妇科、骨科、外科、肛┃┃││第一附属医院│肠、眼科┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999026│广州中医药大学│消化、妇科、骨科、外科、肛┃┃││第二附属医院│肠、眼科┃┠───┼───────┼───────┼─────────────┨┃│JDZ1999027│广州中医药大学│抗疟疾┃┃││粤海医院│┃┠───┼───────┼───────┼─────────────┨┃│JDXZ1999096│第一军医大学南│肾病、心血管、风湿、脑血管┃┃││方医院│┃┠───┼───────┼───────┼─────────────┨┃广西│JDZ1999028│广西中医学院第│心血管、骨伤、肛肠、妇产科┃┃││一附属医院│┃┠───┼───────┼───────┼─────────────┨┃海南│JDZ1999029│海南省中医院│骨伤、脑血管、泌尿┃┠───┼───────┼───────┼─────────────┨┃四川│JDZ1999030│成都中医药大学│肾病、眼科、肛肠、皮肤、妇┃┃││附属医院│科、呼吸、心血管、消化、儿┃┃│││科┃┠───┼───────┼───────┼─────────────┨┃│JDXZ1999072│华西医科大学第│呼吸、消化┃┃││一附属医院│┃┠───┼───────┼───────┼─────────────┨┃云南│JDZ1999031│云南中医学院附│肾病、肝病、儿科┃┃││属医院│┃┠───┼───────┼───────┼─────────────┨┃陕西│JDZ1999032│陕西省中医药研│心血管、消化、肿瘤、脑血管┃┃││究院附属医院│┃┠───┼───────┼───────┼─────────────┨┃贵州│JDZ1999033│贵阳中医学第一│骨科、肛肠、心血管、内分泌┃┃││附属医院│┃┠───┼───────┼───────┼─────────────┨┃新疆│JDZ1999034│新疆维吾尔自治│骨伤、心血管、脑血管、妇┃┃││区中医医院│科、儿科、肾病┃┗━━━┷━━━━━━━┷━━━━━━━┷━━━━━━━━━━━━━┛。
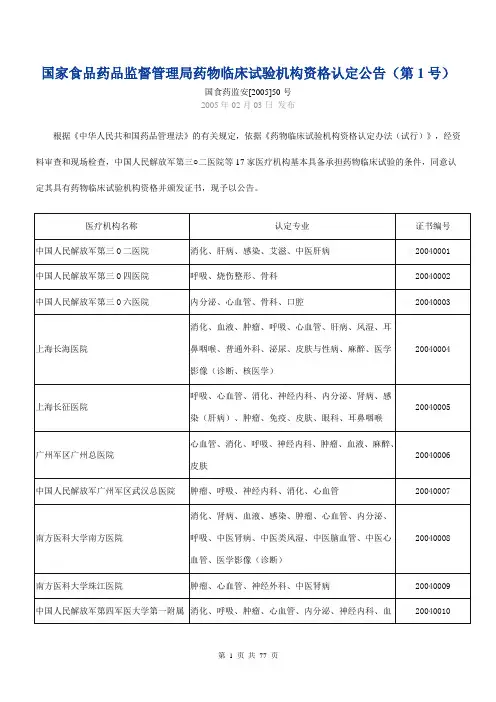
国家食品药品监督管理局药物临床试验机构资格认定公告(第1号)国食药监安[2005]50号2005年02月03日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,中国人民解放军第三○二医院等17家医疗机构基本具备承担药物临床试验的条件,同意认定其具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年二月三日国食药监安[2005]113号2005年03月23日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,中南大学湘雅三医院、大庆油田总医院(大庆市第一医院)、青海省藏医院基本具备承担药物临床试验的条件,同意认定其具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年三月二十三日国食药监安[2005]510号2005年10月24日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军第八一医院等37家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年十月二十四日国家食品药品监督管理局药物临床试验机构资格认定公告(第4号)国食药监安[2005]552号2005年11月21日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定苏州大学附属第三医院等18家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年十一月二十一日国家食品药品监督管理局药物临床试验机构资格认定公告(第5号)国食药监安[2005]646号2005年12月29日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国医科大学附属第一医院等18家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○五年十二月二十九日国家食品药品监督管理局药物临床试验机构资格认定公告(第6号)国食药监安[2006]23号2006年01月23日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定广州医学院第一附属医院等15家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年一月二十三日国家食品药品监督管理局药物临床试验机构资格认定公告(第7号)国食药监安[2006]155号2006年04月17日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军第三军医大学第一附属医院等10家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年四月十七日国家食品药品监督管理局药物临床试验机构资格认定公告(第8号)国食药监安[2006]213号2006年05月22日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国医科大学附属第二医院等8家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年五月二十二日国家食品药品监督管理局药物临床试验机构资格认定公告(第9号)国食药监安[2006]259号2006年06月13日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定江苏省中医院等6家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年六月十三日国家食品药品监督管理局药物临床试验机构资格认定公告(第10号)国食药监安[2006]290号2006年06月23日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定湖南省肿瘤医院等23家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年六月二十三日国食药监安[2006]526号2006年09月30日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定天津市第一中心医院等3家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○六年九月三十日国食药监安[2007]493号2007年08月08日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定首都医科大学附属北京儿童医院等9家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○七年八月八日国家食品药品监督管理局药物临床试验机构资格认定公告(第13号)国食药监安[2007]710号2007年11月26日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中南大学湘雅医院等11家医疗机构具有药物临床试验机构资格并颁发证书,现予以公告。
国家食品药品监督管理局二○○七年十一月二十六日国家食品药品监督管理局药物临床试验机构资格认定公告(第14号)国食药监安[2008]127号2008年04月02日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定河北医科大学第三医院等8家医疗机构具备药物临床试验机构资格并颁发证书。
特此公告。
国家食品药品监督管理局二○○八年四月二日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第15号)国食药监安[2008]279号2008年06月10日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定首都医科大学附属北京中医医院等10家医疗机构具有药物临床试验机构资格并颁发证书。
特此公告。
国家食品药品监督管理局二○○八年六月十日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第16号)国食药监安[2008]490号2008年08月22日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定首都医科大学附属北京友谊医院等14家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
国家食品药品监督管理局二○○八年八月二十二日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第17号)国食药监安[2008]519号2008年09月17日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定安徽省立医院等11家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
国家食品药品监督管理局二○○八年九月十七日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第18号)国食药监注[2009]52号2009年01月22日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定南京市第二医院等8家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
国家食品药品监督管理局二○○九年一月二十二日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第19号)国食药监注[2009]56号2009年02月03日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军总医院等7家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
国家食品药品监督管理局二○○九年二月三日具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第20号)2009年03月13日发布国家食品药品监督管理局公告2009年第9号药品临床试验机构资格认定公告(第20号)根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军第四军医大学口腔医院等10家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○○九年三月十三日附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第21号)2009年07月14日发布国家食品药品监督管理局公告2009年第40号药品临床试验机构资格认定公告(第21号)根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定上海市精神卫生中心等14家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○○九年七月十四日附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第22号)2010年01月22日发布国家食品药品监督管理局公告2010年第4号药品临床试验机构资格认定公告(第22号)根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定济南市中心医院等15家医疗机构具有药物临床试验机构资格,发给《药物临床试验机构资格认定证书》。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○一○年一月二十二日附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局药物临床试验机构资格认定公告(第23号)2010年07月15日发布国家食品药品监督管理局公告2010年第51号药品临床试验机构资格认定公告(第23号)根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定广东省第二中医院等13家医疗机构具有药物临床试验机构资格,发给《药物临床试验机构资格认定证书》。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○一○年七月十五日附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局公告2010年第92号药品临床试验机构资格认定公告(第24号)根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国福利会国际和平妇幼保健院等10家医疗机构具有药物临床试验机构资格,发给《药物临床试验机构资格认定证书》。