2008年江苏省化学竞赛试题
- 格式:doc
- 大小:345.50 KB
- 文档页数:9

第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
1—3画出X 的分子结构示意图1—4 X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。
(注:D 为分配系数,其值指有机相中金属组分浓度与平衡水相中金属组分浓度之比)姓名学校赛场报名号赛区省市自治区第3题(11分)3—1 PCl 3和NH 3在CHCl 3中于195K 时生成A 物质,A 不稳定在稍高温度下即分解为一种不溶于液氨、氯仿等溶剂中的黄色无定形物质B ,B 中含磷68.89%。
写出生成A 的化学反应方程式和A 分解为B 的反应方程式,画出B 的路易斯结构式。
3—2 POCl 3和NH 3作用生成一种易溶于水的晶体C ,它在NaOH 溶液中水解浓缩得化合物D ,D 于483K 时置于真空条件下发生缩合反应生成E ,数天后将E 在水中重结晶得到含十个结晶水的盐类F ,F 和十水焦磷酸钠是等电子体。

中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号 1 2 3 4 5 6 7 8 9 10 11 总分满分14 5 4 10 5 11 14 9 7 11 10 100第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?1-2氨和三氧化硫反应得到一种晶体,熔点205o C,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3 Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
1-4 CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
1-6X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
第2题 (5分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。
2008年江苏省化学竞赛试题一、选择题(每小题有1-2个选项符合题意,每小题4分,共60分)1.嫦娥工程标志着我国航天技术已经达到世界先进水平。
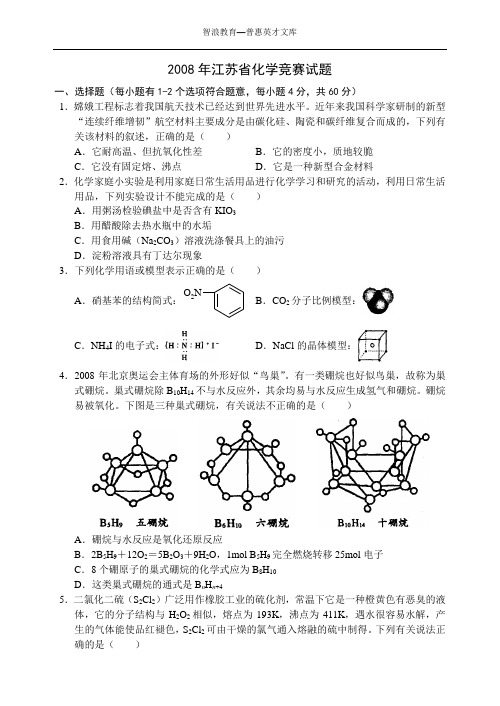
近年来我国科学家研制的新型“连续纤维增韧”航空材料主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列有关该材料的叙述,正确的是()A.它耐高温、但抗氧化性差B.它的密度小,质地较脆C.它没有固定熔、沸点D.它是一种新型合金材料2.化学家庭小实验是利用家庭日常生活用品进行化学学习和研究的活动,利用日常生活用品,下列实验设计不能完成的是()A.用粥汤检验碘盐中是否含有KIO3B.用醋酸除去热水瓶中的水垢C.用食用碱(Na2CO3)溶液洗涤餐具上的油污D.淀粉溶液具有丁达尔现象3.下列化学用语或模型表示正确的是()A.硝基苯的结构简式:O2NB.CO2分子比例模型:C.NH4I的电子式:D.NaCl的晶体模型:4.2008年北京奥运会主体育场的外形好似“鸟巢”。
有一类硼烷也好似鸟巢,故称为巢式硼烷。
巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼烷。
硼烷易被氧化。
下图是三种巢式硼烷,有关说法不正确的是()A.硼烷与水反应是氧化还原反应B.2B5H9+12O2=5B2O3+9H2O,1mol B5H9完全燃烧转移25mol电子C.8个硼原子的巢式硼烷的化学式应为B8H10D.这类巢式硼烷的通式是B n H n+45.二氯化二硫(S2Cl2)广泛用作橡胶工业的硫化剂,常温下它是一种橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得。
下列有关说法正确的是()A.S2Cl2分子中各原子均达到8电子稳定结构B.S2Cl2晶体中不存在离子键C.S2Cl2与水反应后生成的气体难溶于水D.S2Cl2在熔融状态下能导电6.新华社2007年3月21日电,全国科学技术名词审定委员会21日宣布:111号元素(符号为Rg)的中文名称为“”(读音为伦)。


2008年江苏省“化学与可持续发展”化学活动周初中化学竞赛初赛试题(120分钟满分l00分)可能用到的相对原子质量:H-1 N-14 0-16 Na-23 Mg-24 S-32 C1-35.5一、选择题(本题包括l5个小题,每小题2分,共30分。
每小题有l个或2个选项符合题意。
若有两个答案的错选1个不得分,漏选1个扣l分)1.“空气污染指数”是我国城市空气质量日报的主要内容之一。
目前计入其中的各项污染物除可吸人颗粒外,还应包括的气体是( )A.SO2、O2、NO2B.SO2、CO2、NO2C. SO2、N2、NO2D.SO2、CO、NO22.“嫦娥一号”发射的火箭推进器中装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的反应方程式为:2H2O2+A=N2+4H2O,则肼(A)的化学式为( )A.N2H2B.N2H4C. NH2D.N2H4O23.据科学家预测,月球的土壤中吸附着百万吨的氦(He-3),其原子核中质子数为2、中子数为l,每百吨氦(He-3)核聚变所释放出的能量相当于目前人类一年消耗的能量。
下列关于氦(He-3)元素的说法正确的是( )A.原子核外电子数为3B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为4.如图所示,打开止水夹,将液体A滴入试管①中,A与固体B能发生化学反应,同时在试管②中的导管口处观察到有气泡冒出,则下列液体A和固体B的组合中正确的是( )A.稀盐酸和硫酸钠B.稀盐酸和铁C.水和生石灰D.水和氯化钠5.对于化学反应A+B=C+D,下列说法错误的是()A.若A、B为化合物,该反应一定是复分解反应B.若A、C为单质,B、D为化合物,该反应一定是置换反应C.若A为可溶性碱,B为可溶性盐,则C和D可能是两种沉淀物D.若C、D为盐和水,该反应一定是中和反应6.下列各图所示装置的气密性检查中,能说明装置漏气的是( )7.现有t1℃时某溶液l00g,溶质质量分数为20%,溶液密度为1.5g/mL,降温至t2℃时有5g晶体(不含结晶水)析出,则t2℃时溶液的溶质质量分数为( )A.25.4%B.20.3%C.15.8%D.5.9%8.下面是小莉同学用连线的方式对某一主题知识进行归纳的情况,其中完全正确的一组是( )A.性质与用途B.安全常识C.元素与人体健康D.环保与物质的利用9.X 、Y 、Z 、W 是四种不同的金属,为比较金属活动性的大小,某同学利用这四种金属单质、盐酸、Z 的硝酸盐、W 的硝酸盐,进行有关实验,结果如下表(能反应的记为“+”,不能反应的记为“-”,无标记的表示未做该实验)。

● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLiBeB C N O F Na M g Al Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
2002~2008年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题分类原子、分子结构(2002年)1.(12分)⑴如果已经发现167号元素A,若已知的原子结构规律不变,167号元素应是第周期、第族元素;可能的最高氧化态为;氢化物的化学式为。
⑵某一放射性物质衰变20%需15天,该物质的半衰期是。
⑶化合物C H3C H C H2O分子中有种化学环境不同的氢原子。
如果用氯取代分子中的氢原子,生成的一氯代物可能有种。
⑷硅与碳为同族元素,呈四价。
然而,与碳化合物相比,硅化合物的数量要少得多。
碳易于形成双键,硅则不易形成双键。
但据美国《科学》杂志2000年报道,已合成了分子中既有Si-Si单键,又有Si=Si双键的化合物X。
X的分子式为Si5H6,红外光谱和核磁共振表明X分子中氢原子的化学环境有2种,则X的结构式是:。
(2002年)2.(13分)⑴磷和氢能组成一系列的氢化物,如PH3,P2H4,P12H16等。
其中最重要的是PH3。
PH3称为膦,它是一种无色剧毒的有类似大蒜臭味的气体。
它可由NaOH和白磷反应来制备,其制备反应的化学方程式为,P2H4的沸点比PH3(填“高”或“低”),原因是。
AsH3又称胂,试写出由As2O3制备胂的反应方程式,胂的汽化热比膦(填“大”或“小”)。
⑵①根据VSEPR理论,SCl3+和ICl4-的空间构型分别是和,S和I 分别以_______和杂化轨道同Cl形成共价键。
② SCl3+和PCl3是等电子体,其S-Cl键键长(填>、=或<)P-Cl键键长,原因是。
(2003年)第2题(共8分)⑴根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、__________杂化轨道同相应的键合原子成键。
其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。
⑵最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
2008学年江苏南通中学高二化学竞赛题2008.12一、选择题(共25小题,满分50分)1、若前20号元素中两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是()A、1B、3C、5D、62、含有离子的晶体有()A、分子晶体B、原子晶体C、金属晶体D、以上均不对3、下列溶液中的c(Cl-)与50mL1mol·L-1氯化铝溶液中的c(Cl-)相等的是()A.150mL 1mol·L-1氯化钠溶液B.75 mL 2mol·L-1氯化铵溶液C.150 mL 3mol·L-1氯化钾溶液D.50 mL 1mol·L-1氯化亚铁溶液4、六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。
下列关于土卫六的说法中,不正确的是()A.土卫六上存在有机分子B.地表温度极高C.地貌形成与液态甲烷冲刷有关D.土卫六上形成了甲烷的气液循环系统5、只用水就能鉴别的一组物质是()A.苯、乙酸、四氯化碳B.乙醇、乙醛、乙酸C.乙醛、乙二醇、硝基苯D.苯酚、乙醇、甘油6、27.2g铁粉和氧化铁的混合物,放入500mL的稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol/L NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质质量的浓度为()。
A.4mol/L B. 3mol/L C. 2mol/L D. 1mol/L7、在一定温度下,向饱和硫酸钠溶液中加入a克无水硫酸钠粉末,搅拌、静置后,析出b 克Na2SO4·10H2O,则b-a的值是()。
A.原饱和溶液失去水的质量B.原饱和溶液中减少的硫酸钠的质量C.原饱和溶液中失去水和硫酸钠的质量D.析出晶体含有水的质量8、向10mL 0.1mol/L的硫酸铜溶液中加入10mL 0.15mol/L的氢氧化钠溶液时,产生一种蓝色沉淀,经测定溶液中的铜离子已几乎被沉淀完全。
2008年江苏省化学竞赛试题一、选择题(每小题有1-2个选项符合题意,每小题4分,共60分)1.嫦娥工程标志着我国航天技术已经达到世界先进水平。
近年来我国科学家研制的新型“连续纤维增韧”航空材料主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列有关该材料的叙述,正确的是()A.它耐高温、但抗氧化性差B.它的密度小,质地较脆C.它没有固定熔、沸点D.它是一种新型合金材料2.化学家庭小实验是利用家庭日常生活用品进行化学学习和研究的活动,利用日常生活用品,下列实验设计不能完成的是()A.用粥汤检验碘盐中是否含有KIO3B.用醋酸除去热水瓶中的水垢C.用食用碱(Na2CO3)溶液洗涤餐具上的油污D.淀粉溶液具有丁达尔现象3.下列化学用语或模型表示正确的是()A.硝基苯的结构简式:O2NB.CO2分子比例模型:C.NH4I的电子式:D.NaCl的晶体模型:4.2008年北京奥运会主体育场的外形好似“鸟巢”。
有一类硼烷也好似鸟巢,故称为巢式硼烷。
巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼烷。
硼烷易被氧化。
下图是三种巢式硼烷,有关说法不正确的是()A.硼烷与水反应是氧化还原反应B.2B5H9+12O2=5B2O3+9H2O,1mol B5H9完全燃烧转移25mol电子C.8个硼原子的巢式硼烷的化学式应为B8H10D.这类巢式硼烷的通式是B n H n+45.二氯化二硫(S2Cl2)广泛用作橡胶工业的硫化剂,常温下它是一种橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得。
下列有关说法正确的是()A.S2Cl2分子中各原子均达到8电子稳定结构B.S2Cl2晶体中不存在离子键C.S2Cl2与水反应后生成的气体难溶于水D.S2Cl2在熔融状态下能导电6.新华社2007年3月21日电,全国科学技术名词审定委员会21日宣布:111号元素(符号为Rg)的中文名称为“”(读音为伦)。
下列说法正确的是()A.111号元素是第六周期、第ⅣA的金属元素B.111号元素为过渡元素C.111号元素为非金属元素D.111号元素质量数为1117.有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出m g NaCl晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a仪器的刻度线,即可测出NaCl固体的体积。
上述操作中的a、b、c分别指()A.量筒、酸式滴定管、水B.容量瓶、碱式滴定管、苯C.量筒、碱式滴定管、水D.容量瓶、酸式滴定管、四氯化碳8.冰是立方面心结构。
下列是碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排列),其中与冰的晶体结构类型相同的是()A. B.C. D.9.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。
当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是()A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3C.B和Cl2的反应是氧化还原反应D.当X是强酸时,C在常温下是气态单质10.下列离子方程式正确的是()A.硫酸亚铁在空气中氧化:4Fe2++3O2+6H2O=4Fe(OH)3B.向硝酸银溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+C.向硫酸铝铵矾溶液中滴加过量的氢氧化钡溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-11.下列关于某溶液所含离子检验的方法和结论正确的是()A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I-C.加入盐酸产生能使澄清石灰水这浑浊的气体,由原溶液中一定有CO32-或SO32-D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42-12.氢核磁共振谱是根据分子中不同化学环境的氢原子在谱图中给出的信号峰不同来确定分子中氢原子种类的。
在下列有机分子中,氢核磁共振谱中给出的信号峰数目相同的一组是()CH 3① ② ③ ④ ⑤ ⑥A .①⑤B .②④C .④⑤D .⑤⑥13.茉莉醛具有浓郁的茉莉花香,其结构简式如右图所示:关于茉莉醛的下列叙述正确的是( ) A .茉莉醛与苯甲醛互为同系物B .在加热和催化剂作用下加氢,每摩尔茉莉醛最多能消耗2mol 氢气C .一定条件下,茉莉醛能被银氨溶液、新制氢氧化铜等多种氧化剂氧化D .从理论上说,202g 茉莉醛能从足量银氨溶液中还原出216g 银14.右图是一水溶液在pH 从0至14的范围内H 2CO 3、HCO 3-、CO 32-三种成分平衡时组成分数,下列叙述正确的是( )A .此图是1.0 mol/L 碳酸钠溶液滴定1.0 mol/LHCl 溶液的滴定曲线B .在pH 为6.37及10.25时,溶液中c (H 2CO 3)=c (HCO 3-)=c (CO 32-)C .人体血液的pH 约为7.4,则CO 2在血液中多以HCO 3-形式存在D .若用CO 2和NaOH 反应制取Na 2CO 3,溶液的pH必须控制在12以上15.如图I 所示,甲、乙之间的隔板K 和活塞F 都可以左右移动,甲中充入2mol A 和1 molB ,乙中充入2molC 和1mol He ,此时K 停在0处。
在一定条件下发生可逆反应:2A(g)+B(g)2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是()A .达到平衡时,隔板K 最终停留在0刻度左侧的0到2之间B .若达到平衡时,隔板K 最终停留在左侧1处,则乙中C 的转化率小于50%C .若达到平衡时,隔板K 最终停留在左侧靠近2处,则乙中F 最终停留在右侧的刻度大于4D .如图II 所示,若x 轴表示时间,则y 轴可表示甲、乙两容器中气体的总物质的量或A 的物质的量二、(本题共2小题,共13分)16.(7分)柠檬酸三正丁酯(简称TBC )是一种新型绿色环保塑料增塑剂,无毒无味,是可诱发致癌增塑剂邻苯二甲酸酯类的较好替代品。
广泛应用于食品及药品包装、化妆品、日用品、玩具、军用品等领域。
TBC 的传统生产方法是以浓硫酸作催化剂,该方法存在酯化率低、流程长、腐蚀设备和污染环境等问题。
近年来有文献报道用固体强酸SO 42-/TiO 2/La 3+替代浓硫酸制备TBC ,该催化剂具有酸性强,不腐蚀设备,不污染环境,与C CH CH 2(CH 2)3CH 3CHO产物分离方便等特点,是一种对环境友好的催化剂。
实验步骤如下:在装有温度计、搅拌器、分水器(上端接一回流冷凝管)的四口烧瓶中,加入6.4g 含有一个结晶水的柠檬酸[HOC(CH2COOH)2COOH·H2O]和10.0g正丁醇,搅拌加热,加入适量催化剂,测反应液初始pH。
,控制反应温度在110~145℃,当体系开始蒸馏出醇水共沸物时,记录出水量。
反应结束后,将体系冷却到90℃左右,加入1%的碳酸钠溶液搅拌,经分液、干燥、过滤、蒸馏得到无色透明的油状液体TBC9.8g。
(1)写出合成TBC的反应方程式。
(2)本实验中TBC的产率为。
(3)欲提高TBC的产率可采用的措施有(写出两个即可)。
(4)本实验如何控制反应的终点?。
(5)后处理步骤中蒸馏一步的目的是。
17.(6分)五水合硫代硫酸钠的分子式为Na2S2SO3·5H2O是一种白色块状结晶,俗称“摄影师的海波”,可通过向多硫化钠(Na2S5)的乙醇水溶液中通入氧气来合成,SO2是该反应仅有的另一生成物。
多硫化钠(Na2S5)通过硫化氢(H2S)与硫化钠(Na2S)在乙醇溶液中反应来制备。
Na2S是H2S中和NaOH的产物。
(1)请写出由硫化氢和NaOH为起始物制备海波的3个化学反应方程式:(2)若上述反应中多硫化钠的化学式为Na2S x,生成物中SO2与Na2S2O3·5H2O的物质的量之比是。
三、(本题共3小题,共22分)18.(7分)在石油化工领域,人们常用NaOH水溶液洗涤石油裂解气以除去其中的二氧化硫和硫化氢,后来经过技术改进某厂家用三乙醇胺的水溶液代替氢氧化钠水溶液,三乙醇胺N(CH2CH2OH)3可以看作是氨的衍生物,即用乙醇基(-CH2CH2OH)代替了氨分子里的氢而形成。
结果该厂家因此大增加了年产值。
请回答以下问题:(1)三乙醇胺比氨的碱性(填“强”或“弱”),其原因是。
三乙醇胺比氨的沸点(填“高”或“低”),其原因是。
(2)请写出三乙醇胺除去二氧化碳和硫化氢的化学反应方程式。
(3)请解释为什么三乙醇胺代替氢氧化钠可以增加年产值?19.(8分)上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。
在随后的几年内,科学家又相继合成了氙的氟化物、氧化物、氟氧化物以及含氧酸盐等。
氪和氡的个别化合物也已制得,但前者很不稳定,后者难于表征。
(1)只有较重的稀有气体氙能合成出多种化合物,其原因是。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大(2)氙的化合物中,多数是含有氟和氧的,其原因是。
A.氟、氧的电负性大 B.氟、氧的原子半径小 C.氟、氧的氧化性强(3)氡的化合物难于表征,原因是。
A.氡的原子半径大 B.氡的电离能大 C.氡是强放射性元素,无稳定的同位素(4)已知XeO3是三角锥形结构,则其中氙原子轨道杂化类型为,氙原子的孤对电子数为。
(5)二氟化氙是强氧化剂。
1968年,解决了无机化学上长期努力未获成功的一个难题。
试写出该反应的离子方程式。
20.(7分)A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图:已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I 常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃)。
请回答下列问题:(1)写出B的化学式。
(2)电解A的化学方程式。
(3)写出下列反应的离子方程式:电解E水溶液。
过量F与H溶液反应。
四、(本题共2小题,共17分)21.(10分)有三个化合物A、B和C,分子式均为C6H12,当1 mol A、B和C分别催化氢化时,它们都可以吸收1mol H2,生成3-甲基戊烷。