中考溶解度整理
- 格式:doc
- 大小:740.50 KB
- 文档页数:6


人教部编版初中化学中考溶解度知识及解题技巧物质的溶解度一、定义:一种物质溶解在另一种物质里的能力叫溶解性.溶解性的大小与溶质和溶剂的性质有关.根据物质在20℃时溶解度的大小不同,把物质的溶解性通常用易溶、可溶、微溶、难溶等概念粗略地来描述.二、固体的溶解度概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度.在理解固体的溶解度概念时,要抓住五个要点:①“在一定温度下”:因为每种固体物质的溶解度在一定温度下有一个对应的定值,但这定值是随温度变化而变化的,所以给某固体物质的溶解度时,必须指出在什么温度下的溶解度才有意义.②“在100g溶剂里”:溶剂质量有规定的值,统一为100g,但并不是100g溶液,在未指明溶剂时,一般是指水.③“饱和状态”:所谓饱和状态,可以理解为,在一定温度下,在一定量的溶剂里,溶质的溶解达到了最大值.④“所溶解的质量”:表明溶解度是有单位的,这个单位既不是度数(°),也不是质量分数(%),而是质量单位“g”.⑤“在这种溶剂里”:就是说必须指明在哪种溶剂里,不能泛泛地谈溶剂.因为同一种物质在不同的溶剂里的溶解度是不相同的.三、影响固体溶解度大小的因素①溶质、溶剂本身的性质.同一温度下溶质、溶剂不同,溶解度不同.②温度的高低也是影响溶解度大小的一个重要因素.固体物质的溶解度随温度的不同而不同.大多数固态物质的溶解度随温度的升高而升高;少数物质(如氯化钠)的溶解度受温度的影响很小;也有极少数物质(如熟石灰)的溶解度随温度的升高而降低.四、固体物质溶解度的计算1、纯净物与含杂质物质的换算关系:含杂质物质的质量×纯物质质量分数=纯净物质的质量纯净物质的质量÷纯物质质量分数=含杂质物质的质量物质纯度= 纯净物质量/混合物质量×100% = 1—杂质的质量分数2.含杂质物质的化学方程式的计算步骤:(1)将含杂质的物质质量换算成纯净物的质量。

中考必考考点-溶解度考点1 饱和溶液与不饱和溶液1.概念:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做该溶质的饱和溶液;溶质还能继续溶解的溶液,叫做该溶质的不饱和溶液。
2.理解:①明确条件:“一定温度下”,“一定量溶剂”②某物质的饱和溶液只是不能继续溶解这种物质,但是还可能继续溶解其他物质。
③有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
④当温度确定、溶剂量确定时,某溶液饱和状态表示该溶质溶解的最大值。
3. 判断溶液是否饱和的方法向溶液中加入该溶质,观察溶质是否继续溶解,如不再溶解,那么这种溶液就是该溶质的饱和溶液。
下面两种情况可以直接判定:①一定温度下,一定量的溶剂中,有未溶固体,且固体的质量不再减少。
②有溶质析出后所得到的溶液一定是该溶质的饱和溶液。
4.饱和溶液与不饱和溶液的相互转化(1)绝大多数固体(2)氢氧化钙(留心温度对它的影响)注:溶质为气体时,不能用蒸发溶剂的方法将不饱和溶液转化为饱和溶液,如盐酸。
5.浓溶液、稀溶液、饱和溶液与不饱和溶液对不同的溶质来说,溶液的浓稀与溶液是否饱和无关,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。
但是对相同溶质,在相同温度下,饱和溶液一定比不饱和溶液浓度大考点21.固体的溶解度①概念:在一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
③若不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
④固体溶解度的影响因素内因:溶质和溶剂的性质。
外因:温度a.大多数物质的溶解度随温度升高而显著增大,如KNO3。
b.少数物质的溶解度受温度的影响不大,如NaCl 。
c.极少数物质的溶解度随温度升高而减小,如Ca(OH)2 。
⑤固体物质的溶解性与溶解度的关系2.气体的溶解度用于医疗手术、超导材料。
①概念:通常讲的气体溶解度是指该气体在压强为101KPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。


一、饱和溶液与不饱和溶液1.饱和溶液与不饱和溶液的定义在一定温度下,向一定量溶剂里加入某液;当溶质还能继续溶解时,所得到的溶液2.对饱和溶液与不饱和溶液的理解(1)首先,要明确“一定温度”和“一定相转化的。
(2)其次,要明确“某一溶质的”饱和还能溶解KNO 3,此时的溶液是NaCl 的饱的饱和或不饱和溶液。
(3)有些物质能与水以任意比互溶3.饱和溶液与不饱和溶液的转化条件(1)一般规律:此转化条件适合大多数固体物质的溶液(2)特殊情况(如氢氧化钙):极少数物质在一定量水中溶解的最大溶液时,要升高温度;若把饱和溶液转化4.判断溶液是否饱和的方法一般地,可以向原溶液中再加入少量原继续溶解,则说明原溶液是该溶质的不饱和如果有且溶质的量不再减少,未溶解的溶质二、固体的溶解度1.定义在一定温度下,某固态物质在100 g 溶剂里度。
如果不说明溶剂,通常所说的溶解度是2.正确理解溶解度概念需要抓住的四个要(1)条件:一定温度。
因为物质的溶解度溶解度溶液加入某种溶质,当溶质不能继续溶解时,所得到的溶的溶液叫做这种溶质的不饱和溶液。
理解一定量的溶剂”。
因为改变溶剂量或温度时,饱和溶饱和溶液或不饱和溶液。
例如,在一定温度下不能再的饱和溶液,对KNO 3来说就不一定是饱和溶液了互溶,不能形成饱和溶液,如酒精没有饱和溶液。
化条件 的溶液,因为大多数固体物质在一定量水中溶解的最的最大量随温度的升高而降低(如熟石灰),此类物质转化成不饱和溶液,要降低温度。
少量原溶质,如果不能继续溶解,说明原溶液是该溶不饱和溶液。
或者在一定温度下,看该溶液中有没有不的溶质与溶液共存,那么这种溶液就是这种溶质的饱溶剂里达到饱和状态时所溶解的质量,叫做这种固态度是指物质在水里的溶解度。
四个要点溶解度随温度的变化而变化,所以不指明温度时,溶解到的溶液叫做这种溶质的饱和溶饱和溶液与不饱和溶液是可以互不能再溶解NaCl 的溶液,可能液了。
因此必须指明是哪种溶质解的最大量随温度升高而增大。
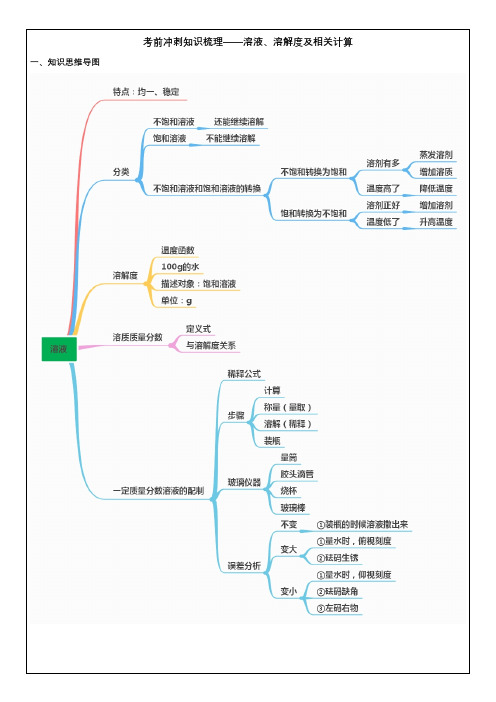
中考化学溶液知识点总结【考点1】溶液的概念和基本特征一、溶液的概念1。
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2.溶液的组成:溶液是混合物,由溶质和溶剂组成。
溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质体积+溶剂体积溶质:被溶解的物质.可以是固体、液体或气体。
一种溶液中的溶质可以是一种或多种物质。
溶剂:能溶解其他物质的物质。
水是最常见的溶剂。
汽油、酒精也可以作为溶剂。
二、溶液的基本特征①均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。
如溶液中部分的浓度、密度和颜色完全一样。
②稳定性:外界条件不变是溶液长期放置,溶质不会从溶液中分离出来.③是混合物。
【规律】溶液的判别(1)澄清透明不代表是无色的。
(2)均一稳定的液体不一定是溶液,如水。
【举例】硬水、空气、纯净水属于溶液;泥水,油水,蒸馏水不是溶液.【技巧】溶质、溶剂的判定①通常不指明溶剂的溶液,一般是水溶液。
②当固体、气体溶于液体时,固体、气体做溶剂,液体做溶剂。
③当两种液体互相溶解时,量多的叫做溶剂,量少的叫做溶质。
④当物质溶解发生化学变化时,一定要正确判断溶质。
⑤溶质和溶剂是溶液所特有的概念,悬浊液和乳浊液不存在溶质和溶剂.⑥溶质质量是指溶液中已溶解溶质的质量。
【拓展】影响物质溶解能力的因素:1、相似相容,溶质和溶剂的性质相似,溶解能力越强.如:氯化钠易溶于水,难溶于油,碘易溶于汽油,那溶于水。
1、大部分物质稳定越高,溶解能力越强.对于气体,压强越大溶解能力越强。
【考点2】溶液和浊液1、浊液:包括乳浊液和悬浊液。
2、乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
悬浊液:固体颗粒分散到液体里形成不均一的、不稳定的混合物叫悬浊液。
3、溶液和浊液的区别【考点3】乳化现象1.乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
2.乳化现象:使植物油分散成无数细小的液滴,而不聚集成大的油珠,这些细小的液滴能随着水流走,这个现象叫乳化现象。
溶解度口诀
溶解度是指在一定温度下,溶质与溶剂能够形成饱和溶
液的最大质量或体积。
溶解度的大小直接影响着溶质在溶液中的浓度,是化学中非常重要的一个概念。
为了方便记忆,我们可以利用一些口诀来记忆常见物质
的溶解度规律。
下面是一些溶解度口诀:
1. “冰壶糖甜”:冰、壶、糖、甜的音节相同,可以表
示溶解度从大到小的顺序。
冰的溶解度最大,壶的溶解度稍小,糖的溶解度小一些,甜的溶解度最小。
2. “五化三游”:五、化、三、游的音节相同,可以表
示溶解度从大到小的顺序。
五指山的溶解度最大,化学的溶解度稍小,三峡的溶解度小一些,游离态离子的溶解度最小。
3. “双氯酸三碘离”:双、氯、酸、三、碘、离的音节
相同,可以表示溶解度从大到小的顺序。
双氯酸的溶解度最大,次之是三碘化物的溶解度,离子的溶解度最小。
4. “并氯高溴乙酯”:并、氯、高、溴、乙、酯的音节
相同,可以表示溶解度从大到小的顺序。
并非所有的物质都有明确的溶解度规律,但是通过这种方式可以记忆一些特殊情况下的溶解度顺序。
记忆这些口诀只是一种辅助记忆的方法,实际应用时还
需要查看实验数据和相关参考资料。
溶解度是一个复杂的概念,受到许多因素的影响,如温度、压力等。
因此,在具体的学习和实验中,还需要进一步深入理解和探索。
1、下表是KNO 3、NaCl在不同温度下的溶解度(单位:g/100g水)温度0102030405060708090100(℃)KNO313.320.93245.86485.5110138169202246 NaCl35.735.83636.336.63737.337.838.43939.8①以上两种物质溶解度的变化受温度影响较大的是________。
②30℃时,KNO3的溶解度是___________。
③KNO3溶液中含有少量NaCl时,可通过____________的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是________(填写编号)。
Ⅰ.剩余溶液一定是KNO3饱和溶液Ⅱ.剩余溶液一定是NaCl不饱和溶液Ⅲ.上述方法可以将两者完全分离Ⅳ.析出的晶体中只含有KNO3⑤在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。
改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是_____________(硝酸钾和氯化钠溶解度互不影响)。
2、溶解度可表示物质溶解性的大小。
①右下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。
请填写下表。
烧杯中的溶质烧杯中固体的变化甲_____________________________乙固体逐渐减少至全部溶解丙_____________________________②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。
由此可见,压强越小,CO2的溶解度越_________。
为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
溶解度1.下图为氯化铵和硫酸钠的溶解度曲线。
下列说法中不正确...的是( )A .30℃时,氯化铵、硫酸钠的溶解度相同B .氯化铵的溶解度随温度的升高而增大C .将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析D .将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变2. KCl 是一种常用的钾肥,其溶解度如下表。
下列说法正确的是( )温度/℃ 020 40 60 溶解度/g 27.6 34.0 40.0 45.5A .KCI 饱和溶液中不能再溶解其他物质B .20℃时,100 g KCl 饱和溶液中含KCI 34.0 gC .40℃时,KCl 饱和溶液的质量分数为40.0%D .60℃的KCl 饱和溶液降温至20℃,有晶体析出3.甲、乙两种固体的溶解度曲线如右下图。
将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。
升高温度后,下列有关说法正确的是( )A. ①②两溶液的质量一定相等B. ①②两溶液均变为不饱和溶液C . ①溶液质量增加,②溶液质量减少D. ①溶液中溶质的质量分数一定大于②溶液4.右下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是 ( )A .t 2℃时,甲、乙两种物质的溶解度相等B .甲的溶解度随温度的升高而增大C .分别将t 3℃时甲、乙、丙的饱和溶液降温至t 1℃,则 所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D .t 1℃时,丙的饱和溶液中溶质的质量分数为40% 5.下列有关溶液的说法正确的是( ) A .盐水的沸点比水低 B .无色澄清液体一定是溶液C .只有固体能作溶质D .溶液的各部分性质均相同6.厨房中的下列物质与水充分混合后,不能..形成溶液的是( ) A . 花生油 B. 白糖 C. 纯碱 D. 食盐7.小琪往右图所示的烧杯中加入一种物质,搅拌后,发现塑料片的水结了冰。
她加入的物质是( )A .食盐B .硝酸铵C .生石灰D .氢氧化钠固体8.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体至溶液刚好饱和,在这一过程中,下列各量:① 溶液中水的质量,② 溶液中溶质的质量,③ 溶液中氯化钾的质量分数,④ 25℃时氯化钾的溶解度,⑤ 氯化钾溶液的质量。
其中不变的是 ( )A .①和④;B .②和③C .③和④D .④和⑤9.物质在溶解时,常常会使溶液的温度发生改变。
下列物质溶于水时,温度无明显变化.....的是( )A .浓硫酸B .氢氧化钠固体C .硝酸铵固体D .食盐10. t ℃时,向10 g 水中逐渐加入硝酸钾晶体至饱和,则此过程中该溶液满足下图a 、b 两个变量的变化关系的是( )A.a -溶解度,b -溶质质量B.a -溶质的质量分数,b -溶质质量C.a -溶质质量,b -溶剂质量D.a -溶解度,b -溶剂质量11..右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。
下列甲 乙 丙40 0 t 1 t 2 t 3 溶解度/g 温度/℃说法正确的是( )A.b 的溶解度大于a 的溶解度B .t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等C.将t 2℃时的b 的不饱和溶液降温至t 1℃,一定能得到b 的饱和溶液D.t 2℃时,a 溶液的溶质质量分数一定小于b 溶液的溶质质量分数12.右图是甲、乙两种固体物质的溶解度曲线。
据此判断下列说法不正确的是:( )A.t 2℃时,甲、乙的溶解度相等[来源:]B . t 3℃时,将60g 乙加入100g 水中可得l60g 溶液C .乙的溶解度受温度影响很小D .t l ℃时,乙的溶解度大于甲的溶解度13.下图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )A .1t ℃时甲、乙、丙三者的溶解度相等B .1t ℃时甲、乙、丙三者饱和溶液的溶质质量分数相等C .要使1t ℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法D .2t ℃时,往100g 水中加入90g 甲,充分搅拌后得到190g甲的溶液14. 右图是a 、b 两种固体物质的溶解度曲线。
从图中可获得的信息是( )A. 固体物质的溶解度均随温度升高而增大B .t ℃,相同质量的a 、b 溶解时放出热量相同C .升高温度,可使a 或b 的饱和溶液变为不饱和溶液D .将相同质量的a 、b 分别加入100g 水中,所得溶液质量分数相同15..(4分)请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm 3)实验操作 实验结果取100mL 水,加入25g 硝酸钾,搅拌,恢复至20°C全部溶解,得溶液①再加w g 硝酸钾,搅拌,恢复至20°C恰好饱和,得溶液②再加25g 硝酸钾,搅拌,恢复至20°C得溶液③加热 全部溶解,得溶液④冷却至20°C 析出晶体,得溶液⑤(1)③中溶液的质量为________g;一定属于不饱和溶液的是___________(填序号,下同);溶质的质量分数一定相等的是____________。
(2)析出晶体的质量为___________。
A.25gB.(w +25)gC.(w +50)g16.4分)右图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。
请你根据图示回答问题:(1)t 1℃时,a 物质的溶解度 b 物质的溶解度(填“>”、“<”或“=”)。
(2)将t 2℃时a 、b 两种物质相同质量的饱和溶液,分别冷却到t 1℃,析出晶体最多的是 物质。
(3)溶解度曲线图中的任何一点都表示溶液的一种特定状态。
图中A、B两个状态中,溶液属于不饱和状态的 ,是 ,状态最不稳定的是 。
17.右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:(1)t 1℃时,甲物质的溶解度 乙物质的溶解 度(填“>”、“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 物质。
(3)t 2℃时,把100g 乙物质放入100g 水中,充分搅拌,所得溶液是 溶液(填“饱和”或“不饱和”)。
(4)t 2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使它变为饱和溶液。
18.甲、乙物质在不同温度下的溶解度如右图所示。
请根据溶解度曲线回答下列问题:(1)40℃甲物质的溶解度是 。
(2)现有一瓶接近饱和的甲物质水溶液,列举出两种能使它变成饱和溶液的方法 、 。
(3)20℃时,向装有100g 水的烧杯中加入45g 乙物质,充分搅拌后静置,所得的溶液是该温度下乙物质的 溶液(填“饱和”或“不饱和”),这种溶液中乙物质的质量分数是 (精确到0.1%)19. (3分)甲、乙两种物质的溶解度曲线如右图。
(1)20℃时,甲物质的溶解度为 g ;(2) 欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是 ;(3) 40℃时,将甲、乙两物质的饱和溶液各100g ,分别降温到20℃,所得甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量。
[来源:学科网]20. (4分)甲、乙两种固体物质的溶解度曲线如下图所示。
现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。
(1)50℃时,甲物质的溶解度是 。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是 。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是 。
除了加浓硫酸外,还可以加 物质,也会发生这样的变化。
21. (4分)右图是A 、B 两种物质的溶解度曲线,请回答:(1)t 3℃时,把46g 固体A 放入100g 水中,充分溶解后可得到A的 溶液(填“饱和”或“不饱和”)。
(2)t 1℃时,A 、B 两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把t l ℃时A 、B的饱和溶液分别升温至t 2℃,此时两种溶液中溶质的质量分数的大小关系为A B :若把t 3℃时A 、B 的饱和溶液分别降温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B 。
22.(3分)已知A 、B 两种固体的溶解度曲线如图所示,试回答下列问题:(1)在t 1℃时,溶解度A B (填<、=、>)。
(2)将A 的某溶液温度从t 2℃降至t 1℃,溶液(填一定甲 乙 0 t 1 t 2 温度/℃溶解度/g 80会、可能会、一定不会)有晶体析出。
(3)欲使t1℃时B的饱和溶液变为不饱和溶液,可采取的措施是。
23..(4分)甲、乙两种物质的溶解度曲线如右图。
(1)20℃时,甲物质的溶解度为g;(2) 40℃时,把40g甲物质放入100g水中,所得的溶液是(选填“饱和”或“不饱和”);(3)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是;(4) 40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量(选填“>”或“=”或“<”)乙物质溶液的质量。
24.右图是某固体物质的溶解度曲线。
(1)30℃时,该物质的溶解度为g。
(2)50℃时,将40g该物质加入到l00g水中,搅拌后得到的是(填“饱和"或“不饱和”)溶液;将该溶液降温到20℃时可析出晶体g25.甲、乙两种固体的溶解度曲线如右图所示。
(1)℃时,甲和乙的溶解度相等;(2)40℃时,若将40g乙(不含结晶水)放入160g水中充分溶解,所得溶液的溶质质量分数为,该溶液是溶液(填“饱和”或“不饱和”);(3)40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体(均不含结晶水)的质量关系是:m(甲) m(乙) (填“﹥”、“﹦”或“﹤”)。
26.右图为氯化钠、碳酸钠在水中的溶解度曲线。
请回答下列问题:(1)氯化钠溶液中的溶剂是;(2)10℃时,碳酸钠的溶解度为g;(3)30℃时,氯化钠的溶解度碳酸钠的溶解度(填写“>”、“<”或“=”);(4)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是溶液(填化学式);(5)如右图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。
加入的物质可能是________(填字母序号)。
A.氢氧化钠B.生石灰C.硝酸铵D.浓硫酸27. (8分)海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的化学资源。
我市具有较长的海岸线,海洋资源开发前景广阔。
(1)目前海水淡化普遍采用的方法是,证明得到的水是淡水的方法是。
(2)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,人们还在海底发现了一种新型矿产资源是,被科学家誉为"21世纪能源”。