实验六血清ALT活性测定1
- 格式:ppt
- 大小:688.02 KB
- 文档页数:17


血清谷丙转氨酶实验报告血清谷丙转氨酶实验报告血清谷丙转氨酶(Alanine Aminotransferase,简称ALT)是一种存在于肝脏细胞中的酶类物质,它在肝脏功能评估中起着非常重要的作用。
通过检测血液中的ALT水平,可以帮助医生判断肝脏是否受损或存在疾病。
一、实验目的本次实验的目的是通过测量血清中ALT的含量,了解被检测对象的肝脏功能是否正常。
通过对实验结果的分析,可以初步判断是否存在肝脏疾病,并为进一步的诊断和治疗提供参考依据。
二、实验方法1. 实验前准备:准备好实验所需的血清样本、试剂和仪器设备,确保实验环境清洁卫生。
2. 采集血清样本:选择合适的部位,用无菌针头采集被检测对象的静脉血液。
注意遵守无菌操作规范,避免外界污染。
3. 血清分离:将采集到的血液样本放置于离心管中,以适当的转速离心一段时间,使血液分离成血清和红细胞。
4. ALT检测:将分离得到的血清样本转移至ALT检测仪器中,按照仪器操作说明进行操作。
仪器会自动测量ALT的含量,并显示结果。
三、实验结果根据实验测得的结果,ALT的含量可以分为正常范围和异常范围。
正常范围通常是男性10-40 U/L,女性7-35 U/L。
如果实验结果显示ALT的含量超出正常范围,可能意味着肝脏受损或存在疾病。
四、结果分析1. ALT升高的原因:ALT升高可能是由于肝脏炎症、肝细胞坏死、肝损伤等原因导致。
常见的疾病如肝炎、脂肪肝、肝硬化等都会引起ALT的升高。
2. ALT降低的原因:ALT降低可能是由于肝脏功能减退或肝细胞受损导致。
例如,肝功能衰竭、肝癌等情况下,ALT的含量通常会降低。
五、临床意义ALT作为肝脏功能的指标之一,对于肝脏疾病的早期诊断和治疗具有重要意义。
通过检测ALT的含量,可以帮助医生判断肝脏是否受损,并及时采取相应的治疗措施。
六、实验注意事项1. 实验操作要规范:在实验过程中,要严格遵守无菌操作规范,避免外界污染。
同时,仪器操作要按照说明书进行,确保结果准确可靠。

血清谷丙转氨酶实验报告背景介绍血清谷丙转氨酶(alanine aminotransferase,简称ALT)是一种存在于肝脏中的酶类物质,主要参与蛋白质的代谢过程。
正常情况下,ALT的活性较低,而当肝脏受到损伤时,ALT会释放到血液中,血液中的ALT水平也会升高。
因此,检测血清中ALT的水平可以作为评估肝脏功能以及肝脏疾病的重要指标之一。
实验目的本实验旨在通过检测血清中ALT的水平,了解被检测个体的肝脏功能状态,提供诊断肝脏疾病的参考依据。
实验材料1.血清样本:被检测个体的血清样本,需通过静脉采血获取。
2.ALT试剂盒:包含必要的试剂和材料,用于检测血清中ALT的水平。
实验步骤1.获取血清样本:用无菌的注射器从被检测个体的静脉中采集足够的血液样本,约5-10毫升即可。
2.处理血清样本:将采集到的血液样本放置在无菌离心管中,离心约10分钟以分离血清和血细胞。
将分离得到的血清转移至干净的试管中。
3.准备实验室试剂:取出ALT试剂盒,按照说明书中的指引,准备所需的试剂和材料。
4.进行实验操作:根据ALT试剂盒的说明,将一定量的血清样本与试剂盒中的试剂混合,进行反应。
反应时间和条件需根据试剂盒的要求进行。
5.反应结果读取:按照ALT试剂盒说明,使用光度计等设备测量反应体系的吸光度。
吸光度的数值与血清中ALT的浓度成正比。
6.数据分析和结果解读:根据测定结果,比较样本中ALT的浓度与正常范围进行对比。
若ALT浓度超过正常范围,可能提示存在肝脏损伤或疾病。
结果与讨论本实验的结果即为测定得到的血清中ALT的浓度。
根据测定结果,我们可以初步判断被检测个体的肝脏功能状态。
若ALT浓度超过正常范围,可能存在肝脏疾病,需要进一步的检查和诊断。
值得注意的是,ALT浓度的升高不一定说明肝脏疾病,还可能受到其他因素的影响,如药物的使用等。
结论通过本实验,我们可以通过检测血清中ALT的水平来评估被检测个体的肝脏功能状态。
ALT浓度的升高可能提示肝脏损伤或疾病,但需要结合其他临床检查和诊断方法来进行综合分析和判断。

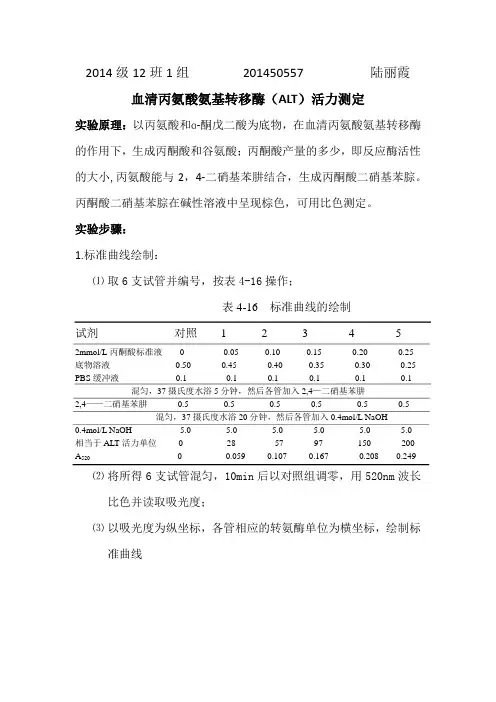
2014级12班1组201450557 陆丽霞血清丙氨酸氨基转移酶(ALT)活力测定实验原理:以丙氨酸和ɑ-酮戊二酸为底物,在血清丙氨酸氨基转移酶的作用下,生成丙酮酸和谷氨酸;丙酮酸产量的多少,即反应酶活性的大小,丙氨酸能与2,4-二硝基苯肼结合,生成丙酮酸二硝基苯腙。
丙酮酸二硝基苯腙在碱性溶液中呈现棕色,可用比色测定。
实验步骤:1.标准曲线绘制:⑴取6支试管并编号,按表4-16操作;表4-16 标准曲线的绘制试剂对照 1 2 3 4 52mmol/L丙酮酸标准液0 0.05 0.10 0.15 0.20 0.25底物溶液0.50 0.45 0.40 0.35 0.30 0.25 PBS缓冲液0.1 0.1 0.1 0.1 0.1 0.1 混匀,37摄氏度水浴5分钟,然后各管加入2,4—二硝基苯肼2,4——二硝基苯肼0.5 0.5 0.5 0.5 0.5 0.5混匀,37摄氏度水浴20分钟,然后各管加入0.4mol/L NaOH0.4mol/L NaOH 5.0 5.0 5.0 5.0 5.0 5.0相当于ALT活力单位0 28 57 97 150 200A5200 0.059 0.107 0.167 0.208 0.249⑵将所得6支试管混匀,10min后以对照组调零,用520nm波长比色并读取吸光度;⑶以吸光度为纵坐标,各管相应的转氨酶单位为横坐标,绘制标准曲线2.酶活性测定:⑴取2支试管,编号,按表4-17操作:表2 ALT活力测定试剂对照测定血清——0.1PBS缓冲液0.1 ——底物溶液0.5 0.5混匀,37摄氏度水浴30分钟,然后各管加入2,4——二硝基苯肼2,4—二硝基苯肼0.5 0.5混匀,37摄氏度水浴20分钟,然后各管加入0.4mol/L NaOH0.4mol/L NaOH 5.0 5.0A5200 0.122⑵用520nm波长比色,以对照管调零,读取测定管吸光度;实验结果:由标准曲线方程y=0.0014x,当A520=0.122,即y=0.122,故x=87那么测得ALT酶活力单位为87讨论:1.查资料得参考正常值为40单位以下,实验测得ALT酶活力单位为87,机体可能发生了肝病变。



保山中医专生物化学实验手册保山中医专生物化学教研室目录实验一生化实验的基本操作实验二酶的专一性实验三影响酶活性的因素实验四尿淀粉酶的测定和尿葡萄糖定性实验实验五血糖的测定实验六血清谷丙转氨酶活性的测定实验七血清尿素的测定(二乙酰一肟法)实验八血清肌酐的测定实验九血浆二氧化碳结合力的测定(滴定法)实验一生化实验的基本操作一、实验目的1.了解实验室的一般规则2.掌握刻度吸量管、微量移液器的使用二、操作:1.吸量管的操作种类:移液管或移液吸量管、刻度吸量管1.1移液管规格:1ml、5ml、10ml、20ml、25ml、50ml及100ml特点:只有一个刻度,放液时管尖残留液体不得吹出。
1.2刻度吸量管规格:0.5ml、1ml、2ml、5ml及10ml特点:吸量管刻度分到尖端者和不到尖端者两种所有刻度有自上而下或自下而上的两种实验室多为刻度到尖端者,要吹出残留在尖端的液体,供量取10ml以下的任意体积的液体之用。
2.吸量管的使用方法2.1 拿法:将中指和拇指拿住吸量管上端,食指指腹顶住吸管顶端。
2.2 取液:将吸量管插入液体内,用洗耳球吸取液体至最高刻度以上,然后迅速用食指按紧吸量管顶端,使液体不致从管内流出。
2.3 调刻度:将已充满液体的吸量管提出液面,用碎滤纸片抹干吸量管外面的液体。
然后持吸量管与地面保持垂直,放松食指控制液体缓慢地下降刚好至最上刻度(液体凹面、刻度和视线应在一水平面上),立即按紧吸量管顶端。
4.放液:吸量管靠壁,容器大约倾斜45度,放松食指,让液体缓慢地放入容器内。
3.吸量管的选用原则3.1量取整数量液体时,应选用移液管。
3.2选用与取液量最近的吸量管如欲取0.15ml液体,应选用0.5ml刻度吸量管。
实验二酶的专一性一、实验目的通过实验,验证酶的专一性,即酶对底物的选择性。
二、实验原理液淀粉酶催化淀粉水解,生成麦芽糖和少量的葡萄糖,它们均属还原性糖,可使班氏试剂中的二价铜离子(Cu2+)还原成亚铜(Cu+),生成砖红色的氧化亚铜(Cu2O)沉淀。


《生物化学》教学大纲课程名称:生物化学计划学时:32学时计划学分:2学分课程类别:专业知识模块课程性质:必修课适用专业:口腔专业开设学期:第一学期制定单位:药学系化学生化教研室执笔人:罗彩林一、课程的性质、任务生物化学是研究生物体的物质组成和结构和生物体内发生的各类化学转变的科学,是口腔医学专业的一门专业基础课程,在医学教育中起着继往开来的作用。
其任务是使学生能解释物质代谢规律与生命活动的关系和物质代谢与疾病的关系,为学习医学基础知识及终生学习奠定基础,为此后在工作实践中拟定科学的口腔医治方案提供有关依据。
二、课程教学目标(一)知识教学目标一、熟悉生物体的物质组成,生物功能和物质代谢进程及规律。
二、理解机体内物质代谢与性能活动的关系。
(二)能力培育目标一、具有大体实验操作性能。
二、初步运用生物化学大体理论观察、思考、分析和解决问题的能力。
三、教学时数分派建议表实验实训学时安排(总课时8学时)四、课程内容及要求:第一部份理论教学第一章蛋白质化学(4学时)教学目的与要求:1.掌握蛋白质的元素组成及特点,氨基酸的结构特点及连接方式。
2.掌握蛋白质各级结构及维持各级结构稳定的作使劲。
3.掌握蛋白质的两性解离和等电点、蛋白质变性。
4.熟悉蛋白质的胶体性质、沉淀、紫外吸收和呈色反映。
5.熟悉氨基酸的分类及理化性质。
6.熟悉蛋白质的结构与功能的关系。
7.了解蛋白质的分类。
教学重点与难点:蛋白质的元素组成及特点,氨基酸的结构特点及连接方式;蛋白质的各级结构及维持各级结构的化学键;蛋白质的两性电离和等电点、蛋白质变性。
*氨基酸的结构特点及分类;蛋白质的空间结构;蛋白质的两性电离和等电点、蛋白质变性。
教学内容:第一节蛋白质的分子组成蛋白质的组成元素,大体组成单位——氨基酸,肽键连接氨基酸。
第二节蛋白质的分子结构蛋白质的一、二、三、四级结构。
第三节蛋白质结构与功能的关系蛋白质一级结构与构象,蛋白质构象与功能。
第四节蛋白质的理化性质蛋白质的两性电离、高分子性质、沉淀与变性、吸收光谱及呈色反映。

实验六血清丙氨酸氨基转移酶测定一实验目的(1)了解血清酶活性测定的基本方法(2)掌握血清丙氨酸氨基转移酶(ALT)测定的临床意义二实验原理丙氨酸及α-酮戊二酸在ALT作用下,生成丙酮酸及谷氨酸,丙酮酸与2,4-二硝基苯肼作COOH COOH| |COOH C=O COOH H –C–NH2| | ALT | |HC-CH3 +CH2 C=O + CH2| | | |NH2CH2NH2CH2|| |COOH COOH丙氨酸α-酮戊二酸丙酮酸谷氨酸用,生成丙酮酸2,4-二硝基苯腙,在碱性溶液中呈红棕色。
于波长505nm 处读取吸光度值,计算酶活性。
三试剂与主要器材(1)0.1mol磷酸盐缓冲液(PH7.4):将0.1mol/L磷酸氢二钠溶液420ml,0.1mol/L磷酸二氢钾80ml,混匀,即为PH7.4、0.1mol磷酸盐缓冲液,加氯仿数滴,4℃保存。
(2)ALT基质液:称DL-丙氨酸1.79g,α-酮戊二酸29.2mg,加磷酸盐缓冲液(PH7.4)约50ml煮沸溶解后,待冷,用1mol/LnaOH调整PH7.4(约加0.5ml),缓冲液加到100ml,加氯仿数滴, 4℃保存。
该溶液可稳定2周。
(3)2,4-二硝基苯肼溶液:称取2,4-二硝基苯肼19.8mg,溶于10mol/L 盐酸10ml中,完全溶解后蒸馏水至100ml,置棕色瓶中,室温保存,若有结晶析出,应重新配置。
(4)2μmol/L丙酮酸标准溶液:精称纯丙酮酸钠22.0mg于100ml容量瓶内,加磷酸盐缓冲液(PH7.4)至刻度。
此液应新鲜配制,不能存放。
(5)0.4mol/LnaOH溶液:将16gNaOH溶液于蒸馏水中,加蒸馏水至1000ml,置塑料瓶内,可长期使用。
四实验方法(1)标准曲线的制作。
0 1 2 3 4丙酮酸标准液(ml) 0 0.05 0.10 0.15 0.20基质液(ml) 0.5 0.45 0.40 0.35 0.30磷酸盐缓冲液(ml) 0.1 0.1 0.1 0.1 0.1相当于酶活性单位(卡门单位) 0 28 57 97 150各管加入2,4–二硝基苯肼0﹒5 ml,混匀,37℃水浴20 min后加入0﹒4 mol/L NaOH 5﹒0 ml,混匀。
实验七血清丙氨酸氨基转移酶(ALT)活性测定生化实验生化实验释的丙酮酸标准液(500μg/ml)0.1ml,再按下表操作。
各管混匀,于室温静置10分钟,520nm波长,以第11管为空白管比色,读取各管光密度将各管丙酮酸含量(5-50μg)按下式换算成谷丙转氨酶活力单位: 以每100ml血清中丙氨酸氨基转移酶活力单位为横坐标,光密度为纵坐标绘制标准曲线。
2.酶活性的测定取干燥洁净试管2支,标明测定管和对照管,按下表操作。
混匀,静置10min,用分光光度计,在520nm波长,用蒸馏水调节零点,读取测定管和对照管光密度,以测定管光密度值减去对照管光密度值,然后从标准曲线上查出其酶的活力单位。
【注意事项】1.标本应空腹取血,当时进行测定或将分离的血清贮存于冰箱中。
2.酶的测定结果与酶作用时间、温度、PH及试剂加入量等有关,在操作时均应准确掌握。
3.测定试剂更换时,要重新制作标准曲线。
【临床意义】ALT广泛存在于一般组织细胞中,肝细胞中此酶含量最多。
肝炎、中毒性肝细胞坏死等肝病时,血清中此酶活性增加,其他疾病如心肌梗塞、心肌炎等亦有增高。
故血清丙氨酸氨基转移谷丙转氨酶活性得测定在临床诊断上具有重要意义。
【附注】1.酶活力的意义及测定方法研究酶促反应速度和各种因素对酶促反应速度的影响时,一般以酶的活力单位为观察指标。
酶活力是指酶催化化学反应的能力;酶活力的大小用酶活力单位表示,酶的一个国际单位为在25℃下,1分钟内催化1μmol/L底物的酶量,或是转化1微摩尔(1μmol)底物的有关基团的酶量。
测定酶活力时,常常用产物的生成量或是底物的消耗量来计算。
一般以测定产物增加量为好,因为产物从无到有,只要方法足够灵敏就可以准确测定。
2.测定血清丙氨酸氨基转移酶活性的方法简介一类是分光光度法,另一类是比色法。
前者是测定酶速率的方法,需要紫外分光光度计与酶试剂。
后者有金式(King)法,穆氏(Mohum)法与赖氏(Reitman Frankel)法3种。
一、实验目的本次实验旨在通过生化实验方法,检测人体血液中的生化指标,包括血糖、血清甘油三酯、血清丙氨酸氨基转移酶(ALT)、血清胆固醇等,以了解人体生化状况,为临床诊断提供依据。
二、实验原理1. 血糖测定:采用葡萄糖氧化酶法(GOD-POD法)测定血糖。
葡萄糖氧化酶催化葡萄糖与氧反应生成葡萄糖酸和过氧化氢,过氧化氢在过氧化物酶的作用下生成水并释放出氧气,通过测定氧气的生成量,计算出血糖浓度。
2. 血清甘油三酯测定:采用酶法测定。
甘油三酯在甘油三酯水解酶的作用下水解生成甘油和脂肪酸,脂肪酸在甘油三酯氧化酶的作用下氧化生成二氧化碳和水,同时释放出能量,通过测定能量释放量,计算出甘油三酯浓度。
3. 血清ALT活性测定:采用改良赖氏法测定。
ALT催化丙氨酸与α-酮戊二酸反应生成丙酮酸和谷氨酸,通过测定反应过程中生成的丙酮酸量,计算出ALT活性。
4. 血清胆固醇测定:采用胆固醇氧化酶法测定。
胆固醇在胆固醇氧化酶的作用下氧化生成胆甾醇-7-α-醇,然后与对苯二胺反应生成紫色化合物,通过测定紫色化合物的吸光度,计算出胆固醇浓度。
三、实验材料1. 试剂:葡萄糖氧化酶试剂盒、甘油三酯测定试剂盒、ALT测定试剂盒、胆固醇测定试剂盒、生理盐水、缓冲液等。
2. 仪器:血糖仪、酶标仪、离心机、恒温水浴箱等。
3. 样本:健康志愿者空腹静脉血。
四、实验方法1. 血糖测定:取血糖仪,按照说明书操作,将血糖试纸插入血糖仪,用采血笔采集血液,滴加在试纸上,待试纸变色后,读取血糖值。
2. 血清甘油三酯测定:取甘油三酯测定试剂盒,按照说明书操作,将血液离心分离血清,取血清加入试剂盒中的反应管中,加入试剂,混匀,放入酶标仪中,在特定波长下测定吸光度,根据标准曲线计算出甘油三酯浓度。
3. 血清ALT活性测定:取ALT测定试剂盒,按照说明书操作,将血液离心分离血清,取血清加入试剂盒中的反应管中,加入试剂,混匀,放入酶标仪中,在特定波长下测定吸光度,根据标准曲线计算出ALT活性。