强弱混合酸准确滴定的条件判定法
- 格式:ppt
- 大小:201.50 KB
- 文档页数:12


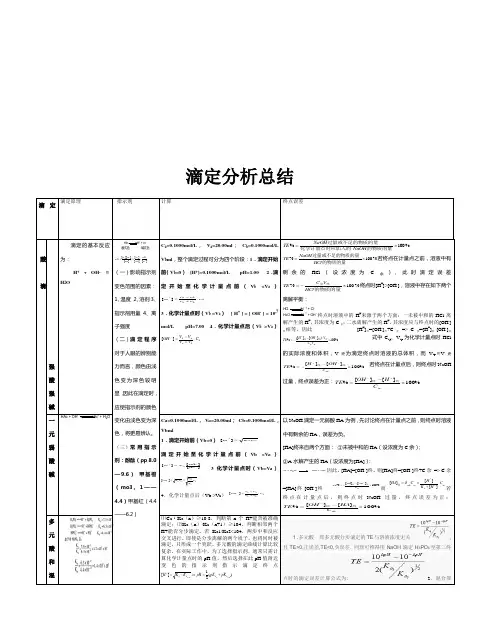
分析化学四大滴定总结一、酸碱滴定原理酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应H++ OH- = H2O滴定曲线与直接滴定的条件强碱滴定强酸强碱滴定弱酸强酸滴定弱碱cK a≥10-8cK b≥10-8多元酸的滴定混合酸的滴定多元碱的滴定c o K a1≥10-9c o K b1≥10-9K b1/K b2>104液基准物质无水碳酸钠、硼酸邻苯二甲酸氢钾、苯甲酸应用硼酸的测定、铵盐的测定、克氏定发、酸酐和醇类的测定等酸碱溶液pH计算一元弱酸两性物质二元弱酸缓冲物质理定分析方法。
基本反应M+Y=MY配合物的稳定常数酸效应αY(H)干扰离子效应αY(N)溶液酸度越大,αY(H)越大,表示酸效应引起的副反应越严重。
αY(H)=1+β1[H+] +β2[H+] ²+β3[H+] ³+β4[H+]⁴+βⁿ [H+] ⁿ[Y]越小,αY(N)越大,表示干扰离子效应引起的副反应越严重。
金属离子的配位效应αM(OH)、αM(L)及总副反应αMY的总副反应αY条件稳定常数K’MYαM越小,αY越小,K’MY越小,配合物稳定性越大滴定条件准确直接滴定的条件K’MY≥10-6分别滴定的条件K’MY≥10-6,△lgK≥5配位剂1.无机配位剂 2.有机配位剂:EDTA、CyDTA、EGTA、EDTP等指示剂铬黑T、二甲酚橙、钙指示剂、PAN等指示剂原理指示剂游离态与配合态颜色不同影响滴定突跃范围因素1.金属离子浓度的影响:K’MY一定时,CM越大,ΔpM’越大2.条件稳定常数的影响:CM一定时,K’MY越大,ΔpM’越大3.酸度的影响:pH越小,αY(H)越大,K’MY越小,ΔpM’越小4.其他辅助配位剂的影响:CL越大,αM(L)越大,K’MY越小,ΔpM’越小用掩蔽和解蔽的方法进行滴定常用掩蔽方法配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法应用测定石灰石中CaO、测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的滴定测定Cu2+、Zn2+、条件电极电位条件对电极电位的影响离子强度副反应酸度一般忽略离子强度的影响,一般用浓度代替活度酸度变化直接影响电对的电极电位条件平衡常数滴定反应条件影响反应速率的因素1.反应物浓度2.温度3.催化剂4.诱导作用滴定化学计量点前化学计量点时化学计量点后曲线与终点的测定指示剂氧化还原指示剂、自身指示剂、专属指示剂预处理预氧化、预还原,除去有机物:干法灰化。







第四章酸碱滴定法1.基本概念(1)混合指示剂:两种或两种以上指示剂相混合,或一种指示剂与另一种惰性染料相混合。
利用颜色互补原理,使终点颜色变化敏锐。
(2)滴定反应常数(K t):是滴定反应平衡常数。
强碱(酸)滴定强酸(碱):K t=1/K w=1014;强碱(酸)滴定弱酸(碱):K t=K a(b) /K w。
K t值越大,该滴定反应越完全,滴定突跃越大。
(3)滴定曲线:以滴定过程中溶液pH值的变化对滴定体积(或滴定百分数)作图而得的曲线。
(4)滴定突跃:化学计量点附近(±0.1%)pH的突变。
(5)滴定误差:滴定终点与化学计量点不一致引起的误差,与指示剂的选择有关。
(6)质子溶剂:能给出质子或接受质子的溶剂。
包括酸性溶剂、碱性溶剂和两性溶剂。
(7)无质子溶剂:分子中无转移性质子的溶剂。
包括偶极亲质子溶剂和惰性溶剂。
(8)均化效应和均化性溶剂:均化效应是指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平;具有这种作用的溶剂称为均化性溶剂。
(9)区分效应和区分性溶剂:区分效应是指不同的酸或碱在同一溶剂中显示不同的酸碱强度水平;具有这种作用的溶剂称为区分性溶剂。
2.基本原理(1)酸碱指示剂的变色原理:指示剂本身是一类有机弱酸(碱),当溶液的pH改变时,其结构发生变化,引起颜色的变化而指示滴定终点。
酸碱指示剂的变色范围:pH=pK HIn±1;理论变色点:pH=pK HIn(2)选择指示剂的原则:指示剂变色的pH范围全部或大部分落在滴定突跃范围内,均可用来指示终点。
(3)影响滴定突跃范围的因素:①酸(碱)的浓度,c a(b)越大,滴定突跃范围越大。
②强碱(酸)滴定弱酸(碱),还与K a(b)的大小有关。
K a(b)越大,滴定突跃范围越大。
(4)酸碱滴定的可行性:强碱(酸)滴定一元弱酸(碱):c a(b)K a(b)≥10-8,此酸、碱可被准确滴定。
多元酸(碱):c a1(b1)K a1(b1)≥10-8,c a2(b2)K a2(b2)≥10-8,则两级离解的H+均可被滴定。
强弱酸混合体系被分步直接准确滴定的判据岳宣峰;张悦;张延妮;漆红兰;张成孝【摘要】以一元强酸和一元弱酸组成的混合体系为对象,并以指示剂确定终点,推导能否实现混酸分步直接准确滴定的判据.研究发现:只有待滴定酸的浓度≥0.544 mol·L?1且弱酸的pKa处于5.6–8.3之间时,才有可能在滴定误差不超过0.1%的要求下实现同浓度混合液中一元强酸和弱酸的分步直接准确滴定,这两个条件会随着滴定准确度要求的变化而变化.【期刊名称】《大学化学》【年(卷),期】2018(033)008【总页数】6页(P52-57)【关键词】混合酸;分步滴定;直接准确;判据【作者】岳宣峰;张悦;张延妮;漆红兰;张成孝【作者单位】陕西师范大学化学化工学院,陕西省生命分析化学重点实验室,西安710062;陕西师范大学化学化工学院,陕西省生命分析化学重点实验室,西安710062;陕西师范大学,药用资源与天然药物化学教育部重点实验室,西安 710062;陕西师范大学化学化工学院,陕西省生命分析化学重点实验室,西安 710062;陕西师范大学化学化工学院,陕西省生命分析化学重点实验室,西安 710062【正文语种】中文【中图分类】G64;O65在滴定分析中,如何实现混合酸体系中每种酸的分步直接准确滴定是分析化学的教学难点之一[1–12],也是滴定分析理论研究的重要内容[13–16]。
教材中常以含有两种酸的混合体系为研究对象,以其组成酸的性质(如强度等)、浓度等信息为基础,从理论上分析其各个组分能被分步直接准确滴定的可能性,国内主要化学分析教材大都涉及到一个由一元强酸和一元弱酸组成的混合体系的滴定[10–12]。
为了便于直观快速地判断一个体系是否有可能实现分步直接准确滴定,不少教材中都提供了判据(比如,武汉大学主编的教材[12]中描述如下:“如用强碱滴定HA和HB的混合溶液……,若其中HA为强酸,HB为弱酸,则当HB的解离常数足够小时,一般要求< 10−4.0,两酸才可分步滴定,或在滴定HA时HB不影响”),然而,现有教材中鲜有介绍这个判据的来源,也没有给出这个判据伴随的滴定准确度及强酸浓度要求等,这种不完整的判据无疑会给学习者带来疑惑[17,18]。