上海师范大学植物生理学实验
- 格式:ppt
- 大小:341.00 KB
- 文档页数:2

植物生理学实验内容提要本书是华东师范大学植物生理教研组主编的《植物生理学实验指导》的第二版,改为张志良主编。
修订后的第二版删去一些简单的验证性内容,新增加“基本实验技术”部分。
全书包括水分生理、矿质营养、光合作用、呼吸作用、物质代谢、植物激素、生长发育、植物与环境和基本实验技术9部分,共91个实验。
内容涉及溶液培养、组织培养、吸收光谱分析、免疫测定、氧电极法、测压法、红外线CO2分析、凝胶柱层析、凝胶电泳以及酶的分离和纯化等技术,系作者们多年在教学和科研中经验的总结。
各实验以原理、仪器药品、操作步骤、实验作业、参考文献顺序叙述。
书后有缓冲溶液、酸碱指示剂、培养基成分、筛目孔径及实验室常用的物理化学参数等附表17个,插图43幅。
本书可作为高等院校和中等专业学校教材,也可供有关专业师生和科研人员参考。
第一版前言1978年12月在北京植物生理学教材审稿会议上,我组受到会兄弟院校代表的委托,着手进行植物生理学实验指导的主编工作。
许多兄弟院校给我们寄来了资料,北京大学、山东大学、南京大学、中山大学、云南大学、杭州大学、北京师大、东北师大、华南师院、北京师院、西南师院、辽宁师院、上海师院等积极承担了编写任务。
在大家的共同努力下,于1979年9月完成初稿,分寄全国各高等师范院校、综合性大学以及部分农林院校和科研单位广泛征求意见。
此后于1980年1月在教育部委托我校举办的全国高师植物生理实验技术短训班上,由38个参加单位讨论草拟了实验编写大纲。
本实验指导就是以这个编写大纲和高等师范院校植物生理学教学大纲(草案)中规定的实验内容为主要依据编写的。
同时考虑到实验教材的适应性应比较广泛,类型应比较齐全,以满足不同的教学要求;既要有基本实验,也要有一定数量要求较高的和综合性的实验。
因此,从初稿中选出有关的内容,经过修改,并补充了一些新的内容,共有实验95个,其中在目录内标有*号者,定为必做内容,标有○号者,可在同一性质的内容中任选一个,为明了起见,将安排列成附表11,供大家参考。

1⾼级植物⽣理学实验报告⾼级植物⽣理学实验报告—植物组织培养摘要:植物组织培养在植物育种,种植等⽅⾯已经有了较成熟的技术,本实验以⾼⽺茅种⼦为外植体在MS培养基中进⾏植物组织培养,并观察其⽣长情况及发芽率等指标。
通过亲⾃体验加深了对植物组织培养的认识,并能熟练的掌握其技术。
实验结果表明组织培养可以使种⼦发芽率达到90%以上。
关键词:植物组织培养;⾼⽺茅;MS培养基引⾔:植物组织培养是从20世纪30年代初期发展起来的⼀项⽣物技术[1]。
它是指在⽆菌条件下,将离体的植物器官(如根、茎尖、叶、花、未成熟的果实、种⼦等)、组织(如形成层、花药组织、胚乳、⽪层等)、细胞(如体细胞、⽣殖细胞等)、胚胎(如成熟和未成熟的胚)、原⽣质体(如脱壁后仍具有⽣活⼒的原⽣质体)培养在⼈⼯配制的培养基上,给予适宜的培养条件,诱发产⽣愈伤组织、潜伏芽等,进⽽培育成完整的植株,统称为植物组织培养。
运⽤组织培养法可以⽣产脱毒苗,对繁殖系数低、不能⽤种⼦繁殖的名、优、特植物品种进⾏快速⼤量的繁殖,单倍体育种、促进远缘杂交种的细胞融合、利⽤基因转⼊的⽅法培育出抗病⾍害等的品种,⽣产出⼤量的胚状体⽤以制作⼈⼯种⼦,⼤量⽣产植物次⽣代谢物等[2]。
⽬前,植物组织培养技术已渗透到植物⽣理学、病理学、遗传学、育种学、药学以及⽣物化学等研究领域,成为⽣物学科中的重要研究技术和⼿段之⼀,推动了相关学科的迅速发展。
特别是植物组织培养技术与分⼦⽣物学及RNA⼲扰技术紧密结合,成为细胞⽣物学和细胞遗传学研究的基础。
植物组织培养技术还被⼴泛应⽤于农业、林业、⼯业、医药业等多种⾏业,从⽽在⽣产实践⽅⾯产⽣了巨⼤的经济效益和社会效益[3]。
1 我国植物组织培养研究进展从20世纪50年代我国植物组织培养创始⼈之⼀罗世韦[4]教授在中国科学院上海植物⽣理研究所开展了组织培养的研究以来,我国组培技术研究快速发展,在近10多年来全国各地许多农业科研院和⾼校都开展了植物组织培养研究⼯作,对农作物、观赏植物、园艺作物、经济林⽊等上千种植物进⾏组织培养研究并取得了成功,同时在实践中总结出很多有益的经验,如郑⽂静[5]等较好地总结了植物组织培养中的常见问题和具体解决⽅法;吴毅明等在植物组织培养的环境微⽣态的研究中,⽤通透性好的化学纤维、纸卷、蛭⽯、沙⼦等代替琼脂作培养基,可有效地改善根际环境,促进⼩植物⽣根;刘思九[6]采⽤的暴露培养法,即在敞⼝培养器中⽤特制的粉沫状灭菌材料覆盖培养基和外殖体,使其不受污染,通过特制装置补⽔,让组培苗暴露在室内空⽓中⽣长,其长势优良,不炼苗即可移栽。



烯效唑(S-3307)对小麦幼苗生长发育旳影响摘要:本次试验是采用烯效唑旳不一样浓度浸种小麦种子,以此来研究小麦旳幼苗形态和生理指标。
在这次试验中共设0、10、30和50mg/L旳烯效唑浸种4个处理,对小麦种子旳呼吸强度、幼苗根系活力、幼苗叶绿素含量、丙二醛含量等指标进行了测定。
试验成果表明:不一样浓度烯效唑浸种对小麦幼芽呼吸强度有一定旳克制作用;烯效唑能增大根/冠比;提高根系活力;增进叶绿素含量旳增长;不过丙二醛含量减少。
烯效唑浸种能使小麦矮化壮苗、增强植物抗性。
关鍵词:小麦烯效唑生长形态指标生理指标序言:烯效唑是一种高效、低毒旳生长延缓剂, 具有活性高、低毒、低残留等特点,广泛合用于农作物、蔬菜、果树、草坪等[11-12]。
烯效唑能减缓细胞旳分裂和伸长,克制节间生长,幼苗高度明显减少,茎粗和分蘖数增长,增强根系活力,提高叶绿素含量,延缓作物衰老,增进花芽形成,根冠比增长和提高光合速率等生理效应。
种子通过浸种法处理可以充足吸取水分,利于催芽播种;可以使种子吸取一定量旳农药,既可以杀灭种子携带旳有害生物,又可以防止幼苗遭受病虫旳危害,浸种可提高秧苗根系活力和根冠比,增长叶绿素旳含量,从而保证强健苗旳形成。
近些年对S3307大量试验研究表明,S3307浸种可使小麦幼苗强健、叶片增长、叶色浓绿、根系发达和分蘖数增多,增进成穗,并有明显旳增产效果[4]1、材料与措施1.1 材料与试剂:经不一样烯效唑浓度处理旳小麦种子,90%S-3307,0.1%消毒液HgCl2 1.2 措施:1.2.1 种子旳前处理精选小麦种子,用0.1%HgCl消毒10min,用清水冲洗洁净消毒液,分别用0、10、30、250mg/ml旳多效唑溶液浸种20小时,倒掉浸泡液,将种子放在培养盘中,在250C-280C 旳恒温箱中催芽三天,待长出幼芽后,测定幼芽旳呼吸强度。
1.2.2幼苗栽植与培养(水培法)选用在不一样浓度S-3307浸泡旳发芽种子,栽植于塑料杯旳纱网上,种植2杯,每杯种植30株,并标上记号,二周后用于测定幼苗旳形态指标和生理指标。

植物生理学实验的基本过程植物生理学实验的基本过程包括:实验设计、样品采集、制备样品、分析测定、数据处理和实验报告。
值得指出的是,在植物生理学研究中体现实验设计的理念十分重要。
因为实验设计的核心是估计和降低误差。
要根据实验设计的指导确定实验方案,确定实验材料、处理条件、重复次数、小区布置、测定指标等内容。
具体方法可参考相关著作,由于篇幅限制,这里不再详述。
(一)植物材料的种类和采集1.植物材料的种类植物生理学实验中使用的材料非常广泛,可依实验目的不同而加以选择。
根据来源可划分为天然的植物材料(如植物的根、茎、叶等)和人工培养的植物材料(如杂交后代材料、突变体、愈伤组织等)两大类;按水分状况、生理状态可划分为新鲜植物材料和干材料两大类。
2.植物材料的采集实验的准确性,除取决于分析方法是否科学以及操作是否严格外,在很大程度上还取决于取样的代表性和典型性。
要根据实验目的分别采集植株的不同部位,如根、茎、叶、果实,不能将各部位样品随意混合。
其次,植物材料的采集还具有适时性,即在植物不同生长发育阶段,或各种处理前后,适时采样分析。
此外,在操作和处理过程中还要防止样品变质和污染。
样品包括原始样品、平均样品和分析样品三类。
从大田或实验地、实验器皿中采取的植物材料,称为“原始样品”,再按原始样品的种类分别选出“平均样品”,然后根据分析的目的、要求和样品种类的特征,采用适当的方法,从“平均样品”中选出供分析用的“分析样品”。
(1)原始样品的取样法随机取样:在实验区(或大田)中随机确定取样点,取样点的数目视田块的大小和样品需要量而定。
选好点后,随机采取一定数量的样株,或在每一个取样点上按规定的面积从中采取样株。
对角线取样:直接从田里采取植株样品,在生长均一的情况下,可按对角线或沿平行的直线等距离布点采样。
即在实验区按对角线选定五个取样点,然后在每个点上随机取一定数量的样株,或在每个取样点上按规定的面积从中采取样株。
(2)平均样品取样法混合取样法:一般颗粒状(如种子等)或已碾磨成粉末状的样品可以采取混合取样法进行。

第一章 植物的水分代谢 一、名词解释: 植物的水分代谢:植物对水分的吸收、运输、利用和散失的过程,被称为植物的水分代谢 水势:(ψw 或φw ):在一个系统(溶液)中,水的化学势与相同温度压力下纯水的化学势之差,再除以水的偏摩尔体积。
1bar=105Pa = 0.1MPa = 0.987atm水势的单位是压强单位,帕斯卡(Pa )、大气压(atm )、巴(bar ) 渗透作用:水分子通过半透膜扩散的现象,是扩散作用的一种特殊形式。
渗透压:渗透作用所形成的流体静压叫渗透压渗透吸收:依赖渗透作用的吸水方式为渗透吸水植物根系的主动吸水:由植物根系生理活动而引起的吸水过程称为主动吸水 质外体途径:水分通过质外体进入根内部质外体是指由细胞壁、细胞间隙、胞间层以及导管的空腔组成的体系。
根中的质外体被内皮层凯氏带分隔成两个区域:外部质外体和内部质外体。
共质体途径:土壤水分通过共质体进入根内部导管共质体是指由胞间连丝把一个个生活细胞的原生质体连成一体的体系。
水分在共质体内运输时需要跨膜,移动阻力较大。
植物根系的被动吸水:由蒸腾作用产生的水势梯度而引起根的吸水称为被动吸水 吸胀吸水:依赖于低的衬质势而引起的吸水称为吸胀吸水。
蒸腾作用:植物体内的水分以气态方式从植物体的表面向外界散失的过程称为蒸腾作用二、知识点:植物的水分代谢包括哪些内容?水分的吸收→水分的运输→水分的利用→水分的散失自由水/束缚水的生理意义?是衡量植物代谢强弱和抗性强弱的生理指标之一。
二者比值越大代谢越旺盛;反之,抗性越强。
溶液水势高低与溶液浓度的关系?纯水的水势为零,其他任何溶液的水势为负值。
溶液浓度愈大,水势值愈小。
若体系存在水势差,则发生水分子转移,水分总是从水势高处向水势低处移动,直至两处水势差为0。
植物细胞水势的组成?溶质势、重力势、衬质势和压力势(帕)Pa N/m J/m mol m mol J 23131===⋅⋅=--w ψ溶液渗透压与浓度的关系?水分移动方向与渗透压的关系?ψs =ψπ=-π=-iCRT溶液越浓=渗透压越大=水势越低。
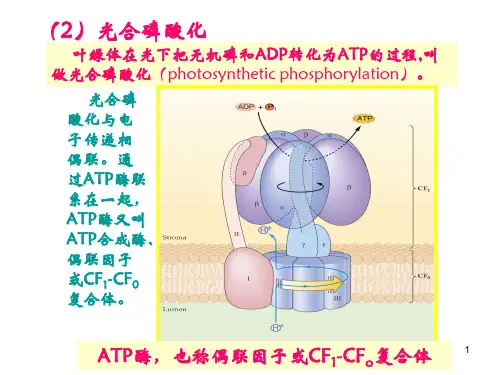

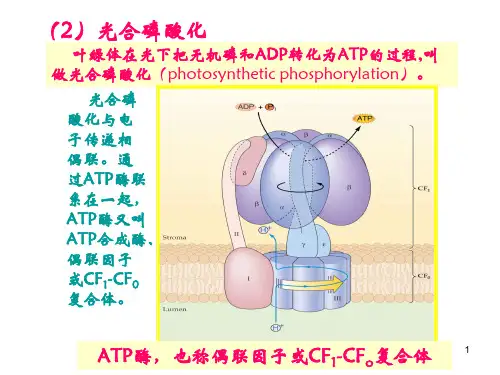
精选全文完整版可编辑修改实验1 叶绿素a 、b 含量的测定(乙醇)(分光光度法)一、目的学会Chla 、b 含量的测定方法,了解叶片中Chla 、b 的含量。
二、材料用具及仪器药品菠菜叶片、721分光光度计、天平、研钵、剪刀、容量瓶(25ml )、漏斗、滤纸、乙醇(95%)三、原理叶绿素a 、b 在波长方面的最大吸收峰位于665nm 和649nm ,同时在该波长时叶绿素a 、b 的比吸收系数K 为已知,我们即可以根据Lambert Beer 定律,列出浓度C 与光密度D 之间的关系式:D 665=83.31Ca+18.60C b ..................................(1) D 649=24.54Ca+44.24 C b . (2)(1)(2)式中的D 665、D 649为叶绿素溶液在波长665nm 和649nm 时的光密度。
为叶绿素a 、b 的浓度、单位为每升克数。
82.04、9.27为叶绿素a 、b 在、在波长665nm 时的比吸收系数。
16.75、45.6为叶绿素a 、b 在、在波长649nm 时的比吸收系数。
解方程式(1)(2),则得 :C A =13.7 D 665—5.76 D 649...........................(3) C B =25.8 D 649—7.6 D 665........................... (4) G=C A +C B =6.10 D 665+20.04 D 649 (5)此时,G 为总叶绿素浓度,C A 、C B 为叶绿素a 、b 浓度,单位为每升毫克,利用上面(3)(4)(5)式,即可以计算叶绿素a 、b 及总叶绿素的总含量。
四、方法步骤1.称取0.05克新鲜叶片,剪碎,放在研钵中,加入乙醇1ml 共研磨成匀浆,再加5ml 乙醇,过滤,最后将滤液用乙醇定容到10ml 。
2.取一光径为1cm 的比色杯,注入上述的叶绿素乙醇溶液,另加乙醇注入另一同样规格的比色杯中,作为对照,在721分光光度计下分别以665nm 和649nm 波长测出该色素液的光密度。

实验名称:植物含水量的测定实验目的:掌握测定植物组织的含水量的方法实验原理:利用水遇热蒸发为水蒸汽的原理,可用加热烘干法来测定植物组织中的含水量。
植物组织含水量的表示方法,常以鲜重或干重 % 表示,有时也以相对含水量 % (或称饱和含水量 % )表示。
后者更能表明它的生理意义。
实验材料与设备:(一)材料:植物鲜组织。
(二)仪器设备:天平(感量1/1000g);烘箱;干燥器;剪刀;搪瓷盘;塑料袋;纸袋;吸水纸等。
实验步骤:⒈鲜重测定迅速剪取植物材料,装入已知重量的容器(或塑料袋)中,带入室内,用分析天平称取鲜重(FW)。
⒉干重测定提前把烘箱打开,温度升至100~105℃。
把称过鲜重的植物材料装入纸袋中,放入烘箱内,100~105℃杀青10min,然后把烘箱的温度降到70~80℃左右,烘至恒重。
取出纸袋和材料,放入干燥器中冷却至室温,称干重(DW)。
⒊饱和鲜重测定将称过鲜重的植物材料浸入水中,数小时后取出,用吸水纸吸干表面水分,立即称重;再次将材料放入水中浸泡一段时间后,再次取出,吸干表面水分,称鲜重,直到两次称重的结果基本相等,最后的结果即为饱和鲜重(SFW)。
若事先已知达到水分饱和所用的时间,则可一次取得饱和鲜重的测量定值。
⒋取得以上数据后,按公式计算组织含水量、相对含水量。
思考题:测定饱和含水量时,植物材料在水中浸泡时间过短或过长会出现什么问题?实验名称:植物组织水势的测定(小液流法)实验目的:学会用小液流法测定植物组织的水势实验原理:将植物组织分别放在一系列浓度递增的溶液中,当找到某一浓度的溶液与植物组织之间水分保持动态平衡时,则可认为此植物组织的水势等于该溶液的水势。
因溶液的浓度是已知的,可以根据公式算出其渗透压,取其负值,为溶液的渗透势(ψπ),即代表植物的水势(ψw)。
ψw=ψπ=-P=-iCRT实验材料与设备:(一)材料:小白菜或其它作物叶片(二)仪器设备:1.带塞青霉素小瓶12个;2.带有橡皮管的注射针头;3.镊子;4.打孔器5.培养皿。
《植物生理学实验》教学大纲课程名称:植物生理学实验实验学时:32学分:1学分适应专业:本科生物科学专业一、实验的地位、目的植物生理学实验是生物科学本科专业重要的专业基础课和必修课,独立设置课程,单独考核。
通过做实验加深学生对植物生理学基础理论的理解,掌握植物生理学研究中一些基本的实验方法和实验技术,更重要的是训练同学们操作技能,锻炼学生的动手能力,培养学生的观察能力、综合能力和创新能力,增强学生分析问题和解决问题的能力,促进创造性思维的形成。
二、实验教材与指导书实验教材:《植物生理学实验》,赵世杰等编著,中国农业出版社,2015年版;教学参考书:《现代植物生理学实验指南》,中国科学院上海植物生理研究所,科学出版社,1999;《植物生理学实验指导》,张志良,瞿伟菁主编,高等教育出版社,2003三、考核方式及成绩评定1、考核方式:综合考核实验成绩,包括实验报告成绩、笔试成绩和平时成绩2、期末考试形式、时间及分值考试形式:技能测试;考试时间:100分钟。
3、成绩组成:平时成绩占50%,其中出勤考核占10%,上课表现占10%,实验报告成绩占30%;期末课程考核成绩占50%四、实验项目开设表共有10个实验,其中选8个实验必做材料2 植物组织水势的测定必做液体交换法测定植物水势,掌握测定方法的原理和操作方法。
3 植物根系活力的测定必做采用TTC法测定。
4 叶绿素的提取分离及理化性质选做练习叶绿体色素的提取方法,验证理化性质。
5 叶绿素的定量测定必做用分光光度计定量测定叶绿素a、b和类胡萝卜素含量,掌握叶绿素计的测定原理和使用方法。
6 植物组织中可溶性蛋白质含量的测定必做考马斯亮蓝染色法测定植物组织中蛋白质的含量。
7 生长素对植物的影响必做利用幼苗芽鞘的生长可被生长素特异地诱导这一特性可用以测定生长素类物质,掌握生长素物质的生物特性及其与植物生长的关系8 植物组织逆境伤害程度的测定(MDA含量)必做利用电导仪测定处理液电导度的变化,确定各种逆境对植物的伤害程度,并了解细胞膜透性与受伤害程度的关系9 植物组织中过氧化物酶活性的测定必做通过测定植物过氧化物酶活性,了解某一组织其再植物体内的带些变化,掌握愈创木酚法测定过氧化物酶。
植物生长调节物质对植物生长的影响多效唑(PP333)浸种对小麦幼苗生长发育的影响摘要:本实验在于研究多效唑对小麦种子萌发过程中呼吸速率的变化以及培养成幼苗过后,对其形态指标和生理指标的影响。
实验表明:多效唑的浓度越高,小麦幼苗的株高也逐渐受到抑制。
而小麦在萌发的过程中,多效唑抑制小麦种子的呼吸速率;随着多效唑浓度的逐渐提高。
小麦根冠比,根系活力先增加后减小,叶绿素增多,说明多效唑浸种有助于提高小麦抗倒伏和抗逆性的能力。
关键词:小麦多效唑幼苗根系生理指标正文:多效唑是80年代研制成功的三唑类植物生长调节剂【1】,是内源赤霉素合成的抑制剂。
也可提高水稻吲哚乙酸氧化酶的活性,降低稻苗内源IAA的水平。
明显减弱稻苗顶端生长优势,促进侧芽(分蘖)滋生【2】。
秧苗外观表现矮壮多蘖,叶色浓绿。
根系发达。
多效唑的农业应用价值在于它对作物生长的控制效应。
具有延缓植物生长,抑制茎杆伸长,缩短节间、促进植物分蘖、增加植物抗逆性能,提高产量等效果【3】。
本文探讨被不同浓度多效唑作用后的小麦幼苗形态指标和生理指标的测定,以此了解多效唑对小麦生长发育的影响,为以后实践中利用多效唑提供理论依据。
1.材料与方法1.1材料与试剂小麦种子(川农26) 15%多效唑1.2方法1.2.1种子消毒【4】精选饱满充实、胚完整的小麦种子若干,用0.1%的HgCl2消毒10min,用自来水和蒸馏水冲洗3次,用滤纸吸干种子上的水分。
1.2.2浸种与催芽用200mg/L的PP333母液配制成浓度为50、100、200mg/L等三种浓度PP333溶液,以蒸馏水作为对照,将已消毒的种子分别用4种溶液浸种24小时后,摆种子摆放在培养皿中,置于28℃恒温箱中催芽48h。
观察种子萌发情况并补充水。
1.2.3幼苗培养与管理将发芽后的小麦种子移栽到以琼脂为基质的培养钵上,每钵种植30株,每种浓度种三钵。
栽植方法:以镊子在琼脂面上戳一小孔,将发芽小麦种子的根全部埋入琼脂中,芽留在琼脂面上,栽好后在琼脂面上浇少量水。
植物⽣理学实验报告植物⽣理学实验报告实验⼀、植物组织⽔势测定(⼩液流法)⼀、实验原理⽔总是从⽔势⾼的系统流向⽔势低的系统。
将植物叶⽚分别与⼀系列不同浓度的蔗糖溶液接触,蔗糖溶液浓度从⼩到⼤,开始时,植物叶⽚⽔势低于蔗糖溶液,溶液中⽔分向叶⽚转移,蔗糖溶液浓缩,蔗糖溶液密度较原始浓度升⾼;蔗糖溶液⾼到⼀定浓度后,蔗糖溶液⽔势低于植物叶⽚,叶⽚⽔分向溶液中转移,蔗糖溶液稀释,密度较原始浓度降低。
如果植物组织的⽔势等于蔗糖溶液的⽔势,⽔分不发⽣净移动,外液浓度较原浓度不发⽣变化上述浸泡过植物组织、浓度发⽣改变的蔗糖溶液为⼄组。
原始浓度的蔗糖溶液为甲组。
将⼄组溶液染⾊后,取⼄组溶液⼀⼩滴(⼩液流),放⼊对应浓度的甲组溶液中,观察⼩液流因密度不同⽽下降、上升或不动的情况,记录与之相对应的甲组溶液的浓度。
⼆、材料与设备1.材料:植物叶⽚;2.仪器设备:试管、试管架、打孔器、尖头镊⼦、尖头针、移液管、⽑细滴管;3.试剂:1M蔗糖液、甲烯蓝粉。
三、实验步骤1.蔗糖溶液配制:l)取⼲燥洁净试管5⽀,贴标签标记,⽤1M蔗糖母液配制蔗糖溶液,浓度由⼩到⼤分别为0.1、0.25、0.5、0.75、1M,每个浓度均配8m1,放⼊对应标记的试管中,作为甲组(⼀定要混匀)2)另取⼲燥洁净的指形管5⽀,标明0.1、0.25、0.5、0.75、1M浓度的蔗糖溶液,分别从甲组取相应浓度蔗糖溶液1m1置于指形管,作为⼄组。
2.取样及测定1)选取⽣长⼀致的叶⽚,⽤打孔器钻取⼩圆⽚4-6⽚/管,将⼩圆⽚全部浸⼊⼄组指形管溶液中,摇动20分钟;2)⽤针尖蘸取少许甲烯蓝粉末,分别放⼊⼄组各指形管中,摇匀,可看见⼄组指形管中溶液颜⾊变蓝:3)⽤⽑细滴管吸取蓝⾊溶液,轻轻插⼊相应浓度的甲组溶液中部,⽤吸⽿球轻柔吹⽓,以帮助蓝⾊溶液从⽑细滴管中流出。
在流出的⼀瞬间观察并记录液滴的升降情况;4)若液滴下降,说明组织吸⽔使溶液变浓,⽐重变⼤;若液滴上升,说明组织失⽔使溶液变稀,⽐重变⼩;若液滴静置不动,说明此溶液的溶质势与叶圆⽚组织的⽔势相等,⽔分交换平衡,溶液⽐重不变,根据溶液的浓度可计算⽔势:若前⼀浓度溶液⼩液流下沉,⽽后⼀浓度溶液中上浮,则组织的⽔势值介于两蔗糖溶液⽔势之间,可取平均值计算。
通过水培的方式研究了根区温度胁迫对小麦抗氧化酶活性及根系与幼苗生长影响.结果表明:(1)改变根区温度对小麦根系抗氧化酶活性有明显的影响,根区温度过高或过低对小麦根系POD和SOD活性都具有激活效应,但随胁迫时间的延长,胁迫对SOD活性转为抑制效应,SOD 活性迅速下降,MDA含量明显增加.(2)高温胁迫主要是抑制小麦根系的生长,表现为根长、根重、根系活性吸收面积与总面积及根冠比均明显低于中温处理,而株高和地上重却略有上升.低温胁迫对小麦地上部的影响大于根系.(3)在根温胁迫逆境条件下,小麦根系不是被动忍受逆境胁迫,而是主动地通过调节根系活力、根系SOD及POD活性等生理代谢过程,以减缓逆境的伤害.关于“植物生理学实验”的综合性实验项目“温度胁迫对植物膜系统的伤害”安排的通知按教务处通知精神,“综合性、设计性实验项目是实验课程教学内容的一部分,其实验内容应根据培养方案和实验教学教学大纲的要求及课程特点,充分考虑学生知识、能力及开设条件等可行性而设置。
综合性、设计性实验学时应包含在本门课程教学计划规定的实验总学时内,不另加学时。
”“每门课中至少应有一个实验为综合性或设计性实验”。
特将“植物细胞膜脂过氧化作用的测定”与“电导率法测定活体植物根系的抗逆性”合并为综合性实验项目。
具体操作如下:1、两个实验合在一起完成;植物材料测定前进行高低温度处理,另设一对照。
2、学生分别填写实验室发的两个实验的“植物生理学实验报告”内容(不填可溶性糖的内容),作为平时成绩。
3、学生另按小论文的格式写一篇报告(3页左右),作为考察成绩。
4、平时成绩占80%,10个实验,每个满分8分。
考察成绩占20%。
附:小论文的格式(手写3页左右,鼓励打印,不硬性规定):标题:温度胁迫对植物(小麦幼苗)膜系统的伤害(对膜透性及膜脂过氧化作用的影响)学生姓名西南大学XX学院,专业,年级,班次,学号摘要:20-50字关键词:2-3个引言:100字左右材料与方法结果与分析(应有表或图)讨论(或小结)温度胁迫对植物(小麦幼苗)膜系统的伤害(对膜透性及膜脂过氧化作用的影响)( 西南大学植物保护学院植物保护专业07级植保*班)关键词:温度胁迫小麦幼苗膜系统伤害丙二醛摘要:以小麦幼苗作为实验材料,用电导法测定温度胁迫对小麦膜系统(膜透性及膜脂过氧化作用的影响)的伤害程度和植物抗性的强弱。
重点章节为光和作用,生长物质,生殖生理;考试大约有60%为作业题,10%为ppt上的,30%为实验设计(ppt中涉及的实验, 尤其是以上三章),另附上15年期中与期末试卷。
1 植物生理学的定义和研究内容?答:植物生理学是研究植物生命活动规律的科学。
研究的内容包括:植物的①物质与能量的转化:水分、矿质、光合和呼吸作用。
②信息传递与信号转导:信号转导、植物生长物质和光形态建成部分内容。
③生长发育与形态建成:生长、形态建成、生殖、成熟和衰老。
1 水分代谢的基本过程?答:水分代谢的基本过程分为三个阶段,即水分的吸收、运输和散失。
①植物体对水分的吸收:A)植物细胞吸水主要有两种形式:一种是渗透性吸水,一种是吸胀性吸水。
未形成液泡的细胞靠吸胀作用吸水;形成液泡以后,细胞主要靠渗透性吸水。
还有第三种吸水方式叫代谢性吸水。
B)植物根系对水分的吸收:有主动吸水与被动吸水两种方式。
主动吸水的动力是根压,被动吸水的动力是蒸腾拉力。
②水分在植物体内运输的途径:土壤水分→根毛→根的皮层→根的中柱鞘→根的导管→茎的导管→叶柄的导管→叶脉的导管→叶肉细胞→叶肉细胞间隙→气孔下腔→气孔→大气。
在这段过程中,一部分要经过活细胞即共质体进行,另一部分要经过死细胞即质外体进行。
③植物体内水分散失:植物散失水分的方式有两种:蒸腾与吐水。
蒸腾作用:水分以气态形式通过植物体表面散失到体外的过程叫做蒸腾作用。
途径有三种:皮孔蒸腾、角质层蒸腾和气孔蒸腾。
2 名词解释:1)自由水和束缚水;束缚水:靠近胶粒并被紧密吸附而不易流动的水分,叫做束缚水;自由水:距胶粒较远,能自由移动的水分叫自由水。
2)渗透作用和吸胀作用;渗透作用:渗透是扩散的特殊形式,即通过选择透性膜的扩散。
这种水分通过半透膜从高水势处向低水势处移动的现象称为渗透作用。
吸胀作用:是指亲水胶体吸水膨胀的现象。
未形成液泡的植物幼嫩细胞能够利用构成细胞壁的果胶和纤维素以及细胞中的蛋白质亲水胶体对水的吸附力吸收水分。