甲醇生产工艺优秀课件
- 格式:ppt
- 大小:1.48 MB
- 文档页数:8


甲醇合成工艺甲醇合成第一节甲醇产品介绍一、物理性质甲醇是最简单的饱和一元醇,俗称“木精”、“木醇”,其分子式为CH3OH,分子量为32.04。
常温常压下,纯甲醇是无色透明、易燃、极易挥发且略带醇香味、刺激性气味的有毒液体。
甲醇能和水以任意比互溶,但不形成共沸物,能和多数常用的有机溶剂(乙醇、乙醚、丙酮、苯等)混溶,并形成恒沸点混合物。
甲醇能和一些盐如CaCl2、MgCl2等形成结晶化合物,称为结晶醇,如CaCl2?CH3OH、MgCl2?6CH3OH,和盐的结晶水合物类似。
甲醇能溶解多种树脂,但不能与脂肪烃类化合物互溶。
甲醇水溶液的密度随甲醇浓度和温度的增加而减小;甲醇水溶液的沸点随液相中甲醇浓度的增加而降低。
甲醇蒸汽和空气混合能形成爆炸性混合物,遇明火、高热能引起爆炸。
甲醇燃烧时无烟,其燃烧时显蓝色火焰。
与氧化剂接触发生化学反应或引起燃烧。
在火场中,受热的容器有爆炸危险,其蒸汽比空气重,能在较低处扩散到相当远的地方,遇明火会引起回燃,属危险性类别;试剂甲醇常密封保存在棕色瓶中置于较冷处。
甲醇有很强的毒性,口服5~10ml可以引起严重中毒,10ml以上造成失明,30ml以上可致人死亡。
甲醇属神经和血液毒物,它可以通过消化道、呼吸道和皮肤等途径进入人体,对中枢神经系统有麻醉作用;对视神经和视网膜有特殊选择作用,引起病变;可导致代谢性酸中毒,故空气中甲醇蒸汽的最高允许浓度为操作区5mg/m3,居民区0.5 mg/m3。
甲醇在常温下无腐蚀性,但对于铅、铝例外。
表一:甲醇物性参数表序号项目单位数值1 沸点(1.013×105Pa)℃ 64.5~64.72 凝固点℃ -97~-97.83 闪点℃ 12(闭口)~16(开口)4 自燃点℃ 473(空气中)~461(氧气中) 5相对密度(d20)(g/ml) 0.7915 6蒸汽压力(20℃)Pa 11825 蒸汽压力(21.2℃) Pa 133337 临界压力 MPa 7.95, 8 临界温度℃ 240 13 爆炸上限 % 36.5 8 爆炸下限 % 6 9 最小点火能量 MJ 0.216 10 相对分子量 32.04 表二:甲醇饱和蒸汽温度与压力平衡表(1mmHg = 133.322Pa)温度℃蒸汽压mmHg 温度℃蒸汽压mmHg 温度℃ 蒸汽压mmHg-67.4 0.102 20 96.0 130 6242-60.4 0.212 30 160 140 8071-54.5 0.378 40 260.5 150 10336-48.1 0.702 50 406 160 13027-44.4 0.982 60 625 170 16292-44.0 1 64.7 760 180 20089-40 2 70 927 190 24615-30 4 80 1341 200 29787-20 8 90 1897 210 35770-10 15.5 100 2621 220 425730 29.6 110 3561 230 5041410 54.7 120 4751 240 59660表三:精甲醇的质量国家标准甲醇质量标准GB338—2004检测项目指标优等品一等品合格品色度(铂—钴号)5 10 密度(20℃)g/cm3 0.791~0.792 0.791~0.793温度范围(101325Pa)℃ 64—65.5 沸程℃≤ 0.8 1 1.5高锰酸钾试验min≥ 50 30 20水混溶性试验 1:03 1:09 水份含量%≤ 0.1 0.15 酸度(以HCOOH)%计≤ 0.0015 0.003 0.005碱度(以NH3)%计≤ 0.0002 0.0008 0.0015 羰基化合物(HCHO)%≤ 0.002 0.005 0.01蒸发残渣含量%≤ 0.001 0.003 0.005 硫酸洗涤试验/铂—钴色号50 —乙醇的质量百分数% 供需双方协商表四:精甲醇的质量美国联邦规格AA标准:美国联邦规格AA级O-M-232E相对密度0.7928 馏程(101.325KPa)℃不大于1℃,并包括64.6±0.1℃纯度% 99.85酸度% 以醋酸计,最大为0.003醛酮% <0.003 KMnO4试验min >30 水份% <0.1不挥发物<0.001乙醇% <0.001 二、甲醇的化学性质甲醇不具酸性,也不具碱性,对酚酞和石蕊均呈中性。
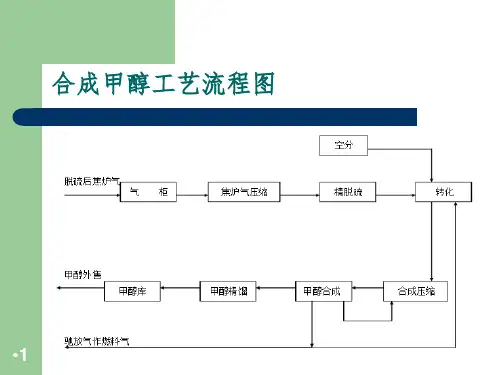



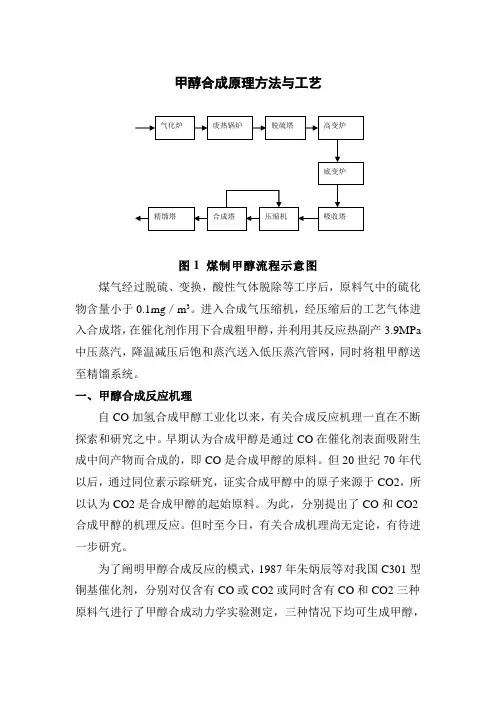
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。




煤制甲醇的工艺流程
以煤为原料生产甲醇的工艺流程,采用固定床气化方法制取水煤气作为合成甲醇的原料,可分为单醇技术和合成氨联产甲醇工艺,后者规模均较小,一般不超过10万吨/年;另一种是采用气流床气化(主要是采用水煤浆气化)方法制取水煤气作为合成甲醇的原料,单套装置规模可以达到20万吨年以上,目前正在朝大型化方向发展。
以煤为原料生产甲醇的主要工艺流程为:气化、净化、甲醇合成、甲醇精制等(参见工艺流程图)
煤制甲醇工艺流程
焦炉煤气----—三段压缩—-----三段油过滤器----焦炉气初预热器-——-铁钼脱硫——--氧化锰脱硫—--—中温锌脱硫—--—-——焦炉气预热器----—-预热炉————-转化炉--—---焦炉气预热器--—--焦炉气初预热器—-—-——锅炉给水预热器-----第一二水冷器---—--气液分离器--—-—常温锌脱硫-——--五段压缩----—-五段油过滤器———---——气气换热器--——-电加热器--——--合成塔—
空分
氧气
气化
煤 变换 变换气提尾气 净化 二氧化碳 压缩 甲醇合成 氢回收 驰放气 精馏
精甲醇常压塔排水 产品甲醇
废催化剂 净化废水
变换冷却塔废水 废催化剂
废渣 气化废水 空气
氢气
——-—-—合成废锅------气气换热器———-—水冷器———-—-甲醇分离器(气体大部分打循环,少部分放空)-----闪蒸槽-—--—--甲醇中间槽-—---预塔精馏-——-加压塔精馏-—---常压塔精馏-———-回收塔精馏----精甲醇储罐.
.
·····谢阅。
[感谢您的阅览以及下载,关注我,每天更新]。