2008 级蛋白质工程复习题
- 格式:doc
- 大小:43.50 KB
- 文档页数:3

蛋白质工程试题1.蛋白质分子的构型与构象构型:是分子中原子的特定空间排布。
当构型相互转变时,必须有共价键的断裂和重新形成。
基本构型有L-型和D型两种。
这种构型无法通过单键的旋转相互转换。
构象:是组成分子的原子或基团围绕单键旋转而成的不同空间排布,构象的转换不要求有共价键的断裂和重新形成,在化学上难以区分和分离。
2.内核假设原理所谓内核是指蛋白质在大自然的进化中形成的保守内部区域。
这样的区域一般由氢键连接而成的二级结构单元组成。
内核假设原理就是所有蛋白质的折叠形式主要决定于其内核中残基的相互作用和组织形式。
遵循这样的内核原理意味着蛋白质工程无法创造出超越天然蛋白质所具有二级结构的新蛋白质二级结构。
3. van't Hoff焓平衡常数与焓/熵的关系式为:-RT lnK = △H - T△S。
取对数可以变为: lnK = -△H/RT + △S/R。
进一步推导可以变为:d(lnK)/d(1/T)= -△H/R。
基于此,以lnK对1/T可以得到一条曲线。
在这条曲线上任何一点的斜率就是△H/R,其中的△H称为van't Hoff焓。
通过解析van't Hoff焓随温度变化的曲线特点,可以用于测定蛋白质体系构象平衡的转变,主要是两态转变模型的分析。
也就是通过这样的曲线分析,可以预测蛋白质天然构象退在折叠时的容易程度。
4. 盒式突变法也称为片断取代法(DNA fragment replacement)。
这一方法的要点是利用目标基因中具有的适当的限制性酶切位点,用具有任何长度、任何序列的DNA片断来置换或者取代目标基因上的一段DNA序列。
5、熔球态在折叠途径中第一个可以观测到的中间体是柔性无序的为折叠多肽链卷折成局部有组织的球状体,称为熔球体melton globule。
熔球体具有天然态的大多数二级结构,但不如天然结构致密,蛋白质内部的密堆积相互作用尚未形成,环肽区和表面结构多数处于未折叠状态,侧链可以活动。


蛋白质习题一:解释下列名词1、肽平面及二面角:①肽平面:肽键具有一定程度的双键性质,参与肽键的六个原子C、H、O、N、Cα1、Cα2不能自由转动,位于同一平面,此平面就是肽平面,也叫氨酰平面。
②二面角:两相邻酰胺平面之间,能以共同的Cα为定点而旋转,绕Cα-N键旋转的角度称φ角,绕C-Cα键旋转的角度称ψ角。
φ和ψ称作二面角,亦称构象角。
2、氨基酸残基:在多肽链中的氨基酸,由于其部分基团参与了肽键的形成,剩余的结构部分则称氨基酸残基。
3、β-折叠:蛋白质中常见的二级结构,是由伸展的多肽链组成的。
4、β-转角:多肽链中常见的二级结构,是连接蛋白质分子中的二级结构(α-螺旋和β-折叠),使肽链走向改变的一种非重复多肽区,一般含有2~16个氨基酸残基。
5、超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
6、结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
7、氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH 值,用符号pI表示。
8、蛋白质的变性与复性:①蛋白质的变性作用:蛋白质分子的天然构象遭到破坏导致其生物活性丧失的现象。
蛋白质在受到光照、热、有机溶剂以及一些变性剂的作用时,次级键遭到破坏导致天然构象的破坏,但其一级结构不发生改变。
②蛋白质的复性:指在一定条件下,变性的蛋白质分子恢复其原有的天然构象并恢复生物活性的现象。
9、亚基:体内许多蛋白质分子含有两条或两条以上多肽链,每一条多肽链都有完整的三级结构,称为亚基10、疏水相互作用:非极性分子之间的一种弱的非共价的相互作用。
这些非极性的分子在水相环境中具有避开水而相互聚集的倾向。
11、胶原蛋白:是动物结缔组织中最丰富的一种结构蛋白,它是由原胶原蛋白分子组成,原胶原蛋白是一种具有右手超螺旋结构的蛋白。
每个原胶原分子都是由3条特殊的左手螺旋(螺距0.95nm,每一圈含有3.3个残基)的多肽链右手旋转形成的。

蛋白质工程复习资料整理版一.名词解释:1.自由界面扩散法:它是根据蛋白质在不同溶剂中的溶解度不同,选择两种溶解性差别大的溶剂,将溶有待结晶蛋白质的溶液小心地放在另一种溶液的上层,首先在界面区域达到瞬间的过饱和,随着两层溶液互相扩散,各自形成一个浓度梯度,当扩散趋向平衡时,蛋白质的溶液达到一定的过饱和度,便形成了晶核。
2.丝素蛋白:是从蚕丝中提取的天然高分子纤维蛋白,含量约占蚕丝的70%~80%,含有18种氨基酸,其中甘氨酸(gly)、丙氨酸(ala)和丝氨酸(ser)约占总组成的80%以上3.大豆分离蛋白(SPI):是以大豆为原料经过加工制成的,大豆分离蛋白等电点4. 5~5 ,4.PAGE:聚丙烯酰胺凝胶电泳,是一种以聚丙烯酰胺凝胶为支持介质的区带电泳,它是在恒定的、非解离的缓冲系统中分离蛋白质,属于非解离电泳。
5.角蛋白:是非水溶性蛋白质,存在于皮肤、毛发、羽毛、指甲、爪和蹄中。
角蛋白中含有大量胱氨酸,二硫键的形成是非水溶性的主要原因。
6.蛋白质纤维:是指基本组成物质为蛋白质一类的纤维,按来源分有天然的和人造的和再生的两种。
7.结构域:二级结构和结构模式以特定的方式组织连接,在蛋白质分子中形成两个或多个在空间上可以明显区分的三级折叠实体,称为结构域。
8.胶原蛋白:是构成细胞外基质的主要成分之一, 广泛存在于哺乳动物体内。
其良好的生物相容性, 稳定的理化性质使其成为生物工程和生物制药中的重要载体。
9.蛋白质工程:按人们意志改变蛋白质的结构和功能或创造新的蛋白质的过程。
包括在体外改造已有的蛋白质,化学合成新的蛋白质,通过基因工程手段改造已有的或创建新的编码蛋白质的基因去合成蛋白质等。
为获得的新蛋白具备有意义的新性质或新功能,常对已知的其他蛋白质进行模式分析或采取分子进化等手段。
10.热塑性挤出:指含水量低的粉状原料在剪切场中同时受压受热,形成塑块,迫使其通过成型模具。
11.固定化酶:水溶性酶经物理或化学方法处理后,成为不溶于水的但仍具有酶活性的一种酶的衍生物。

蛋白质工程复习题一、名词解释结构域:基因突变:融合蛋白:蛋白的表达模式:蛋白质的分子设计:构型:构象:α氨基酸:原核表达:蛋白质的二级结构:蛋白质的三级结构:蛋白质分子的四级结构:蛋白质的分子设计:分子伴侣:启动子:增强子:乳糖操纵子:二、单选题1.下列不属于蛋白质结构测定的技术是()A X射线晶体衍射技术B 核磁共振波谱技术C 生物信息学预测蛋白质结构D 缺失突变技术2. 下列不属于蛋白质结晶技术的是()A 悬滴法B 坐滴法C 微量扩散小室法D 插入突变法3. 增加蛋白质分子的热稳定性的常用方法是()A 提高脯氨酸的含量B 在蛋白质分子中引入二硫键C 增加蛋白质分子的α螺旋D 增加β折叠4. 蛋白质工程的最终目的是( )A 开发新产品B 创造新理论C 制造具有新性能的新蛋白质结构D 研究蛋白质的氨基酸组成5. 抗体属于()A 基因B 蛋白质C DNAD RNA6、不属于蛋白质空间结构的基本组件的是()A α螺旋B β层C 环肽链D 结构域7、不属于强烈倾向于形成α螺旋的氨基酸()A AlaB GluC ProD Met8、蛋白质分子的完全从头设计属于()A 小改B 中改C 大改D 没改9. 蛋白质工程的基本原理是()A 中心法则B 热力学第二定律C 中心法则的逆推D 模型对比三、填空题1. 维持蛋白质一级结构的作用力是()和()。
2.目的蛋白的表达模式检测的方法有()和()3.蛋白质分子设计的目的是()和()4.常用的蛋白表达系统有()、()和()。
5. 蛋白质工程的基本原理是()6.常用的蛋白表达系统有()、()和()。
四、简答题1.简述蛋白质工程研究的基本途径。
2.欲使目的蛋白在大肠杆菌中表达,则表达载体的一般特点是什么?3、简述X射线晶体衍射技术测定蛋白质晶体结构的具体步骤。
4、简述目的蛋白原核表达的基本步骤。
5、简述蛋白质在生物体内的形成的过程.6、蛋白质分子设计的步骤是什么?7. 一个蛋白质由300个氨基酸组成,请简述用搭桥PCR的方法在该蛋白的150个氨基酸处插入GAATCT这6 个碱基的基本步骤。

名解蛋白质工程:蛋白质工程是以蛋白质的结构与功能的关系研究为基础,利用基因工程技术对现存蛋白质加以改造,组建成新型蛋白质的现代生物技术。
蛋白质超二级结构:相邻的二级结构单元组合在一起,彼此相互作用,形成规则排列的组合体,以同一结构模式出现在不同的蛋白质中,这些组合体称为超二级结构,或结构模体。
结构域:指二级结构和结构模体以特定的方式组织连接,在蛋白质分子中形成两个或多个在空间上可以明显区分的三级折叠实体。
结构域是蛋白质折叠中的一个结构层次,介于超二级结构和三级结构之间,是蛋白质三级结构的基本单位,也是蛋白质功能的基本单位。
分子伴侣:是一类相互之间有关系的蛋白分子,能识别正在合成的多肽或部分折叠的多肽并与多肽的一定部位相结合,帮助这些多肽转运、折叠或组装,但其本身并不参与最终产物的形成。
定向进化:在实验室中模仿自然进化的关键步骤-突变、重组和筛选,在较短时间内完成漫长的自然进化过程,有效地改造蛋白质,使之适于人类的需要。
这种策略只针对特定蛋白质的特定性质,因而被称为定向进化。
第二遗传密码:氨基酸顺序与蛋白质三维结构之间存在着对应关系,人们称之为第二遗传密码或折叠密码。
蛋白质的化学修饰:凡通过活性基团的引入或去除,而使蛋白质一级结构发生改变的过程统称为蛋白质的化学修饰。
基因突变的概念:基因突变是指由于DNA碱基对的置换、增添或缺失而引起的基因结构的变化。
蛋白质组学:蛋白质组学定量检测蛋白质水平上的基因表达,从而揭示生物学行为(如疾病过程和药物效应),以及基因表达调控的机制的学科。
双向电泳:是等电聚焦电泳和SDS-PAGE的组合,即先进行等电聚焦电泳(按照pI分离),然后再进行SDS-PAGE(按照分子大小),经染色得到的电泳图是个二维分布的蛋白质图。
蛋白质芯片:也叫蛋白质微阵列,是将大量蛋白质有规则地固定到某种介质载体上,利用蛋白质与蛋白质、酶与底物、蛋白质与其他小分子之间的相互作用检测分析蛋白质的一种芯片。

蛋白质的分子设计:亲和标记:透析:蛋白质工程:双向电泳亲和层析抗体库技术:蛋白质组学:抗体酶:第二遗传密码:蛋白质芯片:等电聚焦:单克隆抗体:蛋白质打靶技术噬菌体表面展示技术:蛋白质超二级结构结构域基因突变蛋白质的化学修饰激光捕获显微切割技术1.()的优点是操作简便、条件温和,不会引起酶的变性失活,载体价廉易得,可反复使用。
A 吸附法B偶联法(共价结合法)C交联法D包埋法2.不属于强烈倾向于形成α螺旋的氨基酸()A AlaB GluC ProD Met“分子病”是由于基因突变造成蛋白质分子中仅仅一个氨基酸残基的变化就引起的疾病。
下列不属于分子病的是()A 地中海镰刀状红血球贫血症B 血友病C 苯丙酮尿症D 老年性痴呆症3.可以方便地在溶液中研究分子结构并且可以使试样不经受任何破坏的蛋白质结构分析方法是()A 核磁共振B X-射线晶体衍射法C 现代光谱技术D 三维电镜重构法蛋白质和酶制品纯度鉴定通常采用的方法不包括下列哪一种()A SDS-聚丙烯酰胺凝胶电泳法B等电聚焦电泳法C超速离心沉降分析法D亲和层析法4.蛋白质微阵列( Protein micro-array) ,将大量蛋白质有规则的固定在某种介质载体上,利用蛋白质与蛋白质、酶与底物、蛋白质与其他小分子之间相互作用检测分析蛋白质的技术称为()A 蛋白质芯片技术B 蛋白质分子印迹技术C表面等离子体共振技术D酶联免疫吸附剂测定5.下列哪项不是初步鉴定蛋白质晶体的方法( )A.刮擦法B.脱水法C.偏振光法D.浓度差法6.蛋白质分子引起280nm光吸收的最主要成分是()A.肽键B.半胱氨酸的-SH基C.苯丙氨酸的苯环D.色氨酸的吲哚环7. TNBS(2,4,6-三硝基苯磺酸)是()的化学修饰常用试剂。
A 巯基B氨基C羧基D二硫键8. 蛋白质工程的基本流程正确的是( )①蛋白质分子结构设计②DNA合成③预期蛋白质功能④据氨基酸序列推出脱氧核苷酸序列A.①②③④B.④②①③C.③①④②D.③④①②9. 下列不属于蛋白质结构测定的技术是()A X射线晶体衍射技术B 核磁共振波谱技术C 生物信息学预测蛋白质结构D 缺失突变技术10. 通过增加内氢键数目可以改善蛋白质设计的哪项目标()A 热稳定性B对氧化的稳定性C对重金属的稳定性 D pH稳定性11. 蛋白质分子设计的关键是()A 建立所研究蛋白质的结构模型B 找出对所要求的性质有重要影响的位置C 预测突变体的结构D 定性或定量计算优化所得到的突变体结构是否具有所要求的性质12. 下列不属于蛋白质结晶技术的是()A 悬滴法B 坐滴法C 微量扩散小室法D 插入突变法13. 增加蛋白质分子的热稳定性的常用方法是()A 提高脯氨酸的含量B 在蛋白质分子中引入二硫键C 增加蛋白质分子的α螺旋D 增加β折叠14 蛋白质工程的基本原理是()A 中心法则B 热力学第二定律C 中心法则的逆推D 模型对比下列氨基酸中,人体不能自身合成的有:( ) A、丙氨酸 B、组氨酸 C、赖氨酸 D、酪氨酸15. 关于 alpha-螺旋错误的是:()A、螺旋中每 3.6 个氨基酸残基为一周B、为右手螺旋C、一个氢键闭合的环包含12个原子D、氨基酸侧链 R 基团分布在螺旋外侧1. 从DNA到蛋白质,按照中心法则,体外表达要分为( ) ,和( )两个步骤。

蛋白质工程复习资料一级结构:蛋白质多肽链中氨基酸残基的排列顺序。
二级结构:一段连续的肽单位借助于氢键,排列成的具有周期性结构的构象。
超二级结构:相邻的二级结构单位组合在一起,彼此相互作用,行为规则排列的组合体,以同一结构模式出现在不同的蛋白质中。
结构域:二级结构和结构模体以特定的方式组织连接,在蛋白质分子中形成两个或多个在空间上可以明显区分的三级折叠实体。
三级结构:蛋白质的多肽链在各种二级结构的基础上再进一步盘曲或折叠形成具有一定规律的三维空间结构。
四级结构:由两条或两条以上具有独立三级结构的多肽链组成的蛋白质就是寡聚蛋白质分子中多肽链间通过次级键相互组合而形成的空间结构。
蛋白质的变性:天然蛋白质分子受到某些物理因素或者化学因素的影响时,会引起蛋白质天然构象的破坏,导致生物活性的降低或完全丧失的过程。
蛋白质的复性:当变性因素除去后,变性蛋白又可以重新恢复到天然构象的现象。
第二遗传密码:氨基酸顺序与蛋白质三维结构之间存在着对应关系。
分子伴侣:一类可介导蛋白质的正确折叠与装配,但并不构成被介导的蛋白质组分的蛋白。
小改:进行蛋白质修饰或基因定位突变中改:进行蛋白质分子裁剪拼接晶体:离子,原子和分子这些微粒在三维空间中周期性重复排列形成的结构。
盐析现象:蛋白质在高浓度中性盐溶液中会沉淀析出的现象。
盐溶现象:在蛋白质水溶液中加入晒量的中性盐(如硫酸铵,硫酸钠,氯化钠)会增加蛋白质分子表面的电荷,增强蛋白质分子与水分子的作用,从而使蛋白质在水溶液中的溶解度增大的现象。
蛋白质芯片:也叫蛋白质微阵列,是将大量蛋白质有规则地固定到某种介质载体上,利用蛋白质与蛋白质,酶与底物,蛋白质与其他小分子之间的相互作用检测分析蛋白质的一种芯片。
噬菌体技术:将目的基因克隆在丝状噬菌体衣壳蛋白的基因中,是外源基因产物与衣壳蛋白融合,伸展在噬菌体表面,可用来直接检测表达产物的某些活性。
蛋白质组:基因组表达的全部蛋白质及其存在方式。

蛋白质工程与酶工程复习思考题(08基地班整理,答案仅供参考)第一部分蛋白质工程1.怎样理解蛋白质工程?以蛋白质的结构和功能为基础,通过基因修饰或基因合成而改造现存蛋白质或组建新型蛋白质的现代生物技术。
蛋白质工程正在形成以改造现有蛋白质和制造新型蛋白质为中心的第二代遗传工程。
2.肽键是什么?氨基酸之间脱水后形成的键为肽键,也为酰胺键3.一级结构与空间构象、功能之间的关系?蛋白质的一级结构(primary structure)指它的蛋白质分子中各个氨基酸残基的排列顺序。
蛋白质的一级结构决定了空间构象,空间构象决定了蛋白质的生物学功能,参与功能部位的残基或处于特定构象关键部位的残基对蛋白质的生物学功能往往起定性作用;一级结构相似的蛋白质,其折叠后的空间构象以及功能往往相似,一级结构的变化引起功能的变化。
4.天然蛋白质中主要的二级结构的类型有哪些?蛋白质的二级结构:指蛋白质多肽链本身的折叠与盘绕方式,。
类型包括:α—螺旋、β—折叠、β—转角、自由回转等。
5.常见氨基酸的结构通式,20种常见氨基酸中有无不符合此通式的氨基酸?除脯氨酸外,脯氨酸(Pro)的侧链R-基与主链N原子共价结合,形成一个环状的亚氨基酸,其他均具有如下结构通式。
R|H2N-C-C00H|H6.什么是变性、复性?变性:天然蛋白质因受到物理和化学的因素影响,使蛋白质严格的空间结构受到破坏,(但不包括肽键的裂解),从而引起蛋白质若干理化性质和生物学性质的改变,这种现象称为蛋白质变性作用。
复性:变性的蛋白质恢复其天然活性的现象称为复性7.常见的氢键发生在哪些基团间?氢键: 由同一条肽链内每个氨基酸残基的两个肽键衍生而来,即每个氨基酸残基的N-H 与前面每隔3个氨基酸残基的C=O形成的。
8.常见氨基酸的旋光性如何?除甘氨酸外,都具有旋光性。
从蛋白质水解得到的α--氨基酸均为L--型氨基酸9.分子伴侣定义及其功能?分子伴侣:是进化上十分保守的蛋白质家族,广泛存在于多种生物体内,其主要作用是与新生肽或部分折叠的蛋白质的疏水表面结合,加速其折叠或组装成天然构象的进程,并防止其相互聚集和错误折叠。

蛋白质工程试题一、蛋白质工程的主要目的是什么?A. 直接改变蛋白质的氨基酸序列B. 通过改造或合成基因来改造现有蛋白质或制造新蛋白质C. 仅研究蛋白质的高级结构D. 仅仅提高蛋白质的产量(答案:B)二、在蛋白质工程中,下列哪一项不是常用的技术手段?A. 定点突变B. 基因重组C. 随机突变D. 蛋白质直接化学合成(答案:D)三、以下哪个步骤不属于蛋白质工程的基本流程?A. 从预期的蛋白质功能出发,设计预期的蛋白质结构B. 根据预期的蛋白质结构,推测应有的氨基酸序列C. 找到相对应的脱氧核苷酸序列,进行基因合成或改造D. 直接在生物体内筛选自然变异的蛋白质(答案:D)四、蛋白质工程相较于传统的基因工程,其独特之处在于:A. 能够在实验室条件下快速合成大量蛋白质B. 可以定向改造或创造符合人类需要的蛋白质C. 主要关注于提高蛋白质的表达效率D. 仅限于对现有蛋白质进行小幅度优化(答案:B)五、在蛋白质设计中,为了增加蛋白质的稳定性,常采用的方法是:A. 增加蛋白质中的疏水性氨基酸比例B. 减少蛋白质中的二硫键数量C. 随意改变蛋白质的α螺旋结构D. 尽可能使用更多的甘氨酸以增加柔性(答案:A)六、下列哪项不是蛋白质工程在医药领域的应用?A. 设计具有新活性的酶用于药物合成B. 改造抗体以提高其特异性和亲和力C. 直接利用天然蛋白质作为药物D. 创造新型疫苗以提高免疫效果(答案:C)七、在进行蛋白质工程时,为了获得具有特定功能的蛋白质,首先需要:A. 确定目标蛋白质的三维结构B. 分析目标蛋白质的功能需求C. 合成目标蛋白质的基因序列D. 在细胞中表达并纯化目标蛋白质(答案:B)八、关于蛋白质工程的未来发展,下列哪项描述最不准确?A. 将更多地依赖于计算机模拟和人工智能进行蛋白质设计B. 能够更精确地控制蛋白质的功能和特性C. 将完全取代传统的生物化学和分子生物学方法D. 在疾病治疗、材料科学和环境保护等领域展现更广泛应用(答案:C)。

第二章蛋白质结构基础1·名词解释蛋白质分子的构象:蛋白质分子中所有原子在三维空间中的排布2·填空氨基酸结构中有一个不对称的α碳原子,这就表示它有不同构型的两种立体结构L型和D 型。
3·判断β发夹结构属于二级结构(X)4·简答什么是基因表达的中心法则答:DNA转录成RNA,再翻译成蛋白质序列5·论述蛋白质的结构层次是如何界定的?答:1.蛋白质所含有的由遗传密码决定的标准氨基酸共有20种天然蛋白质大多是L型的,D型非常少(正确)2.简述氨基酸的基本组成氨基酸是由一个氨基、一个羧基、一个氢原子和一个称为侧链的R基团组成的。
组成蛋白质的氨基酸是一类特殊的氨基酸,氨基和羧基都在碳原子上,不同的氨基酸有不同的R基团3.名词蛋白质的二级结构,是指多肽链在氢键的作用下,沿一维方向排列成为具有周期性的结构的构象,它是肽链中局部肽段的构象,是完整肽链构象的结构单元,是蛋白质复杂构象的基础。
4.简述蛋白质都有哪些二级结构二级结构的类型有α螺旋、β折叠、回折和无规则卷曲。
一填空生命遗传中的中心法则是从DNA到RNA,再到蛋白质。
二名词解释卷曲:在蛋白质构象中,有一些有序但不重复的构象,它与仪螺旋、β折叠和转角等规则而重复的构象不同,仍是氢键,这种构象称之为卷曲。
三简答简述蛋白质的二级结构类型(二级结构的类型有α螺旋、β折叠、回折和无规则卷曲。
)四判断蛋白质的二级结构并不是一成不变的,一些因素可以引起蛋白质二级结构的改变。
(正确)五论述试论述蛋白质初级结构与高级结构的关系(答案略)1;名词解释pI定义:在某一pH值溶液中,Pr酸性基团和碱性基团的解离程度相当Pr分子所带正负电荷相等,净电荷为零此时溶液的pH值称为Pr的pI。
2;蛋白分子在溶液中形成稳定胶体的原因:表面形成水化层,表面同种电荷的斥力。
3;判断题:变性Pr不一定凝固凝固的Pr不一定变性。
(错误)准确答案:变性Pr不一定凝固凝固的Pr一定变性4;蛋白质分子引起280nm光吸收的最主要成分是{D}A.肽键B.半胱氨酸的-SH基C.苯丙氨酸的苯环D.色氨酸的吲哚环E.组氨酸的咪唑环5;H+、CO2和BPG对血红蛋白结合氧的影响1》.H+、和CO2促进氧的释放(Bohr效应)2》.BPG降低Hb 对氧的亲和力第三章蛋白质的功能特性与改性加工一、名词解释1.吸湿平衡法2.乳化能力3.起泡能力4.蛋白质凝胶化5.化学改性二、填空题1.影响蛋白质溶解性的主要因素是-------和----------。

蛋白质工程复习题名词解释结构域:生物大分子中具有特异结构和独立功能的区域,特别指蛋白质中这样的区域基因突变:基因组DNA分子发生的突然的、可遗传的变异现象融合蛋白:将两个或多个开放阅读框按一定序列顺序连接,融合阅读框表达出一杂合蛋白。
蛋白的表达模式:蛋白质的分子设计:构型:是一个分子中原子的特定空间排布。
构型改变必须有共价键的断裂和重新形成.最基本的分子构型为L-型和 D—型,这种异构体在化学上可以分离。
构象:组成分子的原子或基团绕单键旋转而形成的不同空间排布。
构象改变,无共价键的断裂和重新形成,化学上难于区分和分离α—氨基酸:原核表达:是指通过基因克隆技术,将外源目的基因,通过构建表达载体并导入表达菌株的方法,使其在特定原核生物或细胞内表达蛋白质的二级结构:在一段连续的肽单位中具有同一相对取向,可以用相同的构象角来表征,构成一种特征的多肽链线性组合。
结构域:二级结构和结构模体以特定的方式组合连接,在蛋白质分子中形成2个或多个在空间上可以明显区分的三级折叠实体,称为结构域。
蛋白质的三级结构:结构域在三维空间中以专一的方式组合排布,或者二级结构、结构模体及其与之相关联的各种环肽链在空间中的进一步协同盘曲、折叠,形成包括主链、侧链在内的专一排布。
蛋白质分子的四级结构:指蛋白质分子的亚基结构(subunit),亚基的数目、类型、空间排布方式和亚基间相互作用的性质,构成四级结构的基本内容。
亚基:许多蛋白质作为完整的活性分子,是由两条以上的多肽链组成,它们各自以独特的一级、二级、三级结构相互以非共价作用联结,共同构成完整的蛋白质分子,这些肽链单位称为亚基。
其聚合整体称为寡聚体蛋白质的分子设计:从蛋白质分子水平上通过数据库等大量实验数据,结合现代的理论方法通过计算机设计新的分子。
分子伴侣:一类在序列上没有相关性但有共同功能的蛋白质,它们在细胞内帮助其他含多肽的结构完成正确的组装,而且在组装完毕后与之分离,不构成这些蛋白质结构执行功能时的组份启动子:由核苷酸组成,本身并不控制基因活动而是通过与转录因子的这种蛋白质结合而控制基因活动的增强子:能强化转录起始的一段DNA序列为增强子或强化子乳糖操纵子:是参与乳糖分解的一个基因群,由乳糖系统的阻遏物和操纵序列组成,使得一组与乳糖代谢相关的基因受到同步的调控。

2008级《蛋白质与酶》期末考试试题一、名词解释(3’*10=30’)1)Cyclin-dependent Kinase (CDK)2)细胞周期检验点(Cell cycle check point)3)Apoptosome(凋亡体)4)Cancer(恶性肿瘤)5)转移(metastasis)6)成熟促进因子(Maturation Promoting Factor, MPF)7)酶的定向进化8)晶体9)蛋白质组学10)肽质量指纹谱(PMF)二、判断(1’*15=15’)1)自然界存在的绝大部分蛋白质具有其独特构象及化学性质2)具有类似功能的不同蛋白经常具有相似的氨基酸序列3)用cyclin D的抗体处理细胞,则细胞周期被阻断在S期4)当DNA损伤时,一下Rb蛋白作为转录因子,能引起P21的表达(P21抑制G1-S期CDK的活性,使细胞周期阻断)5)细胞凋亡信号能引起线粒体细胞色素C和Smac释放,Smac作为调往诱导因子能与Apaf-1和caspase-9前体、ATP/dATP形成凋亡体6)Caspase是引起apotosis的关键蛋白酶,一旦被信号通路激活,能将细胞内的蛋白降解,使细胞不可逆的走向死亡7)基因微阵列(microarray)能预测细胞中相应蛋白的水平8)氧化还原酶由酶蛋白和辅因子组成9)酶只能在单一水溶液中发生催化反应10)肽质量指纹谱可以测定肽序列11)siRNA能够诱导具有序列同源性的靶mRNA翻译12)生物的基因组只表达部分基因,表达的基因类型及其表达程度随生物生存环境及内在状态的变化而表现出极大的差别13)XRD蛋白结构解析经过两次傅里叶变换14)XRD数据的收集过程中丢失了相位信息15)NMR适合测量分子量大于100kD的大分子复合物的结构三、简答(5’*5=25’)1)寻找和发现新酶的总体思路是什么?2)生物质谱及其在蛋白质检测中的应用3)简述Pb Pathway4)Bcl-2家族蛋白质的结构与功能5)研究蛋白质相互作用的主要方法四、论述(10’*3=30’)1)论述p53在细胞抗癌变过程中的重要作用2)如何从细胞中发现分离鉴定一种一直蛋白相互作用的蛋白?3)研究发现X-IAP蛋白质在80%肝癌细胞中过表达,论述X-IAP蛋白在肝细胞癌变过程中可能的机制和治疗此类癌症的抗癌药物的研发思路。
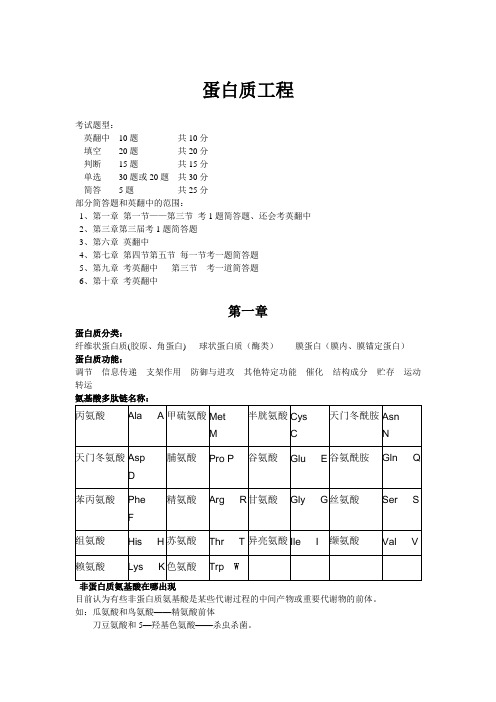
蛋白质工程考试题型:英翻中10题共10分填空20题共20分判断15题共15分单选30题或20题共30分简答5题共25分部分简答题和英翻中的范围:1、第一章第一节——第三节考1题简答题、还会考英翻中2、第三章第三届考1题简答题3、第六章英翻中4、第七章第四节第五节每一节考一题简答题5、第九章考英翻中第三节考一道简答题6、第十章考英翻中第一章蛋白质分类:纤维状蛋白质(胶原、角蛋白) 球状蛋白质(酶类)膜蛋白(膜内、膜锚定蛋白)蛋白质功能:调节信息传递支架作用防御与进攻其他特定功能催化结构成分贮存运动转运氨基酸多肽链名称:丙氨酸Ala A 甲硫氨酸MetM 半胱氨酸CysC天门冬酰胺AsnN天门冬氨酸 Asp D 脯氨酸Pro P 谷氨酸Glu E 谷氨酰胺Gln Q 苯丙氨酸PheF精氨酸Arg R 甘氨酸Gly G 丝氨酸Ser S 组氨酸His H 苏氨酸Thr T 异亮氨酸Ile I 缬氨酸Val V 赖氨酸Lys K 色氨酸Trp W非蛋白质氨基酸在哪出现目前认为有些非蛋白质氨基酸是某些代谢过程的中间产物或重要代谢物的前体。
如:瓜氨酸和鸟氨酸——精氨酸前体刀豆氨酸和5—羟基色氨酸——杀虫杀菌。
多巴胺——神经递质构象与构型的区别:构型:一个分子中各原子的特定空间排布。
当一种构型改变为另一种构型时必须有共价键的断裂和重新形成,最基本的分子构型是L-型和D-型。
构象(conformation)是组成分子的原子或基团绕单键旋转而形成的不同空间排布。
一种构象转变为另一种构象,不会有共价键的断裂与形成。
氨基酸的分类a.按照R基的化学结构进行分类:脂肪族(①中性氨基酸、②含羟基或硫氨基酸、③酸性氨基酸及其酰胺、④碱性氨基酸)、芳香族和杂环族氨基酸3类;b.按照R基的极性性质进行分类:疏水氨基酸(非极性R基氨基酸);不带电的极性R基氨基酸;带正电的R基氨基酸;带负电的R基氨基酸。
c.非天然蛋白质氨基酸肽:肽是氨基酸的线性聚合物,也称为肽链(peptide chain)肽键:氨基酸同时含有氨基和羧基,他们能以首尾相连的方式进行缩合反应,一个氨基酸的α-NH2与另一个氨基酸的α-COOH缩合脱去一份子水,可以形成一个共价酰胺键或称肽键。

复习题(蛋白质化学部分)一、名词解释1、氨基酸残基:组成多肽链的氨基酸单位已不是完整的氨基酸分子,因此每一个-NH-CH-CO- 单位称为氨基酸残基。
-NH-CH-CO-│R2、超二级结构:在蛋白质尤其是球蛋白中,存在着若干相邻的二级结构单位(α-螺旋、β-折叠、β-转角等)组合在一起,彼此相互作用,形成有规则的、在空间能辨认的二级结构组合体,充当三级结构的构件,称为超二级结构。
3、纤维状蛋白:纤维状蛋白分子结构比较有规律,分子极不对称,呈极细的纤维状,溶解性能差,在生物体内具保护、支持、结缔的功能,如毛发中的角蛋白,血纤维蛋白等。
4、盐析作用:向蛋白质溶液中加入大量中性盐,可以破坏蛋白质胶体周围的水膜,同时又中和了蛋白质分子的电荷,因此使蛋白质产生沉淀,这种加盐使蛋白质沉淀析出的现象,称盐析作用。
5、球状蛋白:球状蛋白的空间结构远比纤维状蛋白复杂,分子呈球形或椭圆形,溶解性能好,如血红蛋白、清蛋白、激素蛋白等。
6、疏水相互作用:蛋白质分子某些疏水基团有自然避开水相的趋势而自相黏附,使蛋白质折叠趋於形成球状蛋白质结构时,总是倾向将非极性基团埋在分子内部,这一现象称为疏水相互作用。
7、简单蛋白与结合蛋白简单蛋白:完全由氨基酸组成的蛋白质称为简单蛋白。
结合蛋白:除了蛋白质部分外,还有非蛋白成分,这种蛋白叫结合蛋白。
8、别构现象:当有些蛋白质表现其生理功能时,其构象发生变化,从而改变了整个分子性质的现象。
9、分子病:指某种蛋白质分子一级结构的氨基酸排列顺序与正常的有所不同的遗传病。
10、多肽链:多个氨基酸以肽键相互连接形成多肽,多肽为链状结构,故称为多肽链。
11、桑格(Sanger)反应:即2,4二硝基氟苯与α—氨基酸中氨基反应生成DNP-氨基酸,是黄色二硝基苯衍生物。
用此反应可以N-端氨基酸的种类。
是生化学家Sanger创用,故称桑格反应。
12、氨基酸等电点:当调节氨基酸溶液的pH值,使氨基酸分子上的-NH2和-COOH的解离度完全相等,即氨基酸所带净电荷为零,在电场中既不向正极移动,也不向负极移动,此时氨基酸所处溶液的pH值称为该氨基酸的等电点。

第3章:蛋白质化学复习题一、是非题:1.所有a氨基酸中的a碳原子都是一个不对称的碳原子。
( )2. 蛋白质的四级结构可以定义为一些特定的三级结构的肽链通过共价键形成的大分子体系的组合。
( )3. 根据凝胶过滤层析的原理,分子量愈小的物质,因为愈容易通过,所以最先被洗脱出来。
()4. 两个或几个二级结构单元被连接多肽连接在一起,组成有特殊的几何排列的局部空间结构,这样的结构称为超二级结构,有称为模体(MOTIF)。
( )5..蛋白质是两性电解质,当溶液的pH在其等电点以上时,蛋白质带负电荷,而pH在其等电点以下时,带正电荷()6.、所有氨基酸都各自有其对应的遗传密码子。
()7. 二硫键和蛋白质的三级结构密切有关,因此没有二硫键的蛋白质就只有一级和二级结构()8.蛋白质是两性电解质,当溶液的pH在其等电点以上时,蛋白质带负电荷,而pH在其等电点以下时,带正电荷()二、填空题:1. 胰岛素最初合成的单链多肽称为__________________是胰岛素的前体,水解切除C肽链后称为_________2.在各种蛋白质分子中,含量比较接近的元素是测得某蛋白质样品含氮量为15.2克,该样品蛋白质的含量应为克。
3.蛋白质的二级结构是蛋白质分子中某一段肽链的构象。
多肽链的折叠、盘曲是以为基础,常见的二级结构形式包括、、和。
4.构成蛋白质的氨基酸有种,除外都有旋光性。
其中碱性氨基酸有、、。
酸性氨基酸有、。
5.电泳法分离蛋白质主要根据在某一PH值条件下,蛋白质所带的净电荷而达到分离的目的。
6.蛋白质在PI时,以离子的形式存在,在P H﹥PI的溶液中,以离子形式存在,在PH﹤PI 的溶液中,以离子形式存在。
7.维持蛋白质胶体稳定的两个因素包括和,在蛋白质溶液中加入高浓度的中性盐使蛋白质沉淀的方法称为,该方法一般不引起蛋白质的。
8.由于蛋白质分子中的酪氨酸、色氨酸、苯丙氨酸含有所以在波长处有特征性吸收高峰,该特点称为蛋白质的性质。

蛋白质工程期末复习题一、名词解释(每题4分,共20分)1、蛋白质的分子设计:从分子、电子水平上,通过数据库等大量实验数据,结合现代量子化学方法,通过计算机图形学技术等设计新的蛋白质分子。
2、蛋白质的化学修饰:通过各种方法使蛋白质分子的结构发生某些改变,从而改变蛋白质的某些特性和功能的技术过程称为蛋白质的化学修饰。
3、亲和标记:试剂对蛋白质分子中被修饰部位的专一性修饰,为亲和标记或专一性的不可逆抑制作用。
4、折叠病:蛋白质分子的氨基酸序列没有改变,只是其结构或者说构象有所改变引起的疾病。
如老年性痴呆症、帕金森氏症以及某些肿瘤。
5、透析:利用蛋白质等大分子不能通过半透膜的性质,使蛋白质和其它小分子物质如无机盐单糖等分开。
二、单项选择题(每题2分,共30分)1、不属于蛋白质空间结构的基本组件的是(D)A α螺旋B β层C 环肽链D 结构域2、分子遗传学发展了以(B)为中心的基因操作技术,为通过基因修饰改造蛋白质提供了工具。
A PCR技术B 定点诱变C 分子克隆D 盒式突变3、下列不属于蛋白质结构测定的技术是(D)A X射线晶体衍射技术B 核磁共振波谱技术C 生物信息学预测蛋白质结构D缺失突变技术4、蛋白编码基因的定向诱变属于第(B )代基因工程A 一B二C三D四5、通过增加内氢键数目可以改善蛋白质设计的哪项目标(A )A 热稳定性B对氧化的稳定性C对重金属的稳定性 D pH稳定性6、蛋白质分子设计的关键是(B)A 建立所研究蛋白质的结构模型B 找出对所要求的性质有重要影响的位置C 预测突变体的结构D 定性或定量计算优化所得到的突变体结构是否具有所要求的性质7、蛋白质工程的最终目的是( C )A 开发新产品B 创造新理论C 制造具有新性能的新蛋白质结构D 研究蛋白质的氨基酸组成8、蛋白质分子的完全从头设计属于(C)A 小改B 中改C 大改D 没改9、TNBS(2,4,6-三硝基苯磺酸)是(B )的化学修饰常用试剂。

分子报告:报告分子是一类易于检测的蛋白质,将其与目的基因融合,通过它的表达产物来标定目的基因的表达调控,分子报告即是这样的一种标定检测技术。
该技术具有高灵敏度、检测方便且适合大规模检测的优点。
具有以下特点:1、报告分子应不存在于宿主中或易于和内源性基因相区别;2、应该有一个简单、快速、灵敏及经济的分析方法来检测报告分子;3、报告分子的分析结果应该具有很宽的线性范围,以便于分析启动子活性的幅度变化;4、报告基因的表达必须不改变受体细胞或生物的生理活动。
核酶:核酶(ribosome)指的是具有催化活性的RNA, 即化学本质是核糖核酸(RNA), 却具有酶的催化功能。
核酶的作用底物可以是不同的分子, 有些作用底物就是同一RNA分子中的某些部位。
核酶的功能很多,有的能够切割RNA, 有的能够切割DNA, 有些还具有RNA 连接酶、磷酸酶等活性。
与蛋白质酶相比,核酶的催化效率较低,是一种较为原始的催化酶。
此外,一些单链DNA同样具有生物酶活性,目前只能人工合成。
RNA核酶主要有以下几种:Ⅰ型内含子、Ⅱ型内含子、RNaseP的RNA亚基、发夹状核酶、锤头状核酶、肝炎δ病毒核酶、VS核酶。
3、什么是固定化酶,固定化酶的特点?1固定化酶的定义固定化酶是指固定在一定载体上并在一定的空间范围内进行催化反应的酶。
固定化酶既保持了酶的催化特性,又克服了游离酶的不足之处,具有增加稳定性,可反复或连续使用以及易于和反应产物分开等显著优点。
2 固定化酶的特点(1)稳定性:固定化酶的稳定性一般比游离酶的稳定性好。
(2)最适温度: 固定化酶的最适作用温度一般与游离酶差不多,活化能也变化不大。
(3)最适pH值: 酶经过固定化后,其作用的最适pH值往往会发生一些变化。
影响固定化酶最适pH值的因素主要有两个,一个是载体的带电性质,另一个是酶催化反应产物的性质。
(4)底物特异性: 固定化酶的底物特异性与游离酶比较可能有些不同,其变化与底物分子量的大小有一定关系。

蛋白质与酶工程试题---生工2班1.名词解释(每题3分,共30分)1.蛋白质工程:以蛋白质分子的结构规律及其与生物功能的关系为基础,通过有控制的修饰和合成,对现有蛋白质加以定向改造,设计、构建并最终生产出性能比自然界存在的蛋白质更加优良、更加符合人类社会需要的新型蛋白质。
2.Enzyme Engineering(酶工程):工业上有目的地设计一定的反应器和反应条件,利用酶的催化功能,在常温常压下催化化学反应,生产人类需要的产品或服务于其它目的地一门应用技术。
3.固定化酶:固定化酶(immobilized enzyme),是用物理或化学方法处理水溶性的酶使之变成不溶于水或固定于固相载体的但仍具有酶活性的酶衍生物。
4.分子伴娘:是一类相互之间有关系的蛋白,它们的功能是帮助其他含多肽结构的物质在体内进行正确的非共价的组装,并且不是组装完成的结构在发挥其正常的生物功能是的组成部分。
5.凝胶过滤:又叫分子排阻层析,分子筛层析,在层析柱中填充分子筛,加入待纯化样品再用适当缓冲液淋洗,样品中的分子经过一定距离的层析柱后,按分子大小先后顺序流出的,彼此分开的层析方法。
6.离子交换层析:利用离子交换剂作为载体这些载体在一定条件下带有一定的电荷,当带相反电荷的分子通过时,由于静电引力就会被载体吸附,这种分离方法叫离子交换层析。
7.酶的分子修饰:通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的技术过程称为酶分子修饰。
即:在体外将酶分子通过人工的方法与一些化学基团(物质),特别是具有生物相容性的物质,进行共价连接,从而改变酶的结构和性质。
8.半抗原:具有抗原性,但只有与载体结合才能引起机体产生免疫反应的抗原物质。
9.易错PCR(error-prone PCR):通过改变PCR反应条件,使扩增的基因出现少量碱基错配,从而导致目的基因的随机突变。
10.酶反应器:是利用生物化学原理使酶完成催化作用的装置,他为酶促反应提供合适的场所和最佳的反应条件,使底物最大限度的转化为物。
第一章蛋白质结构基础复习题
1、蛋白质工程、构型与构象、交错构象、Ramachandra构象图、多肽链的构象角、氨基酸残基、肽单位、螺旋偶极子、两亲性螺旋、π螺旋、疏水内核、结构模体、基因、蛋白质折叠、分子伴侣
2、蛋白质工程的主要步骤包括哪些?
3、蛋白质工程的基本目标、基本途径及中心问题是什么?
4、二十种常见氨基酸按侧链性质可分为极性氨基酸和疏水氨基酸,其中疏水氨基酸包括A1a、Val、Leu 、Ile、Met 、Pro、Phe . Gly(极性or非极性);极性氨基酸又可分为极性不带电荷Ser、Thr、Asn、Gln、Cys、Tyr 、Trp(有时归于非极性氨基酸)和His,极性带正电荷Arg、Lys,极性带负电荷Asp、G1u。
5、芳香族氨基酸包括Tyr、Trp、Phe,具有哪两种特性。
光谱特性和紫外线吸收特性
6、强烈倾向于形成α螺旋的氨基酸残基包括Ala、Glu、Leu和Met;非常不利于α螺旋形成的残基有Pro、Gly 、Tyr和Ser。
7、平行β层和反平行β层的区别。
8、简述环肽链及环肽链结构库的意义。
10、结构域的定义及其特征。
13、写出下列字母或词组的中文含义:
PDB-----蛋白质结构数据库protein data bank,PDB
coiled-coil αhelix------线绕式α螺旋
domain------结构域
loop----环肽链
codon----密码子
14、蛋白质在体内形成的两个阶段以及蛋白质工程设计和制造新蛋白质的基础性困难是什么?
15、蛋白质工程中增加蛋白质稳定性的基本途径有哪些?
第二章蛋白质分子设计复习题
1、内核假设、二元模式
2、简述蛋白质设计的目的及存在问题。
3、一般来说蛋白质设计循环包含哪几个步骤。
5、为什么说蛋白质工程是一个具有反向生物学性质的新课题。
6、何谓全新蛋白质设计。
9、在自然界惟一用于肽链交叉连接的方法是?
10、蛋白质功能设计的途径有哪些?
第三章蛋白质的修饰和表达复习题
1、蛋白质修饰的化学途径包括哪两种?
2、、重叠延伸、盒式突变法、质粒不相容性
4、写出下列词的中文含义:DTT、PCR、Tet 、Amp、E.coli、
5、利用基因融合技术表达外源基因的缘由有哪些?
6、为什么说大肠杆菌表达体系是外源基因表达的首选体系?
7、一个典型的大肠杆菌表达载体应包括哪些成分?
8、作为外源基因表达载体的启动子应具备什么标准?
9、寡核苷酸介导的基因突变中用于突变的引物应具备哪些特征?
第四章突变蛋白质的物理化学性质分析复习题
1、热力学函数、熔球态、过渡态、中间态、
2、简述蛋白质量热实验的原理。
3、蛋白质折叠动理的研究技术包括?
4、蛋白质折叠中间态包括哪些可能的形式?
5、多肽链间的非共价相互作用包括哪些类型?
第七章蛋白质的分离纯化与鉴定
1-10
第九章蛋白质组学2、5、6。