高一化学物质变化中的能量变化
- 格式:ppt
- 大小:380.47 KB
- 文档页数:29

物质的变化与能量的关系物质的变化与能量之间存在着密不可分的联系。
根据能量守恒定律,能量在物质变化中既不能被创建,也不能被破坏,只能从一种形式转化为另一种形式。
本文将从不同角度探讨物质的变化如何与能量密切相关。
第一节:物质的变化中的能量变化物质的变化通常伴随着能量的变化,这是因为变化过程中的化学键的形成和断裂涉及到能量的转移和转化。
例如,在化学反应中,反应物和产物之间的化学键会发生断裂和重新组合,从而释放或吸收能量。
这种能量的变化可以通过热量变化、压力变化以及其它物理性质的变化来观察和测量。
第二节:燃烧反应与能量释放燃烧反应是物质变化中最为常见的例子之一,也是能量转化最为明显的过程之一。
在燃烧过程中,燃料与氧气发生化学反应,生成二氧化碳和水,并释放出大量的热量和光能。
这是因为燃料和氧气之间的化学键被断裂并重新组合,形成了更稳定的化学键。
在这个过程中,化学能转化为热能和光能,同时伴随着能量的传递和转化。
第三节:相变与能量转化物质的相变也与能量的变化密切相关。
在固态、液态和气态之间的相互转变过程中,物质所含的能量也会发生相应的转化。
例如,当物质从固态变为液态时,吸收的能量被用于克服分子间的相互作用力,使得固体变为流动的液体。
反之,当物质从液态变为固态时,原来吸收的能量将会释放出来。
这种相变时的能量转化也是物质变化过程中的一个重要方面。
第四节:化学能与能量转化化学能是一种物质所具有的储存能量的形式。
当物质发生化学反应时,这种化学能可以转化为其他形式的能量。
例如,在电池中,化学反应使得化学能转化为电能。
同样地,在细胞呼吸过程中,有机物发生氧化反应,将化学能转化为细胞所需的能量。
化学能的转化在生物化学和工业化学等领域扮演着重要的角色。
总结:物质的变化与能量的关系非常紧密,变化过程中的能量转化和转移使得物质发生了相应的变化。
燃烧反应、相变过程以及化学能的转化都是物质变化与能量关系的重要示例。
通过研究物质变化与能量转化的关系,我们可以更深入地理解自然界中事物的运行规律,也能够应用到科学研究和工程应用中。

化学反应中的能量变化化学反应是指物质之间发生化学变化的过程,而能量变化则是指在化学反应中所涉及的能量的转化与转移。
化学反应中的能量变化包括放热反应和吸热反应两种类型,其能量的变化情况有着重要的物理和化学意义。
一、放热反应放热反应是指在化学反应过程中,反应物所含的化学能转化为热能释放出来的情况。
这种反应通常伴随着温度升高,产热现象明显。
放热反应是自发进行的,也就是说反应物的自由能降低,反应的焓变为负值。
放热反应的例子有燃烧反应,如燃烧氢气生成水的反应:2H2(g) + O2(g) → 2H2O(l) + 热能释放此反应是一个放热反应,它释放出的能量以热的形式迅速传递给周围,导致火焰和热量产生。
二、吸热反应吸热反应是指在化学反应过程中,反应物吸收周围环境的热量进行反应的情况。
这种反应通常伴随着温度降低,吸热现象明显。
吸热反应是非自发进行的,也就是说反应物的自由能升高,反应的焓变为正值。
吸热反应的例子有许多,如溶解氯化铵的反应:NH4Cl(s) + 热量吸收→ NH4+(aq) + Cl-(aq)此反应是一个吸热反应,它从周围环境吸收热量以完成反应。
这种反应在实验室中通常用来制冷或吸附湿度。
三、能量守恒定律化学反应中的能量变化遵循能量守恒定律,即能量在化学反应中既不能被创造,也不能被毁灭,只能从一种形式转化为另一种形式。
根据热力学第一定律,能量的变化等于吸热与放热的代数和。
在生活中,了解化学反应中的能量变化是非常重要的。
例如,在燃料的燃烧过程中,我们需要知道能量的释放情况来优化能源利用和环境保护。
而在化学工业中,了解吸热反应的特性可以帮助我们设计更高效的化学过程,并控制温度变化。
总结:化学反应中的能量变化是化学反应过程中的重要现象之一。
放热反应释放出能量,吸热反应吸收能量。
能量在化学反应中不会被创造或者消失,只能在不同形式之间进行转化。
深入了解化学反应中的能量变化有助于我们更好地理解和应用化学知识,为科学研究和应用提供基础。

高中化学化学反应的能量变化化学反应是物质转变的过程,其中涉及能量的吸收或释放。
在化学反应中,能量的变化可以通过热量的吸收或释放来衡量。
热量是物质内部分子的热运动的一种表现形式,它是化学反应的重要能量因素。
本文将探讨化学反应中的能量变化,以及与之相关的热化学方程式和各类化学反应类型的能量变化。
一、热化学方程式热化学方程式描述了化学反应中的能量变化情况。
在热化学方程式中,我们使用ΔH表示反应的焓变,即反应前后系统的能量变化。
例如,当燃烧甲烷(CH4)产生二氧化碳(CO2)和水(H2O)时,热化学方程式可以写为:CH4 + 2O2 → CO2 + 2H2O ΔH = -890.3 kJ/mol这里的ΔH = -890.3 kJ/mol表示每摩尔甲烷燃烧产生的热量为-890.3千焦耳。
负号表示燃烧过程是放热的,即释放能量。
二、吸热反应和放热反应基于ΔH的正负值,我们可以将化学反应分为吸热反应和放热反应。
1. 吸热反应:当化学反应吸收热量时,ΔH为正数。
这意味着反应物吸收了外界的热量,从而使反应产生的产物具有更高的能量。
吸热反应的一个例子是水的蒸发过程:H2O(l) → H2O(g) ΔH = +40.7 kJ/mol这里的ΔH = +40.7 kJ/mol表示每摩尔水蒸发所需的热量为40.7千焦耳。
正号表示蒸发过程是吸热的,即吸收能量。
2. 放热反应:当化学反应释放热量时,ΔH为负数。
这意味着反应物释放了能量,从而使反应产生的产物具有较低的能量。
放热反应的一个例子是燃烧反应:C(s) + O2(g) → CO2(g) ΔH = -393.5 kJ/mol这里的ΔH = -393.5 kJ/mol表示每摩尔氧化碳所释放的热量为393.5千焦耳。
负号表示燃烧过程是放热的,即释放能量。
三、化学反应的能量变化类型除了吸热反应和放热反应,化学反应还具有其他几种能量变化类型:1. 吸附反应:当反应物从溶液或气体中吸附到固体表面时,会释放出能量,这些反应通常是放热的。



化学反应中的能量变化与热量化学反应是指原子、离子或分子之间发生的变化,产生新的物质和能量的过程。
在化学反应中,能量会发生变化,这种变化可以通过热量的转移来衡量。
本文将探讨化学反应中的能量变化与热量。
一、能量变化的概念能量是物质存在的一种形式,可以存在于不同的形式,例如热能、化学能、机械能等。
在化学反应中,化学键的形成和断裂导致了能量的吸收或释放,从而引起能量的变化。
能量的变化可以用化学反应的焓变(ΔH)来表示。
二、化学反应中的热量变化热量是指物体的内部能量的传递,它是一种能量的形式。
在化学反应中,热量的变化可以通过测定反应物和产物之间的温度变化来确定。
当化学反应释放热量时,温度将升高;反之,吸收热量时,温度将降低。
三、化学反应的热量变化与焓变焓变表示化学反应过程中的热量变化,可以是吸热反应(ΔH>0)或放热反应(ΔH<0)。
吸热反应是指反应过程中吸收了热量,而放热反应则是指反应过程中释放了热量。
化学反应的焓变取决于反应物和产物之间的化学键的形成和断裂。
在化学键形成的过程中,需要输入能量;而在化学键断裂的过程中,会释放能量。
因此,化学反应的焓变可以通过化学键的能量差来计算。
四、热化学方程式热化学方程式是用来表示化学反应过程中的热量变化的方程式。
它通常采用以下形式:反应物1 + 反应物2 + ... → 产物1 + 产物2 + ... + 热量热量的符号(正负号)表示了反应过程中的放热或吸热特性。
例如,当热量为正时,表示反应为吸热反应;而热量为负时,表示反应为放热反应。
五、化学反应中的能量变化与热化学方程式的应用热化学方程式可以用来预测化学反应的热量变化。
通过实验测定反应物和产物的物质的量,以及温度的变化,可以计算出焓变。
这些数据可用于热化学方程式中的热量值。
利用热化学方程式,可以计算出化学反应的焓变,从而了解反应过程中的能量变化。
这对于理解化学反应的热力学性质非常重要,也对于工业生产和能源利用有着重要的意义。

化学物质的化学反应与能量变化化学反应是化学物质发生转变的过程,伴随着化学反应的正在进行的过程中,能量也会发生变化。
本文将探讨化学物质的化学反应与能量变化之间的关系。
一、化学反应与能量变化在化学反应中,物质的化学性质发生改变,原子间的化学键断裂和形成。
这些改变解释了为什么化学反应需要吸热或放热,并揭示了化学反应背后的能量变化。
反应物吸收能量的过程称为吸热反应,反应物释放能量的过程称为放热反应。
化学反应可以是放热反应,也可以是吸热反应。
1. 放热反应放热反应是指当反应物转化为生成物时,反应系统释放出能量。
放热反应通常会产生热量和光能。
典型的放热反应是燃烧反应,例如木材燃烧时生成的热量和光能。
放热反应的能量变化可以用下式表示:反应物 -> 生成物 + 能量2. 吸热反应吸热反应是指当反应物转化为生成物时,反应系统吸收外界的能量。
吸热反应通常会吸收热量,使环境变冷。
典型的吸热反应是溶解反应和融化反应。
吸热反应的能量变化可以用下式表示:反应物 + 能量 -> 生成物二、能量变化的表征为了量化化学反应中的能量变化,我们引入了反应焓的概念。
焓(enthalpy)是反应物和生成物之间的能量差。
1. 反应焓变反应焓变(∆H)是指在化学反应中,以摩尔为单位的反应物和生成物之间的焓差。
反应焓变可以通过测量反应热量来确定。
如果反应焓变(∆H)为正值,表示反应是吸热反应;如果反应焓变(∆H)为负值,表示反应是放热反应。
2. 焓变的实际应用反应焓变的知识在很多方面都有实际应用。
例如,它可以用于计算燃料的热值,评估化学工艺的可行性,以及研究化学反应的热效应。
三、能量守恒定律与化学反应能量守恒定律表明,在化学反应中,能量既不能被创造也不能被毁灭,只能从一种形式转化为另一种形式。
因此,在化学反应中,反应物和生成物之间的能量总和保持不变。
根据能量守恒定律,我们可以利用热力学计算化学反应的能量变化。
通过实验测量反应热量,我们可以确定反应焓变,并由此获得反应的能量变化。

化学反应中的能量变化计算化学反应中的能量变化是一个重要的研究领域,对于了解反应过程的热力学特征以及优化化学反应具有重要意义。
本文将介绍化学反应中能量变化的计算方法。
一、热量变化的计算方法化学反应中的热量变化,通常用焓变(ΔH)来表示。
焓是系统在常压下的内能与对外界做的功之和,可以通过实验测量反应物与生成物的温度变化来计算。
化学反应的热量变化由以下公式给出:ΔH = q / n其中,ΔH为焓变,q为实验测得的热量变化,n为反应物或生成物的摩尔数。
二、标准反应焓的计算方法标准状态下的反应焓(ΔH°)是指在常压、恒温下,1mol参与反应物质生成反应物所放出或吸收的热量。
标准反应焓可以根据化学方程式及标准物质的标准反应焓计算得出。
ΔH° = Σ(nfΔH°f- nrΔH°r)其中,nf为生成物的摩尔系数,ΔH°f为生成物的标准反应焓;nr 为反应物的摩尔系数,ΔH°r为反应物的标准反应焓。
三、能量守恒定律在化学反应中的应用能量守恒定律指出在封闭系统中,能量不会从系统内部转移到外部或从外部转移到系统内部,能量只能在系统内部进行转化。
在化学反应中,根据能量守恒定律,可以应用以下公式计算焓变:ΔH = ΔH° + ΔE其中,ΔH为焓变,ΔH°为标准反应焓,ΔE为系统内部能量变化。
四、化学反应中的热力学计算化学反应的热力学计算广泛应用于工业生产和实验室研究。
根据热力学定律和实验数据,可以计算出反应的热力学参数,如反应熵变(ΔS)和反应自由能变(ΔG)。
ΔS = Σ(nfSf- nrSr)其中,nf为生成物的摩尔系数,Sf为生成物的摩尔熵;nr为反应物的摩尔系数,Sr为反应物的摩尔熵。
ΔG = ΔH - TΔS其中,ΔG为反应的标准自由能变,T为反应的温度。
五、小结通过热量变化的计算,可以了解化学反应中的能量变化情况。
标准反应焓的计算方法可以根据化学方程式和标准物质的数据计算得到。

化学反应中的物质能量变化化学反应是物质之间发生的转变过程,其中伴随着能量的变化。
这种能量的变化在化学反应中起着重要的作用,是我们理解和研究化学过程的基础。
本文将探讨化学反应中的物质能量变化的主要类型及其影响因素。
一、放热反应放热反应是指在反应过程中释放能量的化学反应。
在这种反应中,反应产物的总能量低于反应物的总能量。
这种能量释放可以以热量的形式在环境中感受到,例如产生热气或使反应容器升温。
放热反应通常是放出的能量来自于化学键的破裂,也可以来自于其他反应过程中的能量转换。
放热反应常见的例子包括燃烧反应和酸碱中和反应。
二、吸热反应吸热反应是指在反应过程中吸收能量的化学反应。
在这种反应中,反应产物的总能量高于反应物的总能量。
这种能量的吸收使得反应容器或周围环境变冷。
吸热反应也可以由于化学键的形成或其他能量转换过程产生。
吸热反应的一个典型例子是化学溶解过程,当溶质溶解于溶剂时,会吸收周围环境的能量。
三、内能变化化学反应中的物质能量变化主要体现在反应物和产物的内能之间的差异上。
内能是物质分子中各种能量的总和,包括分子内的势能和动能、分子间的相互作用能以及其他能量形式。
化学反应中,反应物的内能与产物的内能存在差异,这种差异导致了反应的能量变化。
四、活化能化学反应发生时,反应物要克服一定的能垒才能达到反应状态。
这个能垒被称为活化能。
活化能是一种能量差异,反应物必须具备足够的能量才能克服这个能垒并达到活化状态,进而发生化学反应。
活化能的高低决定了反应的速率,越低则反应速率越快。
五、影响物质能量变化的因素化学反应中物质能量变化的大小与多个因素密切相关。
以下是几个常见的影响因素:1. 反应物的物理性质和化学性质:不同物质之间的能量变化具有差异。
例如,单质之间的反应往往伴随着能量的释放,而元素间的化合反应通常需要吸收能量。
2. 反应条件:例如温度、压力和溶液浓度等因素对反应物质的能量变化具有重要影响。
温度的变化可以改变反应物分子的平均动能和活化能,从而改变反应的能量变化。

高一化学知识点化学反应的能量变化化学反应的能量变化是化学领域中的一个重要概念。
在化学反应过程中,物质发生了变化,并伴随着能量的吸收或释放。
本文将就化学反应的能量变化进行探讨,包括内能变化、焓变、化学反应热等方面。
一、内能变化内能是指系统中所有分子的总能量,包括分子的动能和势能。
化学反应发生时,反应物的分子结构被打破,新的化学键形成,导致内能的变化。
反应物与生成物之间的内能差称为内能变化(ΔU)。
化学反应的内能变化可以分为两种情况:吸热反应和放热反应。
1. 吸热反应:当反应物的内能大于生成物的内能时,化学反应需要从外界吸收热量才能进行。
这种反应产生吸热现象,即反应过程中会感觉到周围温度的升高。
吸热反应的内能变化为正值(ΔU > 0)。
2. 放热反应:当反应物的内能小于生成物的内能时,化学反应会释放出热量给周围环境。
这种反应产生放热现象,即反应过程中会感觉到周围温度的降低。
放热反应的内能变化为负值(ΔU < 0)。
二、焓变焓(H)是指化学反应过程中,物质所含的能量总量。
在常压下,反应物和生成物的焓差称为焓变(ΔH)。
焓变可以帮助我们了解反应过程中的能量变化情况。
与内能变化类似,焓变也可以分为吸热反应和放热反应。
1. 吸热反应:在吸热反应中,反应物的焓高于生成物的焓,化学反应需要吸收热量才能进行。
吸热反应的焓变为正值(ΔH > 0)。
2. 放热反应:在放热反应中,反应物的焓低于生成物的焓,化学反应会释放热量给周围环境。
放热反应的焓变为负值(ΔH < 0)。
焓变与内能变化之间存在关系:ΔH = ΔU + PΔV,其中P为常数,ΔV为体积变化。
三、化学反应热化学反应热是指在标准状态下,单位摩尔物质在化学反应中产生或吸收的热量。
通常用符号ΔH表示。
1. 焓变与化学反应热之间的关系在常压下,化学反应热等于焓变:ΔH = Q,其中Q为反应所吸收或释放的热量。
2. 化学反应热的测定方法化学反应热的测定可以通过热量计实验进行。
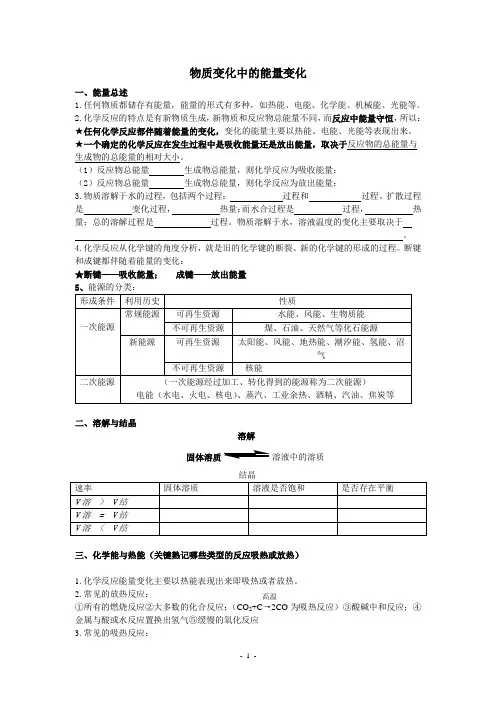
物质变化中的能量变化一、能量总述1.任何物质都储存有能量,能量的形式有多种,如热能、电能、化学能、机械能、光能等。
2.化学反应的特点是有新物质生成,新物质和反应物总能量不同,而反应中能量守恒,所以:★任何化学反应都伴随着能量的变化,变化的能量主要以热能、电能、光能等表现出来。
★一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
(1)反应物总能量 生成物总能量,则化学反应为吸收能量;(2)反应物总能量 生成物总能量,则化学反应为放出能量;3.物质溶解于水的过程,包括两个过程: 过程和 过程。
扩散过程是 变化过程, 热量;而水合过程是 过程, 热量;总的溶解过程是 过程。
物质溶解于水,溶液温度的变化主要取决于 。
4.化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。
断键和成键都伴随着能量的变化:★断键——吸收能量; 成键——放出能量二、溶解与结晶溶解固体溶质溶液中的溶质三、化学能与热能(关键熟记哪些类型的反应吸热或放热)1.化学反应能量变化主要以热能表现出来即吸热或者放热。
2.常见的放热反应: ①所有的燃烧反应②大多数的化合反应;(CO 2+C →2CO 为吸热反应)③酸碱中和反应;④金属与酸或水反应置换出氢气⑤缓慢的氧化反应3.常见的吸热反应:高温(1)大多数的分解反应;(2)以下几个反应是吸热反应: ①Ba(OH)2·8H 2O+2NH 4Cl →2NH 3↑+BaCl 2+10H 2O ②CO 2+C====2CO ③C+H 2O →CO+H 2注意:有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:a 、 放热:①浓硫酸溶于水②NaOH 溶于水③CaO 溶于水,其中属于放热反应的是b 、 吸热:铵盐溶于水[练习]1、下列反应中,既属于氧化还原反应同时又是吸热反应的是( )A.Ba(OH)2.8H 2O 与NH 4Cl 反应B.灼热的炭与CO 2反应C.铝与稀盐酸D.H 2与O 2的燃烧反应2、已知反应X +Y →M +N 为放热反应,对该反应的下列说法中正确的是( )A. X 的能量一定高于MB. Y 的能量一定高于NC. X 和Y 的总能量一定高于M 和N 的总能量D. 因该反应为放热反应,故不必加热就可发生3、下列说法正确的是( )A. 物质发生化学反应都伴随着能量变化B .伴有能量变化的物质变化都是化学变化C .在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量D. 放热反应的发生无需任何条件四、化学能与电能1.原电池是将化学能直接转为电能的装置。
考点3化学反应中的能量变化一、反应热1、化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号ΔH表示,单位一般采用kJ/mol。
当ΔH为负值为放热反应;当ΔH为正值为吸热反应。
测量反应热的仪器叫做量热计。
2、燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热。
3、中和热:在稀溶液中,酸跟碱发生中和反应生成1molH2O,这时的反应热叫做中和热。
中学阶段主要讨论强酸和强碱的反应。
二、热化学方程式1、书写热反应方程式应注意的问题:(1)由于反应热的数值与反应的温度和压强有关,因此必须注明,不注明的是指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应热的数值不同,因此要注明物质的聚集状态。
(3)热化学方程式中的化学计量数为相应物质的物质的量,它可以是整数,也可以是分数。
2、书写热化学方程式的一般步骤(1)依据有关信息写出注明聚集状态的化学方程式,并配平。
(2)根据化学方程式中各物质的化学计量数计算相应的反应热的数值。
(3)如果为放热反应ΔH为负值,如果为吸热反应则ΔH为正值。
并写在第一步所得方程式的后面,中间用“;”隔开。
(4)如果题目另有要求,如反应燃料燃烧热的热化学方程式和有关中和热的热化学方程式,可将热化学方程式的化学计量数变换成分数。
三、中和热的测定1、测定前的准备工作(1)选择精密温度计(精确到0.10C),并进行校对(本实验温度要求精确到0.10C)。
(2)使用温度计要轻拿轻声放。
刚刚测量高温的温度计不可立即用水冲洗,以免破裂。
(3)测量溶液的温度应将温度计悬挂起来,使水银球处于溶液中间,不要靠在烧杯壁上或插到烧杯底部。
不可将温度计当搅拌棒使用。
2、要想提高中和热测定的准确性,实验时应注意的问题(1)作为量热器的仪器装置,其保温隔热的效果一定要好。
因此可用保温杯来做。
如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平,这样可以减少热量损失。
化学反应的能量变化化学反应是指物质之间的原子重组过程,其伴随着能量的变化。
在化学反应中,原子之间的化学键被打破,新的化学键形成,从而产生了能量的变化。
能量可以以不同的形式存在,如热能、化学能、电能等。
本文将深入探讨化学反应中的能量变化过程。
一、热能的变化化学反应中最常见的能量变化形式是热能的变化。
化学反应可以释放热能,也可以吸收热能。
释放热能的反应称为放热反应,吸收热能的反应则称为吸热反应。
1. 放热反应放热反应是指在化学反应中释放出热能。
这种反应通常是一个自发的过程,会伴随着温度升高或周围环境变热。
放热反应常见的例子包括燃烧反应和酸碱中和反应。
例如,将燃料与氧气反应时,会产生大量热能,例如燃烧木材产生的火焰和热量。
2. 吸热反应吸热反应是指在化学反应中吸收热能。
这种反应需要外界向系统提供能量,因此周围环境会变冷。
吸热反应常见的例子包括融化冰块和蒸发水等过程。
在这些反应中,吸收热能使得物质的状态发生改变。
二、化学能的变化化学反应中,化学键的断裂和形成是伴随着化学能的变化的。
当化学键被打破时,化学能会被释放出来,而当新的化学键形成时,化学能会被吸收。
1. 化学键能化学键能是指在成键过程中释放或吸收的能量。
不同化学键的能量不同,常见的化学键有离子键、共价键和金属键等。
通过断裂和形成这些化学键,化学反应中的化学能发生变化。
2. 反应势能反应势能是指化学反应在不同阶段所具有的能量。
在化学反应过程中,反应物的势能发生改变,并决定了反应的进行方向和速率。
当反应物的势能高于产物时,反应是可逆的,而当反应物的势能低于产物时,反应是不可逆的。
三、其他能量变化除了热能和化学能的变化外,化学反应中还可以伴随其他形式的能量变化。
例如,电能在电化学反应中发挥重要作用。
在电化学反应中,化学能被转化为电能,反之亦然。
结语化学反应的能量变化是化学研究中的重要内容。
热能和化学能的变化是化学反应中最常见和最显著的能量变化形式,而其他形式的能量变化则根据具体反应的特点而定。
化学反应中的能量变化化学反应是物质转化过程中发生的重要现象,众多化学反应都会涉及能量变化。
能量在化学反应中的变化对反应速率、反应热、反应平衡等方面都有重要的影响。
本文将探讨化学反应中的能量变化,以及其对反应过程的影响。
一、化学反应的能量变化类型在化学反应中,能量可以以不同的形式进行转化。
常见的能量变化类型有以下几种:1. 焓变(ΔH):焓变是指在常压条件下,反应中吸热或放热的过程。
当反应吸热时,焓变为正值,表示系统吸收了热量;当反应放热时,焓变为负值,表示系统释放了热量。
2. 动能变化:有些化学反应中,反应物和生成物的分子速度发生改变,导致动能的变化。
例如,爆炸反应中,反应物的分子速度突然增加,从而导致动能的增加。
3. 电能变化:在某些化学反应中,电子转移也可以导致能量的变化。
例如,电池中的反应就涉及电子的转移,从而产生电能。
二、能量变化对化学反应的影响能量变化对化学反应具有重要的影响,主要体现在以下几个方面:1. 反应速率:化学反应的速率与反应物之间的能量差有关,能量变化越大,反应速率通常越快。
这是因为能量变化可以改变反应物粒子的动能,使它们更容易克服活化能,从而提高反应速率。
2. 反应热:焓变(ΔH)反映了反应过程中的放热或吸热现象。
当反应放热时,系统释放了热量,反应是放热反应;当反应吸热时,系统吸收了热量,反应是吸热反应。
反应热的大小决定了化学反应的热效应。
3. 反应平衡:在化学反应达到平衡时,反应物与生成物的浓度不再变化。
能量变化可以影响反应平衡的位置。
根据Le Chatelier原理,当系统受到外界能量变化刺激时,系统会试图抵消这种变化,从而使平衡位置发生偏移。
三、实例分析:焙烧反应焙烧反应是指将金属矿石加热至高温,使其发生热分解,转变为金属与非金属氧化物的反应。
以焙烧铁矿石(Fe2O3)为例,化学方程式如下:2Fe2O3(s) → 4Fe(s) + 3O2(g)在这个反应中,可以观察到以下能量变化现象:1. 吸热现象:焙烧反应需要提供大量的热能,因为反应需要克服Fe2O3的化学键强度,使其分解为Fe和O2。
高一化学反应与能量知识点总结一、在化学反应过程中,化学键的断裂需要吸收外界的能量,化学键的形成会向外界释放出能量,因此在化学反应中,参与反应的物质会伴随着能量的变化。
1、化学变化中能量变化的本质原因①当化学键键能越大,断开时所需的能量就越多,形成时所释放出的能量也越多。
②化学反应中,反应物中的化学键(总键能E1)断裂时,吸收能量E1,在形成化学键变成生成物(总键能E2)时,放出能量E2。
整个过程中,反应体系从外界吸收的能量为ΔE=E1-E2 .2、有的化学反应会吸收能量,有的化学反应会放出能量。
据图可知,一个化学反应是吸收能量还是放出能量,决定于反应物总能量与生成物总能量的相对大小。
3、任何化学反应除遵循质量守恒外,同样也遵循能量守恒。
反应物与生成物的能量差若以热量形式表现即为放热反应(化学能转化成热能)或吸热反应(热能转化成化学能)。
(E反:反应物具有的能量;E生:生成物具有的能量):4表现形式放热反应吸热反应键能变化生成物总键能大于反应物总键能生成物总键能小于反应物总键能由1、2联系得键能越大,物质能量越低,越稳定;反之键能越小,物质能量越高,越不稳定,图示5、常见的放热反应和吸热反应☆常见的放热反应:①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应(特殊:C+CO2△2CO是吸热反应)。
注意:有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:放热:①浓硫酸溶于水②NaOH溶于水③CaO溶于水,其中属于放热反应的是③☆常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g)△CO(g)+H2(g)。
②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。
高中化学的归纳化学反应中的能量变化化学反应中的能量变化是化学领域中的重要概念之一。
在研究化学反应时,我们常常需要了解反应中发生的能量变化情况,以此来解释反应的性质和特点。
通过归纳,我们可以将化学反应中的能量变化分为放热反应和吸热反应两种类型。
1. 放热反应放热反应是指在反应过程中释放出能量的反应。
这种反应通常会使周围环境温度升高。
最典型的放热反应是燃烧反应。
例如,当燃料和氧气发生反应时,会产生大量的热能和光能,从而产生火焰。
这是因为在这类反应中,化学键的形成释放出的能量大于化学键的断裂吸收的能量,从而导致反应系统的内能减少,也就是释放出了能量。
2. 吸热反应吸热反应是指在反应过程中吸收外界的能量的反应。
这种反应通常会使周围环境温度降低。
吸热反应的例子非常丰富,包括许多常见的化学反应,如溶解反应和融化反应。
当固体溶解于溶液中时,需要吸收一定的热量才能使固体分子之间的相互作用力弱化,从而使溶质与溶剂分子之间形成新的相互作用力。
这个过程需要吸收热量,因此是一个吸热反应。
3. 化学反应热化学反应热是指在恒压条件下,物质反应时所发生或吸收的热量变化。
根据热力学第一定律,化学反应过程中吸收的热量等于该反应所做的功与反应物之间的热量变化之和。
热量变化可以用ΔH来表示,其中H代表焓(能)。
化学反应热可以通过实验测量得到。
常见的测量方法有常压量热法和恒温恒压热容量法。
常压量热法通过将反应物加入绝热容器中,测量反应前后容器的温度变化,然后根据温度变化计算出反应的热量变化。
恒温恒压热容量法则利用恒温恒压条件下,测量反应溶液温度的变化,从而计算出反应的热量变化。
归纳化学反应中的能量变化对于理解化学反应的本质、探索反应机理以及设计实际应用中的反应过程至关重要。
通过对放热反应和吸热反应的分析,我们可以了解反应物与产物之间的能量转化关系,进而预测反应的趋势和方向。
此外,研究化学反应热还有助于优化化学反应条件,提高反应效率,节约能源。
化学反应伴随的能量变化形式一、化学反应中的能量变化化学反应是物质发生变化的过程,伴随着能量的转化和变化。
在化学反应中,能量可以以不同的形式表现出来,主要包括放热反应和吸热反应两种形式。
1. 放热反应放热反应是指在反应过程中,系统向周围环境释放热量的反应。
这种反应释放的热量可以使周围温度升高,或者产生明显的热效应。
放热反应常常伴随着物质的燃烧、氧化等过程,是一种常见的能量释放形式。
例如,燃烧是一种放热反应。
当物质与氧气发生反应时,会释放出大量的热量。
例如,火焰燃烧时,燃料与氧气发生反应,产生的热量使得火焰升高,周围温度升高。
2. 吸热反应吸热反应是指在反应过程中,系统从周围环境吸收热量的反应。
这种反应吸收的热量可以使周围温度降低,或者产生明显的冷效应。
吸热反应常常伴随着物质的溶解、融化等过程,是一种常见的能量吸收形式。
例如,物质的融化是一种吸热反应。
当固体物质受热而融化时,会吸收大量的热量。
这是因为在融化过程中,固体分子之间的相互作用力被克服,需要吸收热量才能使固体转变为液体。
二、化学反应中能量变化的原因化学反应中能量的变化主要是由于反应物和生成物之间的键能的变化所致。
在化学反应中,化学键的形成和断裂使得反应物的化学能发生变化,从而导致能量的转化。
1. 化学键的形成在化学反应中,反应物中的原子通过化学键的形成组合成新的分子或离子。
化学键的形成是一种放出能量的过程,这是因为化学键的形成使得反应物的内能降低,从而释放出一定的能量。
例如,氢气与氧气发生反应生成水分子时,氢原子和氧原子通过共价键结合成水分子。
在这个过程中,氢气和氧气的分子内能降低,释放出大量的能量。
2. 化学键的断裂在化学反应中,反应物中的化学键可以被断裂,从而使得反应物的内能增加。
化学键的断裂是一种吸收能量的过程,这是因为化学键的断裂需要克服原子之间的相互作用力,从而吸收一定的能量。
例如,水分子发生电解反应时,水分子中的氧气与氢气的化学键被断裂。