2020高考化学 考题 分子结构与性质
- 格式:doc
- 大小:693.67 KB
- 文档页数:18

第15题:有机物结构与性质满分:70分1.下列与有机物结构、性质相关的叙述错误的是A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同D.苯不能使溴的四氯化碳溶液发生化学反应褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键2.下列叙述中,错误的是( )A.苯酚具有弱酸性,但不能使紫色石蕊变红B.因发生化学反应而使溴水褪色的物质一定是和溴水发生加成反应C.用核磁共振氢谱鉴别1溴丙烷和2溴丙烷D.含醛基的有机物都能发生银镜反应3.下列关于常见有机物的说法正确的是A.乙烯和苯都能和溴水发生化学反应而使溴水褪色B.乙烷可使酸性高锰酸钾溶液褪色C.糖类和蛋白质都是高分子化合物D.乙酸和油脂都能与氢氧化钠溶液反应4.关于有机物主要特点的下列说法中不正确的有A.大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂B.有机物的熔点低、受热易分解,且都能燃烧C.绝大多数有机物是非电解质,不易导电D.有机物的化学反应比较复杂一般较慢且有副反应5.下列关于碳原子的成键特点及成键方式的理解,正确的是()A.饱和碳原子不能发生化学反应B.C原子只能与C原子形成不饱和键C.任何有机物中H原子数目不可能为奇数D.五个C原子之间能够形成五个碳碳单键6.下列说法不正确的是()A. 法国化学家维勒首次提出有机化学的概念;德国化学家贝采里乌斯由氰酸铵合成了尿素,首次打破了有机物和无机物的界限B. 李比希用燃烧法来测定有机化合物中碳氢元素质量分数C. 用核磁共振氢谱和红外光谱法可以区别乙醇和二甲醚(CH3OCH3)D. 用“同位素示踪法”是研究有机化学反应历程的手段之一7.下列关于有机化学发展史的说法错误的是网]A. 中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始B. 德国化学家李比希提出运用同位素示踪法研究化学反应历程C. 瑞典科学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支D. 德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限8.下列关于一些有机物在合适条件下的化学反应说法正确的是()A .能催化氧化生成醛B .能在浓硫酸的作用下生成烯C.CH3Br 能在氢氧化钠的乙醇溶液的作用下生成醇D .既能与酸反应也能与碱反应生成盐9.下列说法不正确的是()A.李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法B.红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法C.同位素示踪法是研究化学反应历程的手段之一D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别10.下列说法正确的是A. 沸点:邻二甲苯>间二甲苯>对二甲苯B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应C. 有机物A的分子式为C16H16O3D. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键11.有关下列物质分子结构特征描述正确的是A.1 mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同B.苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构C.CHCl HCl和CClH HCl属于同一种物质,不能用来解释甲烷是一种正四面体结构D.乙烯容易与溴的四氯化碳溶液发生反应,且1 mol乙烯完全加成消耗1 mol溴单质,证明乙烯分子里含有一个碳碳双键12.有关下列物质分子结构特征描述正确的是A.乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键B.表示苯分子的结构,因此能解释邻二甲苯有CH3CH3和CH3CH3两种结构C.因为甲烷是一种正四面体结构,所以CHCl HCl和CClH HCl属于同一种物质D.苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色13.下列与有机物的结构、性质有关的叙述正确的是A.苯、油脂均不能使酸性KMnO4溶液褪色B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同14.下列说法不正确...的是A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学B .蔗糖、淀粉、油脂及其水解产物均为非电解质C .通过红外光谱分析可以区分乙醇和乙酸乙酯D .石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. 15.下列说法正确的是A .按系统命名法,化合物CH 2CHCH 2CH(CH 3)2CH 3CH 2CH(CH 3)2的名称为2,6-二甲基-5-乙基庚烷B .丙氨酸和苯丙氨酸脱水,最多可生成3种二肽C .化合物是苯的同系物D .三硝酸甘油酯的分子式为C 3H 5N 3O 9 16.下列关于有机物的叙述正确的是A.乙醇不能发生取代反应B.C 4H 10 有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别 17.(2014届浙江省金丽衢十二校高三第二次联考理综化学试卷) 下列说法正确的是 A.按系统命名法的名称为2一甲基一3,5一二乙基己烷B.用Na 2 C03溶液能区分CH 3COOH 、CH 3CH 2OH,苯、硝基苯四种物质C .等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所耗氧气的量依次增加D.下列物质的沸点按由低到高顺序为:(CH 3CH 2)2CH 3<(CH 3)3CH <CH 3(CH 2)3CH 3<(CH 3)2CHCH 2CH 3 18.下列叙述中,错误的是( )A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯B.苯乙烯在合适条件下催化加氢可生成乙基环己烷C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯19.(2014届浙江省嘉兴市高三教学测试(二)理综化学试卷) 下列说法正确的是A .按系统命名法,化合物 的名称为2,4—二乙基—6—丙基辛烷B .月桂烯 ()所有碳原子一定在同一平面上C .取卤代烃,加入氢氧化钠的乙醇溶液加热一段时间后冷却,再加入稀硝酸酸化的硝酸银溶液,一定会产生沉淀,并根据沉淀颜色判断卤代烃中卤原子的种类D .通常条件下,1mol 的 分别与H 2 和浓溴水完全反应时,消耗的H 2和Br 2的物质的量分别是 4mol 、3mol20.(2014届浙江省金华十校高考模拟考试理综化学试卷) 下列说法正确的是A .按系统命名法,有机物的名称为3,7一二.甲基-4-乙基辛烷B .高聚物脲醛树脂()的合成单体之一是C .1 mol 葡萄糖能水解生成2 rnol CH 3CH 2OH 和2 mol CO 2D .在酸性条件下,CH 3CO 18OC 2 H 5的水解产物是CH 3CO 18OH 和C 2H 5OH 21.下列对有机物结构或性质的描述,错误..的是 A .乙酸与乙醇在一定条件下发生酯化反应,加入浓H 2SO 4有利于酯化反应的进行B .鉴别己烯中是否混有少量甲苯,先加足量的酸性高锰酸钾溶液,然后再加入溴水C .乙烷和丙烯的物质的量各1mol ,完成燃烧生成3molH 2OD .蛋白质溶液中分别加入饱和(NH 4)2SO 4和CuSO 4溶液,均出现白色沉淀,但原理不同 22.下列有机物结构、性质相关的叙述错误的是A 、乙酸分子中含有羧基,可与NaHCO 3溶液反应生成CO 2B 、蛋白质和油脂都属于高分子化合物,一定条件下都能水解C 、甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同D 、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 23.下列对有机物结构或性质的描述,错误..的是 A .一定条件下,乙醇可以发生取代反应或消去反应B .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱C .乙烷和丙烯的物质的量各1mol ,完全燃烧都生成3molH 2OD .光照下2,2—二甲基丙烷与Cl 2反应,其一氯取代物只有二种 24.下列对有机物结构或性质的描述,错误的是A .一定条件下,Cl 2可在甲苯的苯环或侧链上发生取代反应B .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱C .乙烷和丙烯的物质的量共1mol ,完成燃烧生成3molH 2OD .光照下2,2—二甲基丙烷与Br 2反应其一溴取代物只有一种 25.下列对有机物结构或性质的描述错误的是A .乙酸与乙醇在一定条件下发生酯化反应,加入浓H 2SO 4有利于酯化反应的进行B .鉴别己烯中是否混有少量苯,加入少量溴水C .乙烷和丙烯的物质的量各1mol ,完全燃烧均生成3molH 2OD .蛋白质溶液中分别加入饱和(NH 4)2SO 4和CuSO 4溶液,均有白色沉淀,但原理不同 26.下列对有机物结构或性质的描述,错误..的是 A .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱 B .一定条件下,Cl 2可在甲苯的苯环或侧链上发生取代反应 C .乙烷和丙烯的物质的量共1mol ,完全燃烧生成3molH 2O D .硬脂酸甘油酯的皂化反应的两种产物均可溶于水 27.下列与有机物结构、性质相关的叙述错误的是A .甲烷与氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同B .溴水、酸性高锰酸钾溶液均可用于鉴别乙烯和乙烷,也均可以除去乙烷中的乙烯C .核磁共振氢谱可以鉴别某些不同物质,质谱可快速、准确测定物质的分子量D .实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol 、-3747 kJ/mol 和-3265 kJ/mol ,可以证明在苯分子中不存在独立的碳碳双键 28.下列与有机物结构、性质相关的叙述错误的是A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2B.蛋白质和油脂都属于高分子化合物,一定条件下能水解C.甲烷和氯气反应生成一氯甲烷、苯和硝酸反应生成硝基苯的反应类型相同D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键29.下列对有机物结构或性质的描述,错误..的是A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应B.甲苯与浓硝酸和浓硫酸的混酸反应制TNT体现了苯环对侧链的影响。
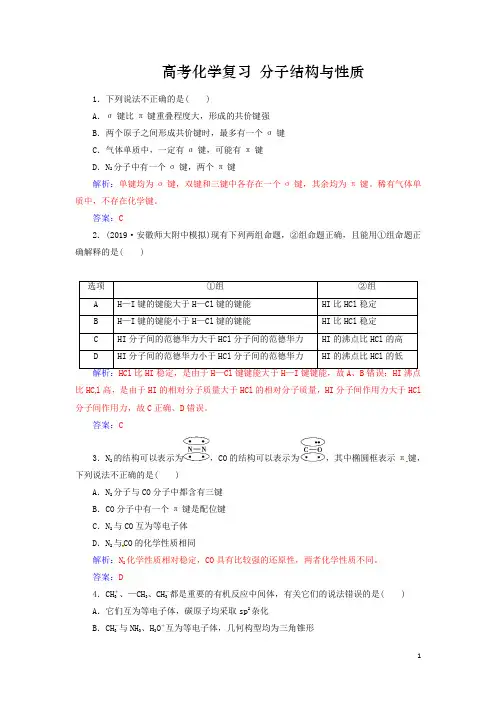
高考化学复习分子结构与性质1.下列说法不正确的是( )A.σ键比π键重叠程度大,形成的共价键强B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,一定有σ键,可能有π键D.N2分子中有一个σ键,两个π键解析:单键均为σ键,双键和三键中各存在一个σ键,其余均为π键。
稀有气体单质中,不存在化学键。
答案:C2.(2019·安徽师大附中模拟)现有下列两组命题,②组命题正确,且能用①组命题正确解释的是( )选项①组②组A H—I键的键能大于H—Cl键的键能HI比HCl稳定B H—I键的键能小于H—Cl键的键能HI比HCl稳定C HI分子间的范德华力大于HCl分子间的范德华力HI的沸点比HCl的高D HI分子间的范德华力小于HCl分子间的范德华力HI的沸点比HCl的低比HC l高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl 分子间作用力,故C正确、D错误。
答案:C3.N2的结构可以表示为,CO的结构可以表示为,其中椭圆框表示π键,下列说法不正确的是( )A.N2分子与CO分子中都含有三键B.CO分子中有一个π键是配位键C.N2与CO互为等电子体D.N2与CO的化学性质相同解析:N2化学性质相对稳定,CO具有比较强的还原性,两者化学性质不同。
答案:D4.CH+3、—CH3、CH-3都是重要的有机反应中间体,有关它们的说法错误的是( ) A.它们互为等电子体,碳原子均采取sp2杂化B.CH-3与NH3、H3O+互为等电子体,几何构型均为三角锥形C.CH+3中的碳原子采取sp2杂化,所有原子均共面D.2个—CH3或1个CH+3和1个CH-3结合均可得到CH3CH3解析:CH+3、—CH3、CH-3分别具有6个、7个和8个价电子,电子总数分别是8个、9个和10个,它们不是等电子体,A选项说法错误;CH-3与NH3、H3O+均具有8个价电子、4个原子,互为等电子体,几何构型均为三角锥形,B选项说法正确;根据价层电子对互斥模型,CH+3中C原子的价电子对数为3 ,碳原子采取sp2杂化,其空间构型是平面三角形,C选项说法正确;2个—CH3或1个CH+3和1个CH-3结合都能得到CH3CH3, D选项说法正确。


第12章(物质结构与性质)李仕才第二节分子结构与性质考点二分子的立体构型1.用价层电子对互斥理论推测分子的立体构型(1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
(2)价层电子对数的确定方法其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是1个与中心原子结合的原子提供的价电子数,x是与中心原子结合的原子数。
(3)价层电子对互斥模型与分子立体构型的关系2.用杂化轨道理论推测分子的立体构型(1)杂化轨道概念:在外界条件的影响下,原子内部能量相近的原子轨道重新组合的过程叫原子轨道的杂化,组合后形成的一组新的原子轨道,叫杂化原子轨道,简称杂化轨道。
(2)杂化轨道的类型与分子立体构型(3)由杂化轨道数判断中心原子的杂化类型杂化轨道用来形成σ键和容纳孤电子对,所以有公式:杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数。
代表物杂化轨道数中心原子杂化轨道类型CO20+2=2 spCH2O 0+3=3 sp2CH40+4=4 sp3SO21+2=3 sp2NH31+3=4 sp3H2O 2+2=4 sp3(4)3.等电子原理原子总数相同,价电子总数相同的粒子具有相似的化学键特征,它们的许多性质相似,如CO和N2。
等电子体的微粒有着相同的分子构型,中心原子也有相同的杂化方式。
常见等电子体与空间构型微粒通式价电子总数立体构型CO2、CNS-、NO+2、N-3AX216e-直线形CO2-3、NO-3、SO3AX324e-平面三角形SO2、O3、NO-2AX218e-V形SiO4-4、PO3-4、SO2-4、ClO-4AX432e-正四面体形PO3-3、SO2-3、ClO-3AX326e-三角锥形CO、N2AX 10e-直线形CH4、NH+4AX48e-正四面体形判断正误(正确的打“√”,错误的打“×”)1.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对。

高考化学复习考点知识突破解析分子结构与性质1.钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。
回答下列问题:(1)基态Ti原子的价电子排布图为___________。
(2)已知电离能:I2(Ti)=1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为___________。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:①钛的配位数为___________,碳原子的杂化类型___________。
②该配合物中存在的化学键有___________(填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 E。
氢键【答案】 K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K) 6 sp3、sp2 BD【详解】(1)基态Ti原子的价电子排布式为3d24s2,则基态Ti原子的价电子排布图为;(2)从价电子轨道的能量来看,K+失去的是全充满的3p6电子,而Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K);(3)①从结构图可以看出,Ti与6个原子形成共价键,所以钛的配位数为6,在配合物分子中,碳原子既形成单间,也形成双键,价层电子数分别为4和3,所以碳原子的杂化类型为sp3和sp2;②该配合物中,存在中心原子与配体间的配位键,其他非金属原子之间形成共价键,故答案选BD;2.铁、钴均为第四周期VIII族元素,它们的单质及化合物具有广泛用途。
回答下列问题:(1)基态Co2+中成单电子数为___________;Fe和Co的第三电离能I3(Fe)___________I3(Co)(填“>”“<”或“=”)。
(2)化学上可用EDTA测定Fe2+和Co2+的含量。
EDTA的结构简式如图所示:①EDTA中电负性最大的元素是___________ ,其中C原子轨道杂化类型为___________;②EDTA存在的化学键有___________(填序号)。

课时作业32 分子结构与性质时间:45分钟一、单项选择题(每小题只有一个选项符合题意)1.氮元素可形成卤化物、叠氮化物及配合物等许多化合物,下列说法不正确的是(C)A.NF3分子的空间构型为三角锥形B.叠氮酸(HN3)是一种弱酸,可部分电离出H+和N错误!,则N2O与N错误!互为等电子体C.叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8D.NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能解析:NF3分子N原子的价层电子对数为3+错误!×(5-3×1)=4,孤电子对数为1,所以分子空间构型为三角锥形,A正确;原子数和价电子数都相同的微粒互为等电子体,N2O与N错误!互为等电子体,B正确;叠氮化物与Co3+等形成配合物,如[Co (N3)(NH3)5]SO4,配体为N错误!和NH3,所以钴的配位数为6,C 错误;离子半径越大,晶格能越小,钾离子半径大于钠离子,所以NaN3的晶格能大于KN3的晶格能,D正确.2.下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是(D)A.VSEPR模型可用来预测分子的立体构型B.分子中价电子对相互排斥决定了分子的立体构型C.中心原子上的孤电子对也要占据中心原子周围的空间并参与互相排斥D.分子中键角越大,价电子对相互排斥力越大,分子越稳定解析:分子中键角越大,价电子对相互排斥力越小,分子的能量就越低,分子越稳定,D项不正确.3.下表是元素周期表的一部分。
表中所列的字母分别代表某一种化学元素.下列说法正确的是(C)A.稳定性:A2D〈A2XB.CA3分子的立体结构为平面三角形C.C形成的单质中σ键与π键个数之比为1∶2D.B、C、D形成的气态氢化物互为等电子体解析:根据元素在周期表中的位置可知,A是H、B是C、C 是N、D是O、X是S、Y是Cl。
元素非金属性越强,气态氢化物的稳定性越强,非金属性O>S,所以稳定性H2O〉H2S,故A错.CA3分子为NH3,NH3分子中N原子有3个σ键,一对孤电子对,所以NH3分子的立体结构为三角锥形,故B错。


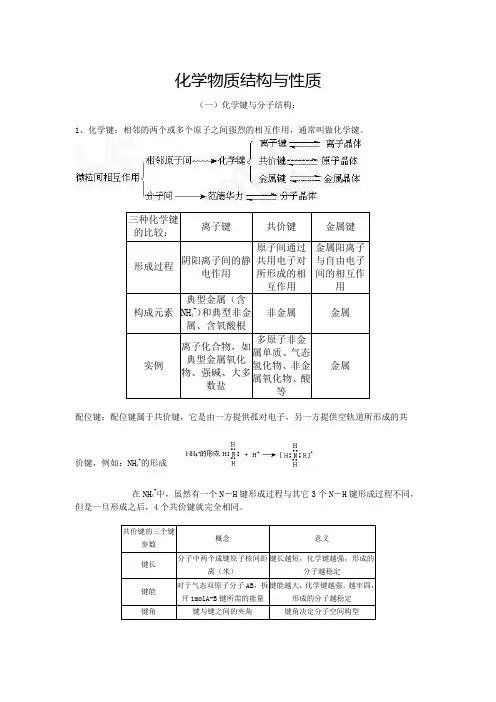
化学物质结构与性质(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键,例如:NH 4+的形成在NH 4+中,虽然有一个N -H 键形成过程与其它3个N -H 键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
键长、键能决定共价键的强弱和分子的稳定性:原子半径越小,键长越短,键能越大,分子越稳定。
共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。
σ键较稳定,而π键一般较不稳定。
共价键具有饱和性和方向性两大特征。
2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。
如CO2、CH2O、CH4等分子中的C原子。
它们的立体结构可用中心原子周围的原子数来预测,概括如下:另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。
因而H2O分子呈V型,NH3分子呈三角锥型。
杂化轨道理论:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
据参与杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化。
杂化轨道理论分析多原子分子(离子)的立体结构价层电子对互斥模型判断简单分子或离子的空间构型说明:(1)等电子原理是指原子总数相同,价电子总数相同的分子或离子,对于主族元素而言,价电子就是其最外层电子数,即为最外层电子总数相等。
这一类分子或离子具有相似的化学键特征、分子结构以及部分物理性质相似,但一般情况下,化学性质并不相似。
同样,化学键相似,并不是指键角等一定相同。
利用等电子原理可判断一些简单分子或离子的主体构型,如:CO2、CNS-、NO2+、N3-的原子总数均为3,价电子总数均为16,因此,它们的空间构型均为直线型。

2020年全国统一高考化学试卷(新课标Ⅰ)一、选择题:本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(6分)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是()A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳2.(6分)紫花前胡醇()可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是()A.分子式为C14H14O4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键3.(6分)下列气体去除杂质的方法中,不能实现目的的是()气体(杂质)方法A.SO2(H2S)通过酸性高锰酸钾溶液B.Cl2(HCl)通过饱和的食盐水C.N2(O2)通过灼热的铜丝网D.NO(NO2)通过氢氧化钠溶液A.A B.B C.C D.D4.(6分)铑的配合物离子(Rh(CO)2I2]﹣可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是()A.CH3COI是反应中间体B.甲醇羰基化反应为CH3OH+CO═CH3CO2HC.反应过程中Rh的成键数目保持不变D.存在反应CH3OH+HI═CH3I+H2O5.(6分)1934年约里奥﹣居里夫妇在核反应中用α粒子(即氦核He )轰击金属原子X ,得到核素Y,开创了人造放射性核素的先河:X+He →Y+n其中元素X、Y的最外层电子数之和为8.下列叙述正确的是()A .X的相对原子质量为26B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸6.(6分)科学家近年发明了一种新型Zn﹣CO2水介质电池。
电池示意图如图,电极为金属锌和选择性催化材料。
放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。

目夺市安危阳光实验学校第二节分子结构与性质1.了解共价键的形式,能用键长、键能、键角等说明简单分子的某些性质。
(中频)2.了解杂化轨道理论及常见的杂化轨道类型(sp、sp 2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构。
(高频)3.了解化学键和分子间作用力的区别。
4.了解氢键的存在对物质性质的影响,能列举含氢键的物质。
(中频)共价键和配位键1.共价键(1)共价键的本质与特征共价键的本质是原子之间形成共用电子对;共价键具有方向性和饱和性的基本特征。
(2)共价键种类根据形成共价键的原子轨道重叠方式可分为σ键和π键。
σ键强度比π键强度大。
(3)键参数①键参数对分子性质的影响②键参数与分子稳定性的关系键能越大,键长越短,分子越稳定。
2.配位键及配合物(1)配位键由一个原子提供一对电子与另一个接受电子的原子形成的共价键。
(2)配位键的表示方法如A→B:A表示提供孤电子对的原子,B表示接受共用电子对的原子。
(3)配位化合物①组成:②形成条件:⎩⎪⎨⎪⎧配位体有孤电子对⎩⎪⎨⎪⎧中性分子:如H2O、NH3和CO等。
离子:如F-、Cl-、CN-等。
中心原子有空轨道:如Fe3+、Cu2+、Zn2+、Ag+等。
分子的立体结构1.用价层电子对互斥理论推测分子的立体构型(1)用价层电子对互斥理论推测分子的立体构型的关键是判断分子中的中心原子上的价层电子对数。
a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数。
(2)价层电子对互斥理论与分子构型:电子对数σ键电子对数孤电子对数电子对空间构型分子空间构型实例2 2 0 直线形直线形CO233 0三角形三角形BF32 1 角形SO244 0四面体形正四面体形CH43 1 三角锥形NH32 2 V形H2O2.用杂化轨道理论推测分子的立体构型杂化类型 杂化轨道数目 杂化轨道间夹角 空间构型 实例 sp 2 180° 直线形 BeCl 2 sp 23 120° 三角形 BF 3 sp 34109°28′四面体形CH 43.等电子原理原子总数相同,价电子总数相同的分子具有相似的化学键特征和立体结构,许多性质相似,如N 2与CO ,O 3与SO 2,N 2O 与CO 2、CH 4与NH +4等。
分子结构与性质1.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是A.分子中每个原子最外层均达到8电子稳定结构B.P4S3中硫元素为-2价,磷元素为+3价C.热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/molD.一个P4S3分子中含有三个非极性共价键【答案】B【解析】A、P原子最外层有5个电子,含3个未成键电子,S原子最外层有6个电子,含2个未成键电子,由P4S3的分子结构可知,每个P形成3个共价键,每个S形成2个共价键,分子中每个原子最外层均达到8电子稳定结构,A正确;B、由P4S3的分子结构可知,1个P为+3价,其它3个P都是+1价,正价总数为+6,而S为-2价,B错误;C、根据燃烧热的概念:1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,则P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H= -3677kJ/mol,C正确;D、由P4S3的分子结构可知,P-P之间的键为非极性键,P-S之间的键为极性键,一个P4S3分子中含有三个非极性共价键,D正确。
2.常温下三氯化氮(NCl3)是一种淡黄色的液体,其分子结构呈三角锥形,以下关于NCl3说法正确的是()A.该物质中N-C1键是非极性键B.NCl3中N原子采用sp2杂化C.该物质是极性分子D.因N-C1键的键能大,所以NCl3的沸点高【答案】C【解析】A、N和Cl是不同的非金属,则N-Cl键属于极性键,故A错误;B、NCl3中N有3个σ键,孤电子对数5312-⨯=1,价层电子对数为4,价层电子对数等于杂化轨道数,即NCl3中N的杂化类型为sp3,故B错误;C、根据B选项分析,NCl3为三角锥形,属于极性分子,故C正确;D、NCl3是分子晶体,NCl3沸点高低与N-Cl键能大小无关,故D错误。
第12章(物质结构与性质)李仕才第二节分子结构与性质考点二分子的立体构型1.用价层电子对互斥理论推测分子的立体构型(1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
(2)价层电子对数的确定方法其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是1个与中心原子结合的原子提供的价电子数,x是与中心原子结合的原子数。
(3)价层电子对互斥模型与分子立体构型的关系2.用杂化轨道理论推测分子的立体构型(1)杂化轨道概念:在外界条件的影响下,原子内部能量相近的原子轨道重新组合的过程叫原子轨道的杂化,组合后形成的一组新的原子轨道,叫杂化原子轨道,简称杂化轨道。
(2)杂化轨道的类型与分子立体构型(3)由杂化轨道数判断中心原子的杂化类型杂化轨道用来形成σ键和容纳孤电子对,所以有公式:杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数。
3.等电子原理原子总数相同,价电子总数相同的粒子具有相似的化学键特征,它们的许多性质相似,如CO和N2。
等电子体的微粒有着相同的分子构型,中心原子也有相同的杂化方式。
常见等电子体与空间构型判断正误(正确的打“√”,错误的打“×”)1.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对。
( √)2.分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构。
( ×)3.NH3分子为三角锥形,N原子发生sp2杂化。
( ×)4.只要分子构型为平面三角形,中心原子均为sp2杂化。
( √)5.中心原子是sp杂化的,其分子构型不一定为直线形。
( ×)6.价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数。
( √)7.中心原子杂化类型相同时,孤电子对数越多,键角越小。
( √)1.杂化轨道只用于形成σ键或者用来容纳孤电子对,剩余的p轨道可以形成π键,即杂化过程中若还有未参与杂化的p轨道,可用于形成π键。
2020高考化学大题专项训练 《物质结构与性质(1)》1.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)气态氟化氢中存在二聚分子(HF)2,这是由于____________。
(2)I 3+属于多卤素阳离子,根据VSEPR 模型推测I 3+的空间构型为____________,中心I 原子的杂化轨道类型为____________。
(3)基态溴原子的电子排布式为____________,碘原子价电子的电子排布图为______________________。
(4)卤素互化物如IBr 、ICl 等与卤素单质结构相似、性质相近。
Cl 2、IBr 、ICl 沸点由高到低的顺序为_____________,I 和Cl 相比,电负性较大的是____________,ICl 中I 元素的化合价为____________。
(5)请推测①HClO 4、②HIO 4、③H 5IO 6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为____________(填序号)。
(6)卤化物RbICl 2加热时会分解为晶格能相对较大的卤化物和卤素互化物,该反应的化学方程式为________________________________。
RbICl 2的晶体结构与CsCl 相似,晶胞边长为685.5pm ,RbICl 2晶胞中含有____________个氯原子,RbICl 2晶体的密度是____________g ⋅cm -3(只要求列算式,不必计算出数值.阿伏伽德罗常数为N A )。
【答案】(1)HF 分子间形成氢键 (2)V 形 sp 3 (3) [Ar]3d 104s 24p 5(4)BrI>ICl>Cl 2 Cl +1 (5)①②③ (6)RbICl 2RbCl+ICl 8-103A283.54(685.510)N ⨯⨯⨯【解析】() 1F 的电负性很大,HF 分子之间形成氢键; 故答案为:HF 分子间形成氢键;()32I +的成键数为2,孤对电子数为()1712122⨯--⨯=,与水相似,则空间构型为V 形,中心I 原子的杂化轨道类型为3sp ;故答案为:V 形;3sp ;()3Br 的原子序数为35,最外层有7个电子,为4s 、4p 电子,则电子排布式为[]1025Ar 3d 4s 4p ,碘原子价电子的电子排布图为;故答案为:[]1025Ar 3d 4s 4p ;;()4分子晶体,相对分子质量越大,沸点越高,则沸点为2BrI ICl Cl >>,氯原子得电子能力强于I ,所以Cl 的电负性大,Cl 显1-价,故I 显1+价; 故答案为:2BrI ICl Cl >>;Cl ;1+;()5含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性Cl I >,则酸性为①②③; 故答案为:①②③;()6根据元素守恒和原子守恒判断产物为RbCl 和ICl ,则反应方程式为2RbICl RbCl ICl +nV;已知氯化钠的晶胞图为:,晶胞中含有4个阳离子和4个阴离子,2RbICl 的晶体结构与NaCl相似,2RbICl 晶胞中含有4个阴离子,则Cl 原子为8个;1个晶胞中含有4个2RbICl ,根据mρV=,所以该晶胞的密度是3103A283.54g cm (685.510)N --⨯⋅⨯⨯; 故答案为:RbICl 2RbCl+ICl ;8;103A283.54(685.510)N -⨯⨯⨯。
2020年⾼中化学⼈教版物质结构与性质第2章《分⼦结构与性质》单元测试卷第2章《分⼦结构与性质》单元测试卷⼀、单选题(共15⼩题)1.下列物质性质的变化规律与分⼦间作⽤⼒⽆关的是()A.在相同条件下,N2在⽔中的溶解度⼩于O2B. HF、HCl、HBr、HI的热稳定性依次减弱C. F2、Cl2、Br2、I2的熔、沸点逐渐升⾼D. CH3CH3、CH3CH2CH3、(CH3)2CHCH3、CH3CH2CH2CH3的沸点逐渐升⾼2.配合物在许多⽅⾯有着⼴泛的应⽤.下列叙述不正确的是()A. CuSO4溶液呈天蓝⾊是因为含有[Cu(H2O)4]2+B.魔术表演中常⽤⼀种含硫氰化铁配离⼦的溶液来代替⾎液C. [Ag(NH3)2]+是化学镀银的有效成分D.除去硝酸银溶液中的Ag+,可向其中逐滴加⼊氨⽔3.下列各组物质中,所有化学键都是共价键的是()A. H2S和Na2O2B. H2O2和CaF2C. NH3和N2D. HNO3和NaCl4.电⼦数相等的微粒叫等电⼦体,下列微粒组是等电⼦体的是()A. N2O4和NO2B. Na+和Cl﹣C. SO42﹣和PO43﹣D. NO和O25.下列有关物质性质、结构的表述均正确,且存在因果关系的是()A.答案AB.答案BC.答案CD.答案D6.向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加⼊⾜量的AgNO3溶液,⽣成氯化银沉淀的物质的量为()A. 0molB. 1molC. 2molD. 3mol7.维⽣素B1可作为辅酶参与糖的代谢,并有保护神经系统的作⽤。
该物质的结构简式如图所⽰,维⽣素B1晶体溶于⽔的过程中要克服的微粒间作⽤⼒有()A.离⼦键、共价键B.离⼦键、氢键、共价键C.氢键、范德华⼒D.离⼦键、氢键、范德华⼒8.下列各种说法中错误的是()A.配位键是⼀种特殊的共价键B. NH4NO3、CuSO4·5H2O都含有配位键C.共价键的形成条件是成键原⼦必须有未成对电⼦D.形成配位键的条件是⼀⽅有空轨道,另⼀⽅有孤电⼦对9.下列微粒中中⼼原⼦的杂化⽅式和微粒的⽴体构型均正确的是()A. C2H4:sp 、平⾯形B. SO:sp3、三⾓锥形C. ClO:sp2、V形D. NO:sp2、平⾯三⾓形10.下列说法正确的是()A.已知N—N键能为193kJ·mol-1,故NN的键能之和为193kJ·mol-1×3B. H—H键能为436.0kJ·mol-1,F—F键能为157kJ·mol-1,故F2⽐H2稳定C.某元素原⼦最外层有1个电⼦,它跟卤素相结合时,所形成的化学键为离⼦键D. N—H键键能为390.8kJ·mol-1,其含义为形成1mol N—H所释放的能量为390.8kJ11.当H原⼦和F原⼦沿z轴结合成HF分⼦时,F原⼦中和H原⼦对称性不⼀致的轨道是() A. 1sB. 2sC. 2p xD. 2p z12.某些化学键的键能如表所⽰:下列有关说法中正确的是()A. 1 mol H2(g)分别与Cl2(g)、Br2(g)、I2(g)反应,则与碘完全反应放出的热量最多B. H—F键的键能⼤于431 kJ·mol-1C. H2与Cl2反应的热化学⽅程式为H2(g)+Cl2(g)===2HCl(g)ΔH=-248 kJ·mol-1D.稳定性最强的化学键是H—Cl键13.与NO3¯互为等电⼦体的是()A. SO3B. PCl3C. CH4D. NO214.从键长的⾓度来判断下列共价键中最稳定的是()A. H—FB. N—HC. C—HD. S—H15.下列物质中,既含有极性键⼜含有⾮极性键的是()A. CO2B. CH4C. C2H4D. NH4Cl⼆、填空题(共3⼩题)16.有以下物质:①HF,①Cl2,①H2O,①N2,①C2H4,①C2H6,①H2,①H2O2,①HCN(H—C≡N)。
晶体结构与性质1.硫和锌及其化合物用途广泛。
回答下列问题:(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:电离能/kJ·mol1I1I2Cu 746 1958Zn 906 1733由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。
H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩()广泛应用于合成医药、农药、染料工业。
π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的①噻吩分子中的大π键可用符号nmπ,则噻吩分子中的大π键应表示为______________。
电子数(如苯分子中的大π键可表示为66②噻吩的沸点为84 ℃,吡咯()的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。
1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
已知:硫化锌晶体密度为d g·cm-3,N A代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
2.下图表示一些晶体中的某些结构,请回答下列问题:(1)代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与_____个碳原子最近且距离相等。
(2)代表石墨的是_____,每个正六边形占有的碳原子数平均为_____个。
(3)代表NaCl 的是_________,每个Na+周围与它最近且距离相等的Cl-有_____个。
高考化学专题复习《分子结构与性质》测试卷-带答案学校:___________班级:___________姓名:___________考号:___________题组一共价键的类别及判断1.下列说法中不正确的是()A.π键是由两个原子的p轨道“肩并肩”重叠形成的B.CH4中的4个C—H键都是H的1s轨道与C的sp3杂化轨道形成的s-sp3 σ 键C.C2H2分子中σ键与π键个数比为1∶1D.H3O+、NH4+、[Cu(NH3)4]2+均含有配位键2.下列十种物质:①CH4②CH3CH2OH③N2④HCl⑤CO2⑥CH3CH3⑦C2H4⑧C2H2⑨H2O2⑩HCHO请按要求回答下列问题(填写编号):(1)只有σ键的有,既有σ键又有π键的有。
(2)只含有极性键的化合物有,既含有极性键,又含有非极性键的化合物有。
(3)含有双键的有,含有三键的有。
3、正误判断(正确打“√”,错误打“×”)。
(1)在任何情况下σ键都比π键强度大。
()(2)共价键的成键原子只能是非金属原子。
()(3)σ键和π键都可以绕键轴旋转。
()(4)碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍。
()(5)SO2-4与CCl4互为等电子体。
()题组二键参数及应用1.下列说法中正确的是()A.分子的键长越长,键能越低,分子越稳定B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键C.水分子可表示为H—O—H,分子的键角为180°D.H—O键键能为462.8 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ2.已知几种共价键的键能如下:化学键H—N N≡N Cl—Cl H—Cl键能/kJ·mol-390.8946242.7431.81下列说法错误的是()A.键能:N≡N>N===N>N—NB.H(g)+Cl(g)===HCl(g)ΔH=-431.8 kJ·mol-1C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g)ΔH=-463.9 kJ·mol-1题组三分子(或离子)中大π键的理解与判断1.中的大π键应表示为,其中碳原子的杂化方式为。
分子结构与性质1.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是A.分子中每个原子最外层均达到8电子稳定结构B.P4S3中硫元素为-2价,磷元素为+3价C.热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/molD.一个P4S3分子中含有三个非极性共价键【答案】B【解析】A、P原子最外层有5个电子,含3个未成键电子,S原子最外层有6个电子,含2个未成键电子,由P4S3的分子结构可知,每个P形成3个共价键,每个S形成2个共价键,分子中每个原子最外层均达到8电子稳定结构,A正确;B、由P4S3的分子结构可知,1个P为+3价,其它3个P都是+1价,正价总数为+6,而S为-2价,B错误;C、根据燃烧热的概念:1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,则P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H= -3677kJ/mol,C正确;D、由P4S3的分子结构可知,P-P之间的键为非极性键,P-S之间的键为极性键,一个P4S3分子中含有三个非极性共价键,D正确。
2.常温下三氯化氮(NCl3)是一种淡黄色的液体,其分子结构呈三角锥形,以下关于NCl3说法正确的是()A.该物质中N-C1键是非极性键B.NCl3中N原子采用sp2杂化C.该物质是极性分子D.因N-C1键的键能大,所以NCl3的沸点高【答案】C【解析】A、N和Cl是不同的非金属,则N-Cl键属于极性键,故A错误;B、NCl3中N有3个σ键,孤电子对数5312-⨯=1,价层电子对数为4,价层电子对数等于杂化轨道数,即NCl3中N的杂化类型为sp3,故B错误;C、根据B选项分析,NCl3为三角锥形,属于极性分子,故C正确;D、NCl3是分子晶体,NCl3沸点高低与N-Cl键能大小无关,故D错误。
3.二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点80℃,沸点135.6℃,对干二氯化二硫叙述正确的是A.二氯化二硫的电子式为B.分子中既有极性键又有非极性键C.二氯化二硫属于非极性分子D.分子中S-Cl键能小于S-S键的键能【答案】B【解析】A.S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,结合分子结构可知S2Cl2的结构式为Cl-S-S-Cl,电子式为,故A错误;B.S2Cl2中Cl-S属于极性键,S-S键属于非极性键,不对称的结构,为极性分子,故B正确;C.分子的结构不对称,为极性分子,而不是非极性分子,故C错误;D.同周期从左往右原子半径逐渐减小,所以氯原子半径小于硫原子半径,键长越短键能越大,所以分子中S-Cl键能大于S-S键的键能,故D错误。
4.下列说法正确的是()A.P4和CH4都是正四面体分子且键角都为109º28´B.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键C.乙醇分子与水分子之间只存在范德华力D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4【答案】B【解析】A项、P4是正四面体分子,键角为60°;CH4是正四面体分子,键角为109°28′,故A错误;B项、H2O分子之间能形成氢键,H2S分子之间不能形成氢键,H2O分子之间分子间作用力大于H2S,则H2O的熔点、沸点大于H2S,故B正确;C项、乙醇分子与水分子之间存在氢键和范德华力,故C错误;D项、含氧酸的非羟基氧原子个数越多,酸性越强,则氯的各种含氧酸的酸性由强到弱排列为HClO4>HClO3>HClO2>HClO,故D错误。
5.氮化硼(BN)晶体有多种结构,六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,有白色石墨之称,具有电绝缘性,可作高温润滑剂。
立方相氮化硼是超硬材料,硬度可媲美钻石,常被用作磨料和刀具材料。
它们的晶体结构如图所示,关于两种晶体的说法,错误的是A .六方相氮化硼属于混合晶体,其层间是靠范德华力维系,所以质地软B .立方相氮化硼含有σ键和π键,所以硬度大C .六方氮化硼不能导电是因为其层结构中没有自由电子D .相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同【答案】B【解析】A. 六方相氮化硼与石墨晶体相同,属于混合晶体,其层间是靠范德华力维系,所以质地软,A 正确;B. 立方相氮化硼含有共价键和配位键,为σ键,所以硬度大,B 错误;C. 石墨层内导电是由于层内碳原子形成大π键,有自由移动的电子,而六方氮化硼不能导电是因为其层结构中没有自由电子,C 正确;D. 六方相氮化硼中每个原子合1.5条键,而立方相氮化硼中每个原子合2条键,则相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同,D 正确。
6.过氧化氢(22H O )俗称双氧水,其分子结构如图所示。
医疗上常用3%的双氧水进行伤口或中耳炎消毒。
过氧化氢能与2SO 反应生成24H SO .下列有关过氧化氢的说法中错误的是( )A .22H O 的结构式为H O O H ———B .过氧化氢与2SO 的化合反应,不是氧化还原反应C .22H O 为既含有极性键又含有非极性键的共价化合物D .过氧化氢与2SO 反应的离子方程式为+2-2224SO +H O 2H +SO =【答案】B【解析】A. 22H O 的结构式为H O O H ———,故A 正确;B. 2SO 中S 为+4价,24H SO 中的S 是+6价,22H O 中,O 为-1价,产物24H SO 中O 为-2价,2SO 被22H O 氧化,化合价发生了变化,是氧化还原反应,故B 错误;C. 22H O 是共价化合物,其中H O —是极性键,O O —是非极性键,故C 正确;D. 24H SO 是强电解质,所以离子方程式:+2-2224SO +H O 2H +SO =,故D 正确。
7.下列说法正确的是 ( )A .由于分子间作用力依次增大,所以热稳定性:NH 3<H 2O <HFB .离子晶体中可能存在共价键,分子晶体中不一定存在共价键C .BeCl 2熔点较低,易升华,可溶于醇和醚,由此可推测BeCl 2晶体属于原子晶体D .NH 3和CCl 4中每个原子的最外层都具有8电子稳定结构【答案】B【解析】A. 由于N 、O 、F 的非金属性逐渐增强,所以气态氢化物稳定性NH 3<H 2O <HF ,热稳定性与分子间作用力无关,故A 错误;B. 离子晶体中可能存在共价键,如NaOH 等,分子晶体中不一定存在共价键;如稀有气体单质,属于分子晶体,没有共价键,故B 正确;C. 原子晶体的熔沸点高,硬度较大,分子晶体熔沸点较低,BeCl 2熔点较低,易升华,可溶于醇和醚,由此可推测BeCl 2晶体属于分子晶体,故C 错误;D. NH 3中的H 原子最外层有两个电子,不符合每个原子的最外层都具有8电子稳定结构,故D 错误。
8.下列有关微粒间作用力的说法正确的是A .硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B 原子发生的是sp 3杂化,不同层分子间主要作用力是范德华力B .金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性C .干冰气化和冰融化克服的分子间作用力相同D .离子晶体熔融状态电离过程中,只有离子键被破坏【答案】D【解析】A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中心原子B 原子只形成3个σ键,没有孤电子对,故其杂化方式为sp 2杂化,不同层分子间主要作用力是范德华力,A 错误;B. 在金属晶体中,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,故金属键无方向性和饱和性,B 错误;C. 干冰和冰都属于分子晶体,但是冰中含有氢键,所以干冰气化只需要克服分子间作用力,冰融化要克服分子间作用力和氢键,C 错误;D. 离子晶体熔融状态电离过程中,只有离子键被破坏,比如NaHSO 4在熔融状态下的电离方程式为:+-44NaHSO Na +HSO (熔融),D 正确。
9.下列说法中错误..的是 A .从CH 4、NH 4+、SO 42-为正四面体结构,可推测PH 4+、PO 43-也为正四面体结构B .1 mol 金刚石晶体中,平均含有2 molC —C 键C .水的沸点比硫化氢的高,是因为H 2O 分子间存在氢键,H 2S 分子间不能形成氢键D .某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF 或FE【答案】D【解析】A.PH4+、PO43-中都形成4个σ键,且孤电子对数分别为0,则应为正四面体结构,选项A正确;B.金刚石晶体中,每个C原子与其它4个C原子形成共价键,且每2个C原子形成1个共价键,则1 mol金刚石晶体中,平均含有4mol×12=2 molC-C键,选项B正确;C.氢键的作用力大于分子间作用力,H2O分子间存在氢键,H2S分子间不能形成氢键,导致水的沸点比硫化氢的高,选项C正确;D.团簇分子中含有4个E、4个F原子,分子式应为E4F4或F4E4,选项D错误。
10.下列中心原子的杂化轨道类型和分子几何构型不正确...的是A.CCl4中C原子sp3杂化,为正四面体形B.H2S分子中,S为sp2杂化,为直线形C.CS2中C原子sp杂化,为直线形D.BF3中B原子sp2杂化,为平面三角形【答案】B【解析】A.CCl4中C原子形成4个σ键,孤对电子数为0,则为sp3杂化,为正四面体形,故A正确;B.H2S分子中,S原子形成2个σ键,孤对电子数为6212-⨯=2,则为sp3杂化,为V形,故B错误;C.CS2中C原子形成2个σ键,孤对电子数为4222-⨯=0,则为sp杂化,为直线形,故C正确;D.BF3中B原子形成3个σ键,孤对电子数为3312-⨯=0,则为sp2杂化,为平面三角形,故D正确。
11.根据价层电子对互斥理论填空:(1)OF2分子中,中心原子上的σ键电子对数为___,孤电子对数为___,价层电子对数为___,中心原子的杂化方式为___杂化,VSEPR构型为____________,分子的立体构型为___________。
(2)BF3分子中,中心原子上的σ键电子对数为___,孤电子对数为___,价层电子对数为___,中心原子的杂化方式为___杂化,VSEPR构型为____________,分子的立体构型为___________。
(3)SO42-分子中,中心原子上的σ键电子对数为___,孤电子对数为___,价层电子对数为___,中心原子的杂化方式为___杂化,VSEPR构型为____________,分子的立体构型为___________。