一般溶液的配制方法课件
- 格式:ppt
- 大小:1.67 MB
- 文档页数:58



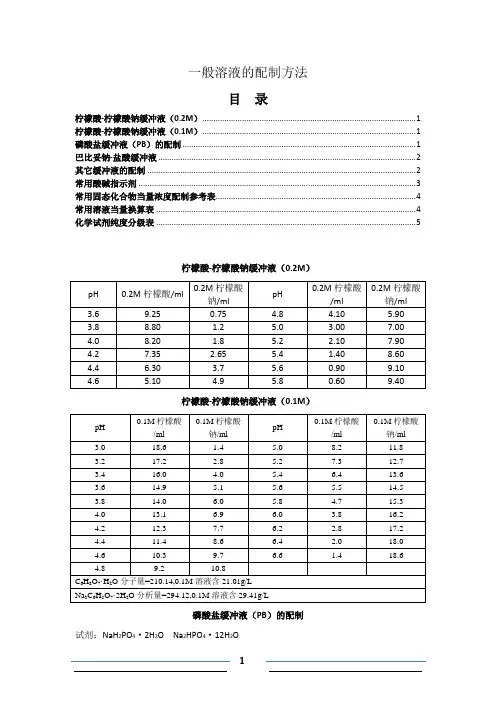
一般溶液的配制方法目录柠檬酸-柠檬酸钠缓冲液(0.2M) (1)柠檬酸-柠檬酸钠缓冲液(0.1M) (1)磷酸盐缓冲液(PB)的配制 (1)巴比妥钠-盐酸缓冲液 (2)其它缓冲液的配制 (2)常用酸碱指示剂 (3)常用固态化合物当量浓度配制参考表 (4)常用溶液当量换算表 (4)化学试剂纯度分级表 (5)柠檬酸-柠檬酸钠缓冲液(0.2M)柠檬酸-柠檬酸钠缓冲液(0.1M)磷酸盐缓冲液(PB)的配制试剂:NaH2PO4·2H2O Na2HPO4·12H2O配制方法:配制时,常先配制0.2mol/L的NaH2PO4和0.2mol/L的Na2HPO4,两者按一定比例混合即成0.2mol/L的磷酸盐缓冲液(PB),根据需要可配制不同浓度的PB和PBS。
(1)0.2mol/L的Na2HPO4:称取Na2HPO4·12H2O 31.2g(或Na2HPO4·H2O 27.6g)加重蒸水至1000ml溶解。
(2)0.2mol/L的NaH2PO4:称取NaH2PO4·12H2O 71.632g(NaH2PO4·7H2O 53.6g或NaH2PO4·2H2O 35.6g)加重蒸水至1000ml溶解。
(3)0.2mol/L pH7.4的PB的配制:取19ml 0.2mol/L的NaH2PO4和81ml 0.2mol/L的Na2HPO4·12H2O,充分混合即为0.2mol/L的PB(pH约为7.4~7.5)。
巴比妥钠-盐酸缓冲液其它缓冲液的配制常用酸碱指示剂常用固态化合物当量浓度配制参考表常用溶液当量换算表量数/化学试剂纯度分级表。







实验二、一般溶液的配制【实验目的】1、学会台秤以及量筒等的使用方法;2、掌握一般溶液的配制方法和基本操作。
【实验原理】在化学实验中,常常需要配制各种溶液来满足不同实验成绩的要求。
如果实验对溶液浓度的准确性要求不高,一般利用台秤、量筒、带刻度烧杯等低准确度的仪器配制就能满足需要。
如果实验对溶液浓度的准确性要求较高,如定量分析实验,这就需要使用分析天平、移液管、容量瓶等高准确度的仪器配制溶液。
对于易水解的物质,在配制溶液时还要考虑先用相应的酸溶解易水解的物质,再加水稀释。
无论是粗配还是准确配制一定体积、一定浓度的溶液,首先要计算所需试剂的用量,包括固体试剂的质量或液体试剂的体积(称量或量取),然后再进行配制。
不同浓度的溶液在配制时的具体计算及配制步骤如下。
一、固体试剂配制溶液1. 质量分数(百分浓度)因为 m X m =溶质溶液所以 X1V X X 1X -=-=溶剂溶剂溶剂溶质ρm m如果溶剂为水(3.98℃时,ρ溶剂=1.0000g·mL-1)1X VmX⋅=-溶剂溶质式中X:溶质质量分数;m溶质:固体试剂的质量;m溶剂:溶剂质量;V溶剂:溶剂体积;ρ溶剂:溶剂的密度。
计算出配制一定质量分数的溶液所需固体试剂质量,用台秤称取,倒入烧杯,再用量筒取所需去离子水倒入烧杯,搅动,使固体完全溶解即得所需溶液,将溶液倒入试剂瓶中,贴上标签备用。
2. 物质的量浓度(摩尔浓度)m溶质= c.V.M式中C:物质的量浓度,单位为mol·L-1;V:溶液体积,单位为L;M:固体试剂摩尔质量,单位为g·mol-1(1)粗略配制算出配制一定体积溶液所需固体试剂的质量,用台秤称取所需试剂,倒入带刻度烧杯中,加入少量去离子水搅动使固体全部溶解,用去离子水稀释至刻度,即得所需溶液。
然后将溶液移入试剂瓶中,贴上标签,备用。
*(2)准确配制算出配制一定体积准确浓度溶液所需固体试剂的质量。
并在分析天平上准确称出它的质量,放在干净的小烧杯中,加适量去离子水搅动使固体全部溶解。
溶液配制讲义培训目标:1.了解溶液及化学试剂的基本知识。
2.掌握溶液配制和溶液保存的方法。
3.了解溶液配制的注意事项。
4.通过培训,可以配制一些常用的溶液。
一.溶液的基本知识1.溶液的定义溶液:一种以分子、原子或离子分散于另一种物质的均匀而又稳定的体系叫做溶液。
溶液由溶质和溶剂组成。
溶剂:用来溶解别物质的物质叫做溶剂;溶质:能被溶剂溶解的物质叫做溶质。
溶液中的溶质和溶剂的规定没有绝对的界限,只有相对的意义。
通常把单独存在和组成溶液状态相同的时的物质叫做溶剂。
2.溶解过程溶解:在一定的温度下,将固体物质放在水中,溶质表面的分子或离子由于本身的运动和受到水分子的吸引,克服固体分子间的引力,逐渐分散到水中,这个过程叫做溶解。
结晶:在溶解的过程的同时,还进行着一个相反的过程,即已溶解的溶质粒子不断的运动,与未溶解的溶质碰撞,重新被吸引到固体表面上,这个过程叫做结晶。
饱和状态:当溶解速度等于结晶速度时,溶液的浓度不再增加,存在着一个动态平衡,这种状态叫做饱和状态。
饱和溶液:在一定条件下达到饱和状态的溶液叫做饱和溶液,还能继续溶解溶质的溶液叫做不饱和溶液。
溶解过程是一个物理-化学过程,而不是一个机械混合过程。
加速溶解的办法:研细溶质、搅拌、振和加热溶液。
3.溶解度溶解度:在一定的温度下,某种物质在100克溶剂中达到溶解平衡状态时所溶解的克数。
相似相溶规律:物质易溶于性质相似的物质之中。
如:极性物质易溶于极性溶剂,非极性溶质易溶于非极性溶剂中。
影响物质溶解度的因数很多,其中温度的影响较大,大多数固体物质的溶剂溶解度随温度升高而增加。
易溶物质:溶解度在10克以上;可溶物质:溶解度在1-10克;微溶及难溶物质:溶解度在1克以下。
配制饱和溶液的方法:查阅溶解度表,得知该物质在室温下的溶解度,称取稍过量的溶质,配制溶液,在溶解达到平衡后,在溶液中保持过量未溶解的溶质固体。
二.化学试剂进行溶液配制,要先了解相关的化学试剂。