氧气的制法
- 格式:ppt
- 大小:363.00 KB
- 文档页数:22

§ 2·5 氧气的制法在空气里虽然含有相当多的氧气,但工业上或者实验室里,往往都需用纯粹的氧气。
因此,我们有必要研究制取纯氧的方法。
自然界里的哪些物质可以用作制造氧气的原料呢?前面讲过,氧在自然界里,既有以游离态存在的(单质的氧气,主要存在在空气里),也有以化合态存在在各种含氧化合物里的。
这些含有氧元素(游离态或化合态)的物质,都有可能用作制造氧气的原料。
由于所用原料的不同,制取氧气就有两类不同的方法。
第一类方法是以空气为原料,通过物理的方法,把氧气从空气里分离出来。
第二类方法是以含氧化合物为原料,通过化学反应,使其中所含的氧游离出来,成为单质的氧气。
第一类方法需用的装置比较复杂,但原料(空气)可以随处取得,成本少,适宜于工业上大量生产氧气;第二类方法的操作比较方便,适宜于实验室里制取少量氧气。
下面我们分别来介绍。
氧气的实验室制法实验室里制取氧气是用含氧化合物为原料的。
这些含氧化合物,必须具备下面两个条件:第一,这种含氧化合物是较不稳定的,在加热时容易分解放出氧气;第二,这种含氧化合物里含氧的百分比是比较高的,能分解放出较多的氧气。
在实验室里最常用的,符合于这两个条件的含氧化合物是氯酸钾(分子式是KClO3),它含氧的百分比比较高(达40%左右),而且在不太高的温度下就能分解放出氧气。
用氯酸钾制取氧气的方法是:先把固体氯酸钾放在试管里,加热(图2·7(a)),不久,氯酸钾固体开始熔化(氯酸钾的熔点是357℃),但这时还不分解放出氧气,继续加热到大约400℃时,就有氧气气泡从熔化的氯酸钾里缓慢地放出。
这时如果用一根带有余烬的木条放在管口,木条就会燃烧起来。
这一反应可以用下面的式子表示:这是一个分解反应,反应时由一种物质变成两种新物质(氯化钾和氧气)。
氯酸钾里的氧是化合态的,当它分解出来后,就转变成游离态的氧气了。
如果我们在熔化的氯酸钾里加入少量黑色的二氧化锰(MnO2)粉末,氯酸钾会迅速分解,有多量的氧气放出(图2·7(b))。

初三化学《制取氧气》知识点总结氧气的制法 (重难点 )(1)实验室制法①原理: 2KMn04= 加热 = 2K2MnO4+MnO2+O2↑ (a)2KClO3 = MnO2 /加热=2KCl+3 O2↑ (b)2H202 =MnO2=2H20+2O2↑ (c)②发生装置的选择选择发生装置的依照是:反应物的状态和反应条件等。
若采纳原理 (a)或 (b)的反应 ,则采纳典型的固体与固体反应且需要加热型的装置。
若采纳原理 (c)的反应 ,则采纳典型的固体与液体反应且不需要加热型的装置。
③收集方法及检验、验满、存放a.气体的收集方法是跟气体的性质亲近相关的。
选择气体收集方法的依照是:该气体的水溶性、密度以及该气体可否拥有毒性,可否与空气或水反应等。
排水法:适用于难溶于水、或不易溶于水、且不与水发生化学反应的气体。
此法收集的气体较为纯净,但含有水蒸气。
向上排空气法:适用于相同状况下,密度比空气大且不与空气中任何成发散生反应的气体。
操作时应注意将导管口伸到凑近集气瓶瓶底处,便于将集气瓶内的空气排尽。
同时,应在集气瓶的瓶口处盖上玻璃片,以便牢固气流。
此法收集的气体较为干燥,但纯度较低。
向下排空气法:适用于相同状况下,密度比空气小且不与空气中任何成发散生反应的气体。
操作时应注意将导管口伸到凑近集气瓶底处,便于将集气瓶内的空气排尽。
此法收集的气体较为干燥,但纯度较低。
由于氧气不易溶于水,且不与水反应,所以能够用排水法收集;又由于氧气的密度比空气略大,且不与空气中任何成发散生反应,所以还可以够用向上排空气法收集。
用排水法收集的氧气比较纯净,而用向上排空气法收集的氧气比较干燥。
b.检验:将带火星的木条伸人集气瓶中,若木条复燃 ,证明该气体是氧气c.验满和存放:用排水法收集气体时,当有气泡从集气瓶口边缘冒出时,表示气体已收集满。
用向上排空气法收集氧气时,将带火星的木条放在集气瓶瓶口,若木条复燃,表示气体已收集满。
收集满氧气的集气瓶要用玻璃片遮住并正放在桌面上。

九年级化学教案氧气的制法9篇氧气的制法 1[教学目标]:1.了解实验室制取氧气的主要方法和原理,初步学会通过化学实验制取新物质的方法。
2.认识催化剂、催化作用及分解反应。
3.练习连接仪器的基本操作,动手制取氧气并试验氧气的性质。
[教学重点]:氧气的制法及实验操作。
[教学难点]:催化剂的概念[教学时数]:2课时第一课时复习提问:现有一瓶无色气体,怎样证明这瓶气体是不是氧气?氧气有哪些性质和用途?引入课题:氧气这么重要,如何制取氧气呢?探讨:你知道怎样制取氧气?试想一想要得到大量氧气,可以以什么为原料?阅读:P38-39,大量制取氧气要考虑哪些因素?有哪些方法?这些方法在过程中是发生了什么变化?这些方法能否用于实验室中制取氧气?为什么?实验室采用什么方法制取氧气较好呢?设问:如何挑选原材料?实验探究:过氧化氢在什么条件会产生氧气?学生填写表格并汇报:实验现象原因1.2.3.讨论:如何使上述实验2检验出氧气?通过上述三个实验你认为哪个方法比较适合用于实验室制氧气?为什么?设疑:二氧化锰在反应中起什么作用?阅读:P35催化剂、催化作用提问:怎样将上述实验中发生的化学反应表达出来?试写出文字表达式。
讲解:高锰酸钾也可通过化学反应制得氧气?演示:加热高锰酸钾并用带火星的木条检验?板书:写出反应的文字表达式讨论:这三个化学反应是否是化合反应呢?为什么?它们有没有相似的地方?小结:分解反应类型提问:它们与化合反应有什么区别?反应类型反应物生成物化合反应分解反应课堂小结:学习完本节课后你有什么收获?巩固练习:P40 1 、 2第二课时复习提问:实验室制取氧气一般用的是什么药品?其反应原理的文字表达式怎样书写?设问:如果以高锰酸钾为原料制取氧气,你会用到什么仪器?这些仪器如何组装成装置?活动与探究:1.学生观察图2-17制取氧气的装置图,回答下列问题:⑴. 图中使用了哪些仪器?与你的设计相同吗?⑵. 哪部分是发生装置?哪部分是收集装置?⑶. 在安装装置时应注意哪些问题?为什么?2.如何实现制取氧气呢?(制取氧气的操作步骤)⑴. 制取气体的装置如果漏气,会不会影响实验?如何解决?⑵. 加热固体药品,应注意哪些方面?⑶. 结束制取氧气实验时,应怎样操作?⑷. 小结加热高锰酸钾制取氧气的操作步骤。

氧气的性质、氧气的制法以及氧气的用途氧气是一种无色、无味、无臭、易挥发的气体,在自然界中,氧气占据了空气总量的21%,是地球上生命活动必备的基本物质之一。
氧气的性质物理性质氧气纯度高达99.5%以上的时候为无色、无味、无臭、惰性气体,不易燃烧,具有较高的溶解度和活性。
化学性质氧气具有很强的氧化性,能和其他元素发生化学反应。
在常温下,氧气能与很多元素直接反应,如金属、非金属、碳、硫、磷等元素,许多化学反应都需要氧气参与。
氧气的制法氧气的制法主要分为物理制法和化学制法两种。
物理制法物理制法主要是利用低温分离空气中的氧气。
一般采用的方法为普通空分法、低温空分法、氩渗透分离法、氧分子筛吸附法等。
化学制法化学制法主要是通过化学反应将氧化合物分离出氧气。
这种方法对于高要求的氧气比较常用,比如医用氧气。
氧气的用途氧气的应用非常广泛,常见的应用领域有:医疗行业氧气常用于医疗、急救等领域。
医疗用氧气通常纯度为99.5%以上,可以用于缓解呼吸急促、呼吸困难等症状,同时也广泛用于麻醉、手术等领域。
工业行业氧气在工业生产中也有广泛的应用,其中主要应用领域有:金属切割、氧化铜铁、制氧化剂、混凝土氧化,以及制取二氧化钛等。
生活领域氧气在生活领域也有一些应用,比如许多人在进行户外运动时都会携带氧气瓶,以便应对突发氧气不足的情况。
同时,氧气也可以用于给鱼类增氧,保证水质清洁、水生环境健康。
综上所述,氧气不仅是地球生命所需的基本物质,而且在医疗、工业、生活领域中都有着广泛的应用。
随着时代的变迁,氧气的应用范围也将会不断扩大和创新。

氧气性质及其制法知识点总结
氧气,也称为氧,是一种常见的气体,化学式为O2、它是地球大气中的主要组分,占据了大气的约21%。
氧气在许多物质的燃烧和许多生物过程中都起着重要的作用。
氧气的性质:
1.密度:氧气的密度约为1.429克/升,在常温和常压下,它是无色无味的气体。
2.溶解性:氧气可以溶解在水中,溶解度随温度的升高而减小。
在0摄氏度下,氧气在水中的溶解度约为4.89升/升。
3.反应性:氧气是一种高度活性的气体,在大多数物质的燃烧过程中都起着重要作用。
它可以与其他元素形成氧化物,如与金属结合形成金属氧化物。
氧气的制法:
1.分馏法:氧气可以通过空气的分馏得到。
分馏是根据不同气体的沸点来进行的,因为氧气的沸点约为-183℃,而其他成分的沸点较高。
通过冷却空气并逐渐升温,可以将氧气从空气中分离出来。
2.氧化法:氧气可以通过物质的氧化反应来制取。
例如,将氢过氧化物或过氧化银等氧化剂与对应的还原剂反应,可以释放出氧气。
这种方法通常用于实验室制取小量的氧气。
3.电解水法:氧气还可以通过电解水来制取。
将水加入到电解槽中,通过通电使水分解,可以得到氧气和氢气。
这是一种可靠且经济的制氧方法。
总结:
氧气是一种重要的气体,具有许多特性和用途。
它可以通过分馏、氧化反应以及电解水等方法来制取。
氧气不仅在工业生产中很有用,还在医疗、气候调节等方面起着重要作用。
了解氧气的性质和制备方法有助于我们更好地理解和应用这种气体。
、收集氧气的方法或。
⑤收集满氧气的集气瓶在桌子上。
7、检验氧气的方法。
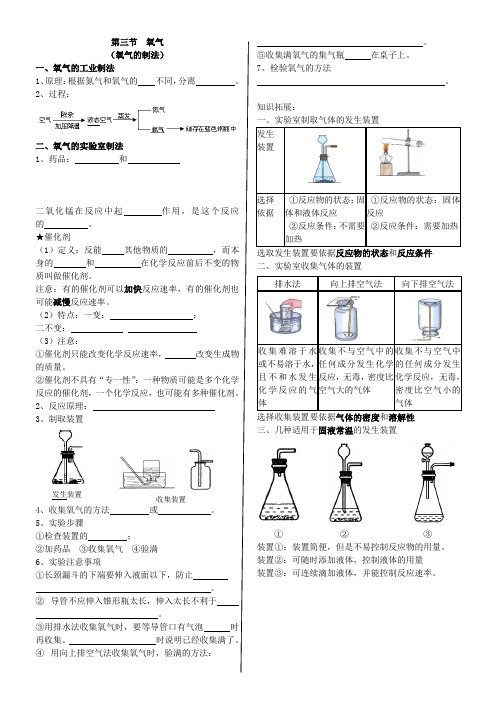
知识拓展:
①反应物的状态:
体和液体反应
②反应条件:不需要
①反应物的状态:固体
反应
选取发生装置要依据反应物的状态和反应条件
二、实验室收集气体的装置
选择收集装置要依据气体的密度和溶解性
三、几种适用于固液常温的发生装置
①②③
装置①:装置简便,但是不易控制反应物的用量。
装置②:可随时添加液体,控制液体的用量
装置③:可连续滴加液体,并能控制反应速率。
收集难溶于
或不易溶于水,
收集不与空气中的
任何成分发生化学
反应,无毒,
收集不与空气中
的任何成分发生
化学反应,无毒,
发生装置
收集装置。
氧气的制法和氧气的性质一、氧气的制法氧气的制法可以分为物理的和化学的两种方法。
1. 物理法制氧物理法制氧主要是通过空气压缩机将空气压缩,使其中的氧气浓度增加,然后将氧气分离出来。
下面是具体的步骤:a、将空气通过进气管输送到空气压缩机中;b、空气压缩机将压缩器空气压缩到10-12atm;c、经过压缩的气体经过冷却,在润滑油分离器中将液态润滑油分离出来;d、将含有氧气的气体进入吸附器,并在毛细孔表面吸附,分离出氧气;e、通过再压缩,加热,干燥等工序,将氧气净化和增压至所需压力。
2. 化学法制氧化学法制氧是利用某些物质或化学反应来制造氧气。
下面是常见的两种化学法制氧的方法:a、过氧化氢法过氧化氢是一种含有氧气的化合物,是通过将氢氧化物和过氧化固源反应得到。
具体步骤如下:H2O2 + MnO2 → O2 + MnO(OH)2b、氧化钾法氧化钾法是一种利用氧化钾或双氧水来制造氧气的方法。
具体步骤如下:2KClO3 → 2KCl + 3O2二、氧气的性质1. 物理性质氧气是一种无色,无味,无臭的气体,密度为1.429 g/L。
在常温和常压下,氧气是一种二原子分子,其分子式为O2。
氧气的熔点为-218.79℃,沸点为-182.962℃。
与其他气体相比,氧气在空气中的溶解度较低。
2. 化学性质氧气具有强氧化性,是一种强烈的氧化剂。
它可以与大部分金属形成金属氧化物,同时也可以氧化非金属物质。
在高能环境下,氧气可以参与许多化学反应,例如燃烧、爆炸等。
在火焰中,氧气是燃料燃烧的必需品。
氧气还可以发生氧化还原反应,如:Zn + O2 → ZnO3. 生物性质对于生物体来说,氧气是必不可少的。
氧气可以直接参与人体的呼吸过程,同时还可以驱动许多重要的生化反应,例如细胞的产能等。
但是,如果氧气摄入过度,也会对身体产生危害。
氧化作用过强会导致人体损伤,促进衰老,引起疾病。
总之,氧气是一种重要的物质。
它可以通过多种方法制造,具有许多重要的物理和化学性质,同时对生物体起着重要的作用。
氧气性质及其制法知识点总结氧气是一种无色、无味、无臭的气体,也是地球上最常见的元素之一,它占据了地球大气中的21%。
人们对氧气的认识和应用可以追溯至17世纪末,当时瑞典化学家卡尔·威廉·谷神父通过加热石灰石得到了一种叫做氧气的气体。
如今,氧气被广泛用于鼓舞人心、舒缓呼吸急促、促进人体代谢等医疗保健行业,同时也应用于其他众多领域,如矿业、制药、化工、环保等。
下面,我们将通过对氧气的性质及制法知识点进行总结,来了解更多关于氧气的知识。
一、氧气的性质1.物理性质氧气为无色、无味、无臭的气体,密度为1.429 g/L,比空气稍重(空气密度为1.29 g/L),在常温常压下不溶于水。
2.化学性质氧气是一种极活泼的元素,属于氧族元素,可与大多数元素发生反应,特别是非金属元素,如氢、氮、碳、硫等。
其主要的化学性质如下:(1)易于与非金属元素形成氧化物,如氢氧化物、酸等;(2)对于某些金属元素具有强氧化性,可与金属形成金属氧化物;(3)具有强的燃烧性,能与许多物质反应并放出大量热能,如描火、烟火等。
二、氧气的制法1. 通过空气分离法制取氧气空气中的气体主要由氧气和氮气组成,其中氧气占空气体积的21%,氮气占78%。
但空气中还含有其他气体,如烟雾、水蒸气、氩气等。
通过空气分离法可以将氧气从空气中分离出来。
该方法将空气吸入普通压力下进行初步洗涤和预冷处理后,通过吸附剂得到液态空气,再将其加压后通过各种温度条件下的精馏分离,从而得到氧气和氮气。
氧气的纯度可以达到99%以上,若要制取更高纯度的氧气,还需进一步加工。
2. 通过化学反应制取氧气(1)过氧化氢分解法过氧化氢分解时可以反应出氧气。
2H2O2 → 2H2O + O2(2)氯酸钾分解法氯酸钾被加热分解,可以制取氧气。
2KClO3 → 2KCl + 3O2(3)过氧化钴催化分解法过氧化钴可以催化水分子分解,也可以制取氧气。
2H2O → 2H2 + O2三、结语本文总结了氧气的性质及其制法知识点。
九年级化学氧气的制法氧气是一种常见而重要的化学元素,在日常生活和工业生产中具有广泛的应用。
了解氧气的制法对于学习化学知识和实验技术都非常重要。
本文将介绍九年级化学中常用的氧气制法,帮助读者更好地理解和掌握相关知识。
一、氯酸钾分解制氧法氯酸钾分解制氧法是一种常见的制氧方法,也是九年级化学实验中常用的制氧实验之一。
氯酸钾经加热分解产生氧气和氯气的反应方程式如下:2KClO3 → 2KCl + 3O2具体操作步骤如下:1. 取一定质量的氯酸钾,放入干燥的试管或烧杯中。
2. 加热试管或烧杯,直接用火焰或电炉加热均可。
3. 观察试管或烧杯内部情况,观察是否产生气泡和气体。
这种方法制得的氧气通常带有少量的氯气,因此在实验中需要小心操作,避免吸入有害气体。
二、过氧化钠分解制氧法过氧化钠分解制氧法是另一种常见的制氧方法。
过氧化钠经加热分解产生氧气和氧化钠的反应方程式如下:2Na2O2 → 2Na2O + O2具体操作步骤如下:1. 取一定质量的过氧化钠,放入试管中。
2. 加热试管,直接用火焰或电炉加热均可。
3. 观察试管内部情况,观察是否产生气泡和气体。
过氧化钠分解制氧法相对于氯酸钾分解法制得的氧气更为纯净,在一些实验和应用中要求氧气纯度较高时常会选择这种方法。
三、氢氧化钠和过氧化氢制氧法氢氧化钠和过氧化氢是一种常见的制氧剂组合,可以通过氢氧化钠和过氧化氢的反应制取氧气。
反应方程式如下:2NaOH + H2O2 → Na2O2 + 2H2O具体操作步骤如下:1. 取一定质量的氢氧化钠和过氧化氢,放入试管中。
2. 充分搅拌混合试管内的溶液。
3. 观察试管内部情况,观察是否产生气泡和气体。
使用氢氧化钠和过氧化氢制氧法制得的氧气纯度较高,适用于某些特定实验和应用中。
四、注意事项在进行制氧实验时,需要注意以下几点:1. 操作环境要良好通风,避免吸入有害气体。
2. 操作时需佩戴安全眼镜和手套,防止溅溶液或碎片对身体造成伤害。