丰富多彩的化学物质
- 格式:ppt
- 大小:2.98 MB
- 文档页数:34
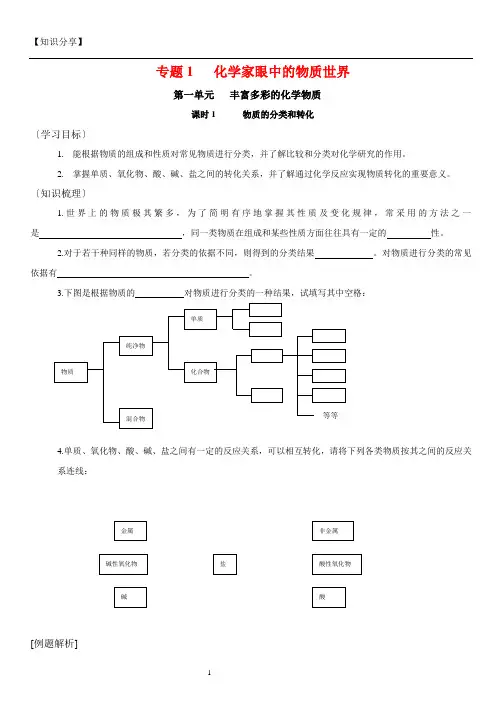
专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质课时1 物质的分类和转化〔学习目标〕1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,并了解通过化学反应实现物质转化的重要意义。
〔知识梳理〕1.世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是,同一类物质在组成和某些性质方面往往具有一定的性。
2.对于若干种同样的物质,若分类的依据不同,则得到的分类结果。
对物质进行分类的常见依据有。
3.下图是根据物质的对物质进行分类的一种结果,试填写其中空格:4.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列各类物质按其之间的反应关系连线:[例题解析]例 1.现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。
(2)写出它们之间转化的化学方程式。
解析:(1)对所给物质进行分类,首先应根据它们在组成、性质、状态等方面的不同,明确分类的依据,然后再针对不同的依据得出不同的分类结果。
从组成上看,镁条是只含一种元素的纯净物,为单质;另四种物质都是含两种或两种以上元素的纯净物,为化合物。
从状态上看,硫酸为液体,另四种物质为固体。
从性质上看,硫酸镁和硫酸都是易溶物,另三种物质为难溶物,等等(2)单质、氧化物、酸、碱、盐之间有一定的转化规律,可先明确上述物质所属物质类型,再根据此类型物质所具有的性质,写出相应的化学方程式(注意复分解反应发生的条件)。
如:锌属于活泼金属,可与酸(或盐)反应生成相应的盐,据此可写出反应式: Zn + H 2SO 4 == ZnSO 4 + H 2↑ , 依此类推,有:2 Zn + O 2 == 2 ZnO ,Zn(OH)2 + H 2SO 4 == ZnSO 4 + 2H 2O , ZnO + H 2SO 4 == ZnSO 4 + H 2O Zn (O H )2=Z n O +H2O〔基础训练〕1.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( ) A.NH 3 B.CH 4 C.NaHCO 3 D.HClO 32. 同种类型的物质往往具有某些相同的性质。


第一单元丰富多彩的化学物质第1课时物质的分类与转化一、物质的分类1.物质的分类依据为了更好地认识和研究物质,人们常根据物质的________、________、________等对物质进行分类。
根据物质的存在状态,将物质分为__________、__________和__________;根据物质的导电性,将物质分为________、__________和__________;根据物质在水中的溶解性,将物质分为____________、________________和______________。
2.物质分类方法(1)按组成结构分类(2)根据物质的性质分类如氧化物的分类①酸性氧化物a.概念:能够与碱反应生成________的氧化物。
b.举例:写出CO2和NaOH溶液反应的化学方程式:___________。
②碱性氧化物a.概念:能够与酸反应生成________的氧化物。
b.举例:写出CaO和盐酸反应的化学方程式:____________________________。
二、物质的转化12.写出上述反应的化学方程式:①________________________________________________________________________ ②________________________________________________________________________ ③________________________________________________________________________ ④________________________________________________________________________ ⑤________________________________________________________________________ 三、化学反应的几种类型1.以反应物和生成物的类别、反应前后物质的种类为分类依据,化学反应可分为:____________、____________、__________和____________。

专题一化学家眼中的物质世界课时作业1 丰富多彩的化学物质时间:45分钟满分:100分一、选择题(每小题4分,共44分)1.某同学在学习了元素与物质之间的相互关系后,在笔记中记录了这样几段话:①酸性氧化物均可与水反应生成对应的酸②难溶碱也可一步反应转化为另一种难溶碱,例如Cu(OH)2→Fe(OH)3③由CaCO3可直接制取纯碱(Na2CO3)④铜可经一步反应制取Cu(NO3)2,你认为以上说法正确的是() A.①②③B.②④C.只有④D.①②③④答案:C2.分类是化学学习和研究的常用手段。
下列分类依据和结论都正确的是()A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物B.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物答案:B3.下列关于胶体和溶液的说法中,正确的是()A.胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀B.溶液和胶体是纯净物,浊液是混合物C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应D.只有胶状物如胶水、果冻类的物质才能称为胶体解析:4.(2011·苏州模拟)现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉。
它们两两之间发生的反应最多有()A.3个B.4个C.5个D.6个答案:B5.下列关于胶体的认识错误的是()A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化B.纳米材料微粒直径一般从几纳米到几十纳米,因此纳米材料属于胶体C.Fe(OH)3胶体呈红褐色D.某些铁的化合物能作净水剂,是因为这些物质溶于水能形成胶体答案:B6.(2011·巢湖模拟)下列关于有关物质的叙述正确的是()①酸性氧化物肯定是非金属氧化物②不能跟酸反应的氧化物一定能跟碱反应③碱性氧化物肯定是金属氧化物④分散系一定是混合物⑤浊液均可用过滤的方法分离A.①③B.③④C.②④D.④⑤答案:B7.下列关于胶体和溶液的说法中,正确的是()A.胶体和溶液都是比较均一、稳定的分散系B.可用过滤的方法将溶液和胶体分离C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应D.常见的烟、豆浆、自来水都是胶体解析:A项,胶体和溶液都是均一、稳定的分散系。

第一单元丰富多彩的化学物质第1课时物质的分类与转化学习目标:1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,能从化合价升降的角度初步认识氧化还原反应,并了解通过化学反应实现物质转化的重要意义。
学习重、难点:学会从不同角度、不同的标准对物质及物质间的转化进行分类。
教学过程:一、导入新课教师讲解]阅读P2图片,思考化学与人类社会发展的关系。
强调]人类生活离不开各种各样的化学物质。
化学物质种类繁多,且新分子和新材料还在飞速增长。
展示]新分子和新材料的飞速增长过渡]世界上的物质如此繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是进行分类研究。
那么,我们是如何来对不同物质进行分类的呢?板书] 物质的分类与转化二、推进新课教学环节一:物质的分类板书]一、物质的分类交流与讨论]在我们日常生活中,常会接触到下列物质:空气、乙醇、水、硫酸铵、铜、碘酒、碘、氧气、石墨、食盐水请你将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
归纳]分类标准:(1)混合物和纯净物;(2)单质和化合物;(3)导体和非导体;(4)气体、液体和固体;(5)易溶物、微溶物和难溶物。
板书]1. 研究物质常采用的方法之一是分类研究。
2. 对于若干种同样的物质,若分类的依据不同,则得到的分类结果不同。
对物质进行分类的常见依据有组成、状态、性能等。
化学上,根据组成对物质进行分类是最常用的方法。
思考]下图是根据物质的组成对物质进行分类的一种结果,试填写其中空格:提问]请说出上述概念“混合物、纯净物、单质、化合物”的含义。
问题解决]实验室中有下列物质,请根据物质的组成对它们进行分类。
①钠(Na);②氯气(Cl2);③氯化铁(FeCl3)溶液;④硫酸(H2SO4);⑤碳酸钙(CaCO3);⑥氧化钙(CaO);⑦氢氧化钠(NaOH);⑧葡萄糖(C6H12O6)。

高一化学专题1知识点归纳第一单元 丰富多彩的化学物质考点1:物质的分类(按物质的组成分类)考点2:物质的转化(反应)类型氧化还原反应和四种基本反应类型的关系:置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合和分解反应不一定是氧化还原反应氧化还原反应 判断依据:元素化合价发生变化考点3:物质的量1、物质的量(1)、 物质的量是一个物理量,符号为 n ,单位为摩尔(mol)(2)、 1 mol 粒子的数目是0.012 kg 12C 中所含的碳原子数目,约为×1023个。
(3)、 1 mol 粒子的数目又叫阿伏加德罗常数,符号为N A ,单位mol -1。
(4)、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
(5)、数学表达式 : AN N n 2、摩尔质量(1)、定义:1mol 任何物质的质量,称为该物质的摩尔质量。
符号:M 表示,常用单位为g/mol(2)、数学表达式:n = m/M(3)、数值:当物质的质量以g 为单位时,其在数值上等于该物质的相对原子质量或相对分子质量。
考点4:物质的聚集状态1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积单位物质的量的气体所占的体积。
符号:V m 表达式:V m = ;单位:L·mol -1在标准状况(0o C,101KPa)下,1 mol 任何气体的体积都约是 L ,即标准状况下,气体摩尔体积为mol 。
补充:①ρ标=M/ → ρ1/ρ2= M 1 / M 2②阿佛加德罗定律:V 1/V 2=n 1/n 2=N 1/N 23、转化关系: n 、m 、M 、N 、N A 、V (气体)、V m 、C B 、V (aq) 之间的关系 考点5:物质的分散系1.分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物。
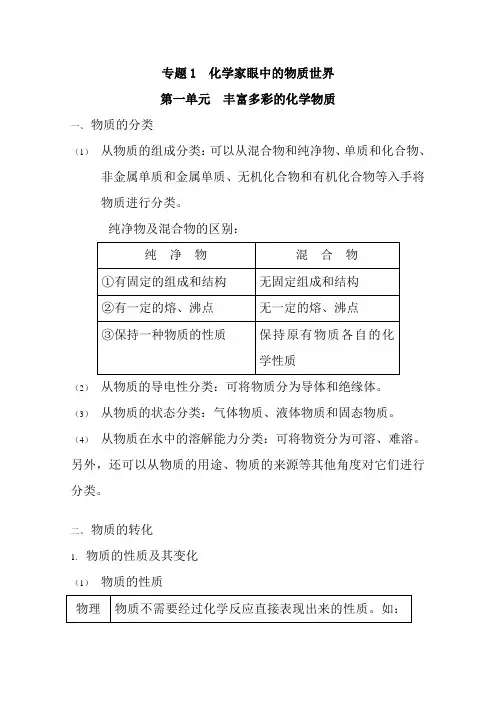
专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质一、物质的分类(1)从物质的组成分类:可以从混合物和纯净物、单质和化合物、非金属单质和金属单质、无机化合物和有机化合物等入手将物质进行分类。
纯净物及混合物的区别:(2)从物质的导电性分类:可将物质分为导体和绝缘体。
(3)从物质的状态分类:气体物质、液体物质和固态物质。
(4)从物质在水中的溶解能力分类:可将物资分为可溶、难溶。
另外,还可以从物质的用途、物质的来源等其他角度对它们进行分类。
二、物质的转化1.物质的性质及其变化(1)物质的性质性质颜色、状态、气味、熔点、沸点、密度、硬度等化学性质物质在发生化学反应时表现出来的性质。
如:酸性、碱性、氧化性、还原性、可燃性、稳定性等(2)物质的变化物理变化定义物质发生状态或外形的改变,而没有生成新物质的变化。
如:水结成冰,蔗糖的溶解,酒精的挥发,金属通电,活性炭的吸附漂白等化学变化定义物质发生变化时生成了其他物质的变化。
在化学变化中常伴随有发光、热效应、变色、气体放出、沉淀生成等现象。
如:金属的腐蚀、物质的燃烧、食品的腐败变质、铵盐受热分解等类型按反应形式可分为:分解、化合、置换、复分解按反应的本质可分为:氧化还原反应、非氧化还原反应按参及反应的离子可分为:离子反应、分子反应按反应进行的程度可分为:可逆反应、不可逆反应2.无机化学反应一般规律(1)金属+非金属→无氧酸盐 Mg+Cl2MgCl2(2)碱性氧化物+酸性氧化物→含氧酸盐 CaO+CO2=CaCO3(3)酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+H2O(4)盐+盐→两种新盐 AgNO3+NaCl=AgCl↓+NaNO3一般参加反应的两种盐可溶,反应向生成更难溶物质的方向进行。
(5)金属+氧气→碱性氧化物 2Cu+O2 2CuO(6)碱性氧化物+水→碱 CaO+ H2O=Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能及H2O反应生成相应的氢氧化物(碱)。
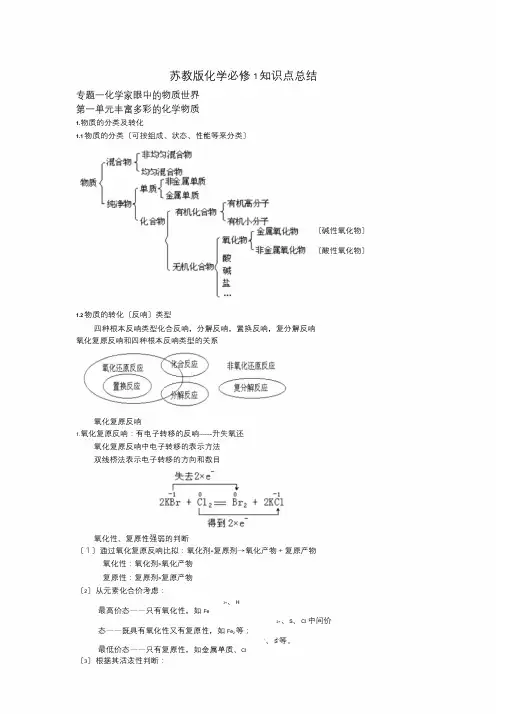
苏教版化学必修1知识点总结专题一化学家眼中的物质世界第一单元丰富多彩的化学物质1.物质的分类及转化1.1物质的分类〔可按组成、状态、性能等来分类〕〔碱性氧化物〕〔酸性氧化物〕1.2物质的转化〔反响〕类型四种根本反响类型化合反响,分解反响,置换反响,复分解反响氧化复原反响和四种根本反响类型的关系氧化复原反响1.氧化复原反响:有电子转移的反响-------升失氧还氧化复原反响中电子转移的表示方法双线桥法表示电子转移的方向和数目氧化性、复原性强弱的判断〔1〕通过氧化复原反响比拟:氧化剂+复原剂→氧化产物+复原产物氧化性:氧化剂>氧化产物复原性:复原剂>复原产物〔2〕从元素化合价考虑:3+、H最高价态——只有氧化性,如Fe2+、S、Cl 中间价态——既具有氧化性又有复原性,如Fe2等;-、S2-等。
最低价态——只有复原性,如金属单质、Cl〔3〕根据其活泼性判断:①根据金属活泼性:对应单质的复原性逐渐减弱KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu对应的阳离子氧化性逐渐增强②根据非金属活泼性:对应单质的氧化性逐渐减弱Cl2Br2I2S对应的阴离子复原性逐渐增强(4)根据反响条件进展判断:不同氧化剂氧化同一复原剂,所需反响条件越低,说明氧化剂的氧化剂越强;不同复原剂复原同一氧化剂,所需反响条件越低,说明复原剂的复原性越强。
如:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O△MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O前者常温下反响,后者微热条件下反响,故物质氧化性:KMnO4>MnO2(5)通过与同一物质反响的产物比拟:如:2Fe+3C2l=2FeC3l Fe+S=FeS可得氧化性Cl2>S离子反响〔1〕电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。


高一化学专题知识点归纳IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】高一化学专题1知识点归纳第一单元丰富多彩的化学物质考点1:物质的分类(按物质的组成分类) 考点2:物质的转化(反应)类型氧化还原反应和四种基本反应类型的关系:置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合和分解反应不一定是氧化还原反应氧化还原反应判断依据:元素化合价发生变化 考点3:物质的量 1、物质的量(1)、物质的量是一个物理量,符号为n ,单位为摩尔(mol)(2)、1mol 粒子的数目是0.012 kg 12C 中所含的碳原子数目,约为×1023个。
(3)、1mol 粒子的数目又叫阿伏加德罗常数,符号为N A ,单位mol -1。
(4)、使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
(5)、数学表达式:AN Nn 2、摩尔质量(1)、定义:1mol 任何物质的质量,称为该物质的摩尔质量。
符号:M 表示,常用单位为g/mol(2)、数学表达式:n=m/M(3)、数值:当物质的质量以g 为单位时,其在数值上等于该物质的相对原子质量或相对分子质量。
考点4:物质的聚集状态1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积单位物质的量的气体所占的体积。
符号:V m 表达式:V m =;单位:L·mol -1在标准状况(0o C,101KPa)下,1mol 任何气体的体积都约是,即标准状况下,气体摩尔体积为mol 。
补充:①ρ标=M/→ρ1/ρ2=M 1/M 2②阿佛加德罗定律:V 1/V 2=n 1/n 2=N 1/N 23、转化关系:n 、m 、M 、N 、N A 、V (气体)、V m 、C B 、V (aq)之间的关系考点5:物质的分散系1.分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物。
苏教专题1 化学家眼中的物质世界教学参考摘录《化学1》是高中化学课程必修部分的第一个模块。
承担着与义务教育阶段化学教育衔接、为高中学生学习化学打好基础和全面提高学生科学素养的任务。
专题一“化学家眼中的物质世界”由3个单元组成,分别为“人类对原子结构的认识”、“丰富多彩的化学物质”和“研究物质的实验方法”。
通过本专题的学习,学生能够体验和感受化学家研究和认识物质的科学方法,了解化学学科研究的主要内容和基本方法:(1)化学家通过假说一模型一实验一假说的方法研究物质的结构,特别是研究原子的结构;(2)为了研究物质的性质和应用,化学家采用多种方法对物质进行分类,研究不同种类物质之间的转化关系;(3)无论是对自然界存在的物质还是化学家新合成的物质,化学家首先将他们分离提纯,然后对其结构、组成、性质等进行实验研究;(4)化学家需要通过定量研究的方法,研究物质的组成和物质的转化关系等。
本专题编写的基本出发点是:(1)让学生在生动有趣的学习过程中,了解化学学科研究的基本范围,了解学习和研究化学学科的基本方法。
如本专题第一单元中安排“原子的构成”等内容,一方面是让学生明白化学学习和研究必须进入原子、分子等微观世界;另一方面为后续专题中有关钠、镁、氯、溴等元素及化合物内容的学习作准备。
再如,第三单元“研究物质的实验方法”,就是要让学生懂得实验方法不仅是化学家研究化学物质的一种重要的方法,也是高中阶段学习化学的最重要的方法,要学好化学必须亲自动手进行实验探究。
(2)让学生大致了解化学学科与人类发展的紧密关系。
让学生通过本专题的学习,体验到化学既是一门好学、有用、有趣的学科,又是一门与人类发展、人类生活有着紧密联系的学科。
如第二单元“丰富多彩的化学物质”,就是要让学生初步了解在人类发展的历史过程中,化学学科已经为改善人类的生活作出了重大的贡献,并还将起着更大的作用。
从而在高中化学学习的起始阶段就能让学生体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐,培养和发展学习化学的兴趣。
必修1第一单元丰富多彩的化学物质知识点总结work Information Technology Company.2020YEAR第一单元丰富多彩的化学物质一、物质的分类方法根据存在状态分:气态,固态和液态根据导电性能分:导体,半导体和绝缘体根据眼的溶解性分:可溶性的盐,难溶性的盐和不溶性的盐④根据物质的组成分:混合物和纯净物稳定的混合物:溶液,空气等混合物(多种物质构成) 不稳定的混合物:泥土,矿石等金属单质:Na、Fe、Cu等物质单质一种元素非金属单质:Cl2、H2、、O2、O3、C60等纯净物酸:HCl、H2CO3等(一种物质)无机化合物碱:NaOH、Ba(OH)2、NH3·H2O等化合物盐:Na2CO3、NaHSO4、Cu(OH)2(CO3)2两个或氧化物:CO、CO2、CuO等两个以上元素有机化合物:CH3COOH、CH4、C2H6、CH3CH2OH等二、物质的转化意义:一定条件下,不同类别的物质是可以转化的。
研究物质的转化,不仅可以探索自然界已经存在的物质,更重要的是利用物质的转化可以进一步制造人类需要的新物质(1)不同类别物质间的转化:一定条件下,不同类别的物质间可以转化(1)按反应类型研究物质的转化①四大基本反应类型的化学反应反应类型实例A+B====AB Ca+Cl2=====CaCl2化合反应AB==== A+B 分解反应AB+C====A+CB Ca+H2O====Ca(OH)2+H2↑置换反应AB+CD====AD+CCaO+2HCl====CaCl2+H2O 复分解反应B②两类反应发生的条件:A.在水溶液中,发生复分解反应需具备下列条件之一:生成沉淀(包括微溶性物质),生成气体,生成水(严格讲是生成难电离的物质)B.在水溶液中,一种金属与另一种可溶性的金属盐溶液发生置换反应应具备的条件是:活动性强的金属置换活动性弱的金属(除K、Ca、Na外)(2)按照反应前后元素的化合价是否变化研究物质的转化实例反应类型反应前后元素化合价是否变化氧化还原反应升(被氧化),降(被Ca+Cl2=====CaCl2还原)非氧化还原反应没有变化CaO+2HCl====CaCl2+H2O氧化还原反应与四大反应之间的关系如下图所示三、物质的量 1.物质的量① 物质的量是七个基本物理量之一(长度l 质量m 时间s 物质的量n ),② 意义:表示含有一定量数目的粒子的集体,适用范围:肉眼看不到的微粒,如原子,分子,离子等。