考研哈尔滨工业大学2011年水分析化学真题
- 格式:doc
- 大小:46.00 KB
- 文档页数:2

哈尔滨工业大学2010年硕士研究生考试物理化学试题一.填空题(20分)1、C (s )和CO (g )、CO 2(g )、O 2在700℃达到平衡,则该系统的自由度数为( )2、某一化学反应在一定条件下的平衡转化率为50%,加入催化剂后,保持其他反应条件不变,反应速率增加了20倍,此时的平衡转化率将是( )3、在T 、P 恒定的条件下,某反应达到平衡时A 的平衡转化率为x A ,1,保持T 、P 不变,加入惰性气体,此时A 的平衡装化率为x A ,2,那么 x A ,1、 x A ,2的大小关系为()4、电极的极化现象是( )5、1mol 双原子分子理想气体B 从300K 分别经恒温和恒压过程升温至400K ,则两过程熵变之差为,即∆S (恒压)−∆S (恒容)=( )6、写出(ðV/ðT)P 、(ðP/ðT)V 、(ðS/ðV)T 、(ðS/ðP)T 这四个量之间的两个等量关系式( )7、在一定温度下,当KCl 溶液中KCl 的物质的量浓度c = ( )时,该溶液的电导率与其摩尔电导率数值上相等。
8、在101.325 kPa 的压力下,I 2在液态水和四氯化碳中达到分配平衡(无固态碘存在),则该系统的条件自由度( )9、将克拉贝龙方程用于水的液固两相平衡,因为()()m 2m 2V H O,l V H O,s 〈,所以随着压力的增加,()2H O l 的凝固点将( ) 二. 选择题(20分) 1、在隔离系统内( )A. 热力学能守恒,焓变守恒B. 热力学不一定守恒,焓变守恒C. 热力学能守恒,焓变不一定守恒D. 热力学能,焓变均不一定守恒 2、戊烷标准摩尔燃烧焓−35201KJ mol -⋅,()2CO g 和()2H O g 标准摩尔生成焓分别为−3951KJ mol -⋅和−2861KJ mol -⋅,则戊烷标准摩尔生成焓为( ) A. 28391KJ mol -⋅ B. −28391KJ mol -⋅ C. 1711KJ mol -⋅ D. −1711KJ mol -⋅3、有一连串反应12K K A B C −−→−−→,下列哪些情况可能使B 的产率提高( ) A. B 很不活泼,A 很活泼 B. 反应速率关系12k kC. A 不活泼,B 活泼D. 尽可能延长反应时间 4、()γP,m V,m pV γ=C /C = 常量适用的条件是( )A. 绝热过程B. 理想气体绝热过程C. 理想气体绝热可逆过程D. 绝热可逆过程5、恒温恒压下,某反应的1r m G 5kJ mol θ-∆=⋅该反应能否进行( )A. 能正向自发进行B. 能逆向自发进行C. 不能判断D. 不能进行 6、关于亨利系数,下列说法正确的是( )A. 其值与温度、浓度、压力有关B. 其值只与温度、溶质性质和浓度标度有关C. 其值与溶剂性质、温度以及浓度大小有关D. 其值与温度、溶剂和溶质的性质以及浓度标度等性质有关 7、已知373K 时液体A 的饱和蒸汽压为133.24 kPa ,液体B 的饱和蒸汽压为66.62KPa ,设A 和B 形成理想溶液,当溶液中A 的物质量分数为0.5时,在气相中A 的物质的量分数为( )A. 1B. 1/2C. 2/3D. 1/38、在一定温度和压力下,对于一个化学反应,能用于判断其方向的是( ) A. r m G θ∆ B. P K C. r m G ∆ D. r m H ∆9、某温度下,()4NH Cl s 的分解压力为p θ,则分解反应的平衡常数为p K θ为( ) A. 1 B. 1/2 C. 1/4 D. 1/810、某物质溶于互不相容的两液相α和β中,该物质在α相以A 的形式存在,在β相以2A 的形式存在,则定温定压下,两相平衡时( ) A. ()()2A A θθμ=μ B. ()()2A 2A θθμ=μ C. ()()22A A θθμ=μ D. 无法确定 三. 简答题(20分)1、用3AlCl 水解制备3AlOH 溶胶,(1)请画出胶团结构;(2)用3LaNO 和NaCl 聚沉,何者聚沉能力强 ?2、Zn 和稀硫酸作用:(a )在敞口瓶中进行(b )在封口瓶中进行,请问何者放热多?为什么?3、在一个底部为光滑平面的抽真空的玻璃容器中,有半径大小不同的圆形汞滴,请问恒温放置一段时间后,会发生什么现象?请分别用拉普拉斯方程和开尔文方程解释这种现象。

水分析化学试卷及答案篇一:水分析化学试卷及答案一、选择题(每小题 1 分,共 20 分)1、在滴定分析法测定中出现的下列情况,哪种导致系统误差?( D )A 试样未经充分混匀;B 滴定管的读数读错;C 滴定时有液滴溅出;D 砝码未经校正;2、滴定分析相对误差一般要求为0.1%,滴定时耗用标准溶液体积应控制在:(C )A 10ml 以下;B 10ml;C 10~40ml;D 50ml;3、由计算器算得(2.236×1.1124)/(1.036×0.2000)的结果为12.004471,按有效数字运算规则应将结果修约为:( C )A 12.0045;B 12.0;C 12.00;D 12.0044、对______A____某试样进行三次平行测定,得CaO 平均含量为30.6%,而真实含量为30.3%,则30.6%-30.3%=0.3%为:( )A 绝对误差;B 相对偏差;C 相对误差;D 绝对偏差;5、用25ml 移液管移出的溶液体积应记录为:( C )A 25ml;B 25.0ml;C 25.00ml;D 25.000ml。
6、欲配制2mol/LHCl溶液,应在10ml 6 mol/L HCl溶液中加水:( )A 100ml;B 50ml;C 30ml;D 20ml;D7、可用于直接配制标准溶液的是(B )A KMnO4;B K2Cr2O7;C Na2S2O3·5H2O;D NaOH。
8、间接碘量法测定水中Cu2+含量,介质的pH 值应控制在:( B)A 强酸性;B 弱酸性;C 弱碱性;D 强碱性。
9、在滴定反应K2Cr2O7+FeSO4+H2SO4→Fe2(SO4)3+Cr2(SO4)3+K2SO4+H2O 达到等当点时,下列各说法哪些是正确的?( )A 溶液中Fe2(SO4)3与Cr2(SO4)3的浓度(单位:mol/L)相等;B 溶液中Fe2(SO4)3与Cr2(SO4)3的浓度(单位:mol/L)之比为3:1;C 溶液中不存在Fe2+和Cr2O72-;D 溶液中两个电对“Fe3+/Fe2+”和“C r2O72-/Cr3+”的电位不相等10、共轭酸碱对的Ka 和Kb的关系是:( C)A ka=Kb;B Ka·Kb=1;C Ka/Kb=Kw;D Ka·Kb=Kw。


★哈尔滨工业大学012市政环境学院污染控制微生物、水分析化学2013内部辅导全套考研资料库、试题笔记库★【◆2011年10月—2015年10月更新◆】适用专业:0830环境科学与工程(含083001环境科学、083002环境工程两个二级学科)、081403市政工程、085213建筑与土木工程(工程硕士)、085229环境工程(工程硕士)、★081420城市水资源、085229环境工程稀贵套餐:Ⅰ.旗舰级黄金套餐★★★Ⅱ.尊贵领袖级套餐★★★★Ⅲ.超级套餐VIP白金版★★★★哈工大硕博联合团队信度认证:Ⅰ、证件照片:哈尔滨工业大学本科学生证、学生卡、研究生证、研究生卡、饭卡、图书卡、团队成员博士录取通知书、研究生录取通知书、各院辅导班多年听课证数码照片。
Ⅲ、票据照片:中国邮政EMS国内特快专递、国内快递包裹、国内慢速包裹、国内挂号印刷品、顺风快递1000张邮寄回执收据清晰数码照片Ⅳ、资料照片:可欣赏团队空间各学院全套王牌资料高清晰全集数码照片进行验证。
Ⅴ、联系方式:QQ为VIP会员,两部业务电话24小时开机。
Ⅵ、团队面购:哈尔滨地区考生可预约后持本人学生证来工大本部或工大二区直接购买资料。
所有资料在其各自领域都是之最,突破了连续6年获得"考生最爱之王牌资料"的殊荣!『品牌资料、王牌资料、金牌资料、名牌资料』全套“精华版▲上乘”笔记、经典VIP笔记、课件、资料、教案、录音、指南需要满足的条件,是:1、抄写者必须是哈工大本院专业课方面突出并且字体俊美善于记录的女生(男生如果各项指标高也可)2、字体必须清晰幽美、抄写必须详尽并有条理性和逻辑性,以供参看。
(乱七八糟的坚决不在本列)3、抄写者必须是专业课单科考试成绩非工科130~140分、工科110~120分的牛人。
4、该笔记必须是第一次原版经典复印,而非二次、三次、N次粗糙复印。
(很多卖家都是N次复印)5、辅导班录音必须用高清晰录音笔或者品牌MP3进行录制,有杂音的不在本范围内。


水分析填空题水分析填空题水分析填空题水分析填空题1.吸光度A与透光率T的关系式为A= —IgT o2.A=eCL式中£叫摩尔吸光系数,它反映了在一定波长下用吸收光谱法测定该吸光物质的灵敏度,£越大对光的吸收越强,灵敏度越高。
3.吸收光谱法定量的理论基础是最常用的定律。
朗伯-一比耳4.吸收光谱曲线上最大吸收峰所对应的波长叫,用表示,在此波长测定灵敏度,通常选用作为分析时的工作波长。
最大吸收波长X max 最高X max5.高镒酸钾为,它吸收了白色光线中的光线。
紫红色绿色6.可见光分光光度计工作范围为nm,在比色器中进行测定时,被测物质必须在仪器工作波长范围有。
36()〜800 吸收7.分光光度计主要由、、、四部分组成。
光源单色器吸收池检测器8.水样中铁的测定可用或显色后进行比色分析。
磺基水杨酸邻二氮菲9.天然水中Fe2+的测定采用邻二氮菲比色法测铁时,需将水中的Fe3+ 以后才能显色测定。
还原成Fe2+10.采用邻二氮菲比色法测水样中Fe3+时,先测,再测离子,其差值即为Fe3+的含量。
总铁Fe2+11.如水中的氮主要为有机氮和氨氮时,表明水O 近期受到污染12.如水中的氮主要为亚硝酸盐时,表明水中有机物的分解。
尚未达到最后阶段13.如水中的氮主要为硝酸盐时,说明 。
水污染己久 14.吸收光谱定量分析通常利用法。
标准曲线15. 利用吸光度具有性质可利用量。
加和性解联立方程法16. 对于较高浓度或较低浓度的待测物质,可利用度法17. 利用标准曲线法进行测定时,待测物质的浓度应在范围18. 利用显色剂对无机离了进行显色比色分析时,应注意控制显色剂的、介质的、及溶液中共存离子的。
用量 酸度 干扰19.采用PH 计测定水样PH 值时,通常采用作参比电极,作指示电极。
甘汞电极玻璃电极20.采用PH 计测定水样PH 值时,两个电极构成的电池电动势与水样的PH 值 成 。
正比 21.采用离了选择性电极测定高子浓度时,两个电极构成的电池电动势与水样中待测离了 成线性关系。

西安科技大学2011年硕士研究生入学考试试题(A)────────────────────────────────────────────────科目编号:814 科目名称:有机化学考生须知:1、答案必须写在答题纸上,写在试题或草稿纸上不给分。
2、答题须用蓝、黑色钢笔或圆珠笔,用铅笔、红色笔者不给分。
3、答题必须写清题号,字迹要清楚,卷面要保持整洁。
4、试题要随答题纸一起交回。
5、注意第三、第四和第五题,有选作提示:按照卷面答题顺序得分。
一、选择(10小题, 共20分)[2分](1) 有强大爆炸力的三硝基甘油属于下列哪类物质:(A) 酸(B) 碱(C) 脂(D) 酯[2分](2) 从庚烷、1-庚炔、1,3-己二烯中区别出1-庚炔最简明的办法是采用: (A)Br2 + CCl4(B) Pd + H2(C) KMnO4,H+(D) AgNO3,NH3溶液[2分](3) 下列化合物有对映异构的应是:[2分](4) 羧酸的沸点比相对分子质量相近的烃,甚至比醇还高。
主要原因是: (A) 分子极性(B) 酸性(C) 形成二缔合体(D) 分子内氢键[2分](5) 下列化合物中哪些可能有顺反异构体?(A) CHCl=CHCl (B) CH2=CCl2(C) 1-戊烯(D) 2-甲基-2-丁烯[2分](6) 合成格氏试剂一般在下列哪一溶剂中反应?(A) 醇(B) 醚(C) 酯(D) 石油醚[2分](7) 起硝化反应的主要产物是:[2分](8) 在测定沙海葵毒素结构中主要反应有两个:一是用过碘酸,二是用臭氧,目的是:A 前者为了氧化切断双键,后者为了氧化切断邻二醇键B 前者为了氧化切断邻二醇键,后者为了氧化切断双键C 切断双键D 切断邻二醇键[2分](9) 下面化合物羰基活性最差的是:(A) PhCHO (B) CH3CHO(C) PhCOCH3(D) CH3COCH3[2分](10) 邻甲基乙苯在KMnO4,H+作用下主要产物是:(A) 邻甲基苯甲酸(B) 邻苯二甲酸(C) 邻甲基苯乙酸(D) 邻乙基苯甲酸二、填空题12小题,共30分)[2分](1) 下列化合物的CCS名称是:[2分](2) 写出下列反应的主要有机产物(如有立体化学问题请注明)。

一.名词解释条件电极电势酸度标定缓冲容量朗伯—比尔定律老化EDTA酸效应色谱流出曲线梯度淋洗共振发射线二.填空测定COD进程中,催化剂————需要回流————基准物质————1.制备溴酸钾溶液时,由————和————发生,反应方程式————2.弱酸/碱缓冲溶液能够准确滴定的范围————3.4.在电位法测定PH的过程中————作为指示电机,————作为参比电极5.色谱/质谱法由三部分组成————,————,————6.水质由————种指标《GB5749—2006》三.简答1.用气相色谱法检测水中微量有机物,预处理方法有几种,并进行简单论述。
2.KMnO4,TOC,UV A254分别是表示水中有机物含量的指标,请论述其区别和联系。
3.在络合滴定过程中,消除干扰的方法有哪些?举例说明。
4.原子化器有哪几种?分别论述工作的基本原理。
5.影响直接碘量法与间接碘量法的关键因素。
四.计算1.加标量加标后样品量加标前样品量0.2 0.242 0.050.1 0.149 0.050.1 0.099 0.00试计算平均加标回收率。
2.已知K sp(AgCl)=1.8*10-10 K sp(Ag2CrO4)=1.1*10-12 用0.05mol/LAgNO3滴加0.05mol/L KCl和0.05mol/LK2CrO4的混合物,试计算说明:(1)Cl—与CrO42—哪种离子先沉淀?(2)当CrO42—形成沉淀时,Cl—的含量是多少?是否能分离?3.EDTA测定水中Al3+,Fe3+时,lgK稳(AlY)2-=16.13,lgK稳(FeY)-=25.1,试计算水中Al3+,Fe3+滴定时所需的最小PH值。
PH 0 1 2 3 4 5 6 7 8 9lg@Y(H)4.BOD指数是指水质可生化能力的指标,用锰固法可增加其测量的准确性:第N天空白水样水样第一天10.12 9.87第五天10.12 2.54计算BOD值。
5.测量水中铁离子含量NH4Fe(SO4)2(用吸收光谱法测定水中铁离子含量),C(Fe3+)=0.1g/L,取下面表格中的体积放入50ml容量瓶中。
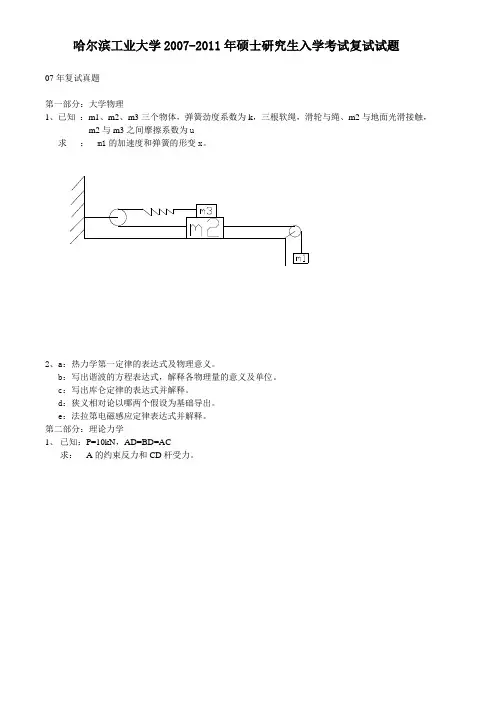
哈尔滨工业大学2007-2011年硕士研究生入学考试复试试题07年复试真题第一部分:大学物理1、已知:m1、m2、m3三个物体,弹簧劲度系数为k,三根软绳,滑轮与绳、m2与地面光滑接触,m2与m3之间摩擦系数为u求: m1的加速度和弹簧的形变x。
2、a:热力学第一定律的表达式及物理意义。
b:写出谐波的方程表达式,解释各物理量的意义及单位。
c:写出库仑定律的表达式并解释。
d:狭义相对论以哪两个假设为基础导出。
e:法拉第电磁感应定律表达式并解释。
第二部分:理论力学1、已知:P=10kN,AD=BD=AC求:A的约束反力和CD杆受力。
2、已知:一光滑圆柱体用绳子缠绕,如图下落,从起点下落h 时质心速度v =32gh 3求:圆柱体平面运动方程第三部分:材料力学1、L=11 h=8 b=10求Me= ,d= ,[bs δ] [τ] 。
校核2、 已知:J2=2J1求:最大挠度第四部分:电工技术1、求电流的初始值2、a:叠加定理b:把电阻性负载联结到三相电路中,分别联成星形和三角形。
c:已知:u=310sinwt,f=50HZ求:U的有效值和当t=0.1s时的瞬时值d:叙述基尔霍夫电压和电流定律e:可编程控制器的英文缩写是什么?工作方式是什么?f:用电流表、电压表测电流、电压时与电路或负载如何联结?第五部分:电子技术1、已知:三人表决器设计,原则:少数服从多数,不可弃权写出真值表及逻辑表达式推理过程,并用“与非”门设计电路。
2、a:什么叫反馈、正反馈及负反馈?b:二极管主要参数是什么?第六部分:自动控制1、已知:施加一外力f(t),求:物体的运动微分方程和传递函数G(S)=Y(s)/F(S)。
S+23S +32S+4S+52、a:已知系统的特征方程为 D(s)=4用劳斯稳定判据判断其稳定性。
b:自动控制系统稳定性的概念。
c:写出控制系统典型输入信号的函数表达式:脉冲函数,阶跃函数,速度函数。
d:开环传递系统和闭环传递系统的定义。

二OO七年硕士研究生考试试题考试科目:____水分析化学_________ 考试科目代码:[ 473 ]适用专业:____市政工程、城市水资源考生注意:答案务必写在答题纸上,并标明题号。
答在试题上无效。
题号一二三四总分分数20 40 40 50150分一. 基本概念(2×10=20分)1 水质指标2 色度3 同离子效应4 掩蔽作用5 间接电位分析6 色谱流出曲线7 共振线8 总残渣9 溴酸钾法 10 酸度二. 论述题(5×8=40分)1 试论分子光谱产生的原因及其表达方法。
2 为什么要对色谱柱进行老化处理。
3 金属指示剂在应用时会出现那些问题,怎样防止。
4 基准物质应符合哪些条件。
5 如何确定地表水中碱度的组成形式。
6提高氧化还原反应速度的技术措施。
7 怎样通过试验方法评价分析方法准确度和精密度。
8 原子吸收锐线光源产生的方法。
三. 填空题(2×20=40分)1 乙二胺四乙酸二钠盐的化学结构式可表示为(1),它的溶解度比乙二胺四乙酸(2)。
2.化学法测水中DO时,先加入(3)和(4)可以看到(5)色沉淀,发生反应的方程式为(6),然后转变为(7)色沉淀,相应的反应方程式为(8)。
3.作为卫生学指标之一的余氯一般包括(9)和(10)两种。
4.在高锰酸盐指数和COD测定过程中,催化剂分别为(11)和(12),而掩蔽剂分别为(13)和(14),指示剂分别为(15)和(16)。
5.通过林邦曲线可以确定金属离子被EDTA(17)的最低(18)。
6.欲检测水中硝基苯的含量可以选择(19)法,也可采用(20)法。
四:计算题(10分×5=50分)1.两种无色物质A和B,反应生成有色物质AB(1:1),混合等体积0.0010mol·L-1 A和B,用1cm比色皿在550nm处测定AB的吸光度值是1.60,已知AB的ε550nm=450L/(mol·cm),试计算AB的解离平衡常数。
华中科技大学文华学院2008~2009 学年度第二学期《水剖析化学》试卷学号课程性质:(必修)考试时间: 2009 年月日专业(B 卷)使用范围:(本科)考试方式:(闭卷)班级学生姓名成绩一、选择题(每题 2 分,合计 16 分)1.用含有少许邻苯二甲酸的邻苯二甲酸氢钾标定 NaOH 溶液的浓度,标定出的 NaOH 浓度比实质浓度()。
A. 偏低B. 偏高C. 无影响 D 不可以确立2. 在滴定剖析测定中出现的以下状况,那种致使系统偏差 ? ()A. 滴定管的读数读错B. 滴准时有液滴溅出C. 砝码未经校订D. 试样未经充足混匀2O2溶液的 pH值为:(H2O2的 Ka=2.24*10-12)()(A)(B)(C)(D)4.测定 Fe2(SO4)3溶液中的 SO42-,而 Fe3+以 Fe (OH)3形式除掉,则溶液酸度应控制在()。
A. 弱酸性溶液中B. 强酸性溶液中C. 弱碱性溶液中D. 中性溶液中5. 切合朗伯—比尔定律的有色溶液,当浓度改变时()。
A.最大汲取波长改变,吸光度不变B.吸光度改变,透光率不变C.最大汲取波长不变,吸光度改变D.最大汲取波长、吸光度均改变6. 已知 Mg(OH) 2的 Ksp=1.8*10 -11,Mg(OH) 2则饱和溶液中的 pH 是()。
4-在酸性、中性、碱性介质中的复原产物分别是( )7. MnO(A) Mn2+、MnO2、 MnO42-2-2+(B) MnO4、MnO2、Mn2+-(C) MnO2、Mn 、MnO42-2+-(D) MnO4、Mn 、MnO48. 高锰酸钾滴定法中酸化溶液时用的酸是()( A)HNO3(B) HCl(C)H2SO4(D)HAC二、填空(每空 2 分,合计 40 分)1.关于常量滴定管读数,若要求剖析结果的相对偏差< 0.1%,则要求耗费滴定剂的体积> __________2.某酸碱指示剂的 K a×10-5,其理论变色范围是 pH 为__________。
《水分析化学Ⅰ》研究生入学考试模拟试卷(150分)试题序号分值得分评阅人一、选择题20分,每题1分二、填空题30分,每题1分三、名词解释:20分,每题2分四、问答题20分,每题4分五、论述题320分,每题5分六、计算题30分,每题6分七、方案设计题10分,每题5分一、单项选择题(20分,每题1分)1、欲配制1000mL 0.1mol/L HCl 溶液,应取浓盐酸()。
A. 0.84mlB. 8.4mlC. 1.2mlD. 12ml2、NaOH标准溶液滴定H2CO3至酚酞终点时的质子条件式是()。
A.[H+]+[H2CO3]=[OH-]+[HCO3-]+[CO32-]B.[H+]+[H2CO3]=[OH-]+[CO32-]C.[H+]+2[H2CO3]+[HCO3-]=[OH-]+[CO32-]D.[H+]=[OH-]+[HCO3-]+2[CO32-]3、莫尔法测定Cl-含量时,要求介质的pH在6.5-10.0范围内,若酸度过高,则()A.Ag2CrO4沉淀不易生成B.AgCl沉淀不完全C.AgCl沉淀吸附Cl-增强D.AgCl沉淀易胶溶4、已知在1mol/L H2SO4溶液中,MnO4-/Mn2+和Fe3+/Fe2+电对的条件电极电位分别为1.45V 和0.68V。
在此条件下用KMnO4标准溶液滴定Fe 2+,其化学计量点的电位值为()。
A. 0.73VB. 0.89VC. 1.32VD. 1.49V5、在EDTA 络合滴定中,()。
A. 酸效应系数愈大,络合物的稳定性愈大;B. 酸效应系数愈小,络合物的稳定性愈大;C. pH 值愈大,酸效应系数愈大;D. 酸效应系数愈大,络合滴定曲线的pM 突跃范围愈大6、符合比尔定律的有色溶液稀释时,将会产生()。
A. 最大吸收峰向长波方向移动;B. 最大吸收峰向短波方向移动;C. 最大吸收峰波长不移动,但峰值降低;D. 最大吸收峰波长不移动,但峰值增大7、标定KMnO4溶液的浓度时,合适的基准物质是()。
考研哈尔滨工业大学2013年水分析化学真题哈尔滨工业大学2013年硕士研究生考试试题考试科目:水分析化学考试科目代码:[873]适用专业:市政工程、城市水资源考生注意:答案务必写在答题纸上,并标明题号,答在试题上无效。
可以使①样本标准偏差②标准溶液③化学需氧量④缓冲溶液⑤分布沉淀⑥配位原子⑦离子选择电极⑧摩尔吸收系数⑨分配系数⑩火焰原子化器二.填空题(0.5分×60=30分)1.准确度是指________。
2.基准物质应满足_______、_______、_______、_______、_______和试剂组成与它的化学式完全相符。
3.碱度是指水中_______物质的总量,酸度是指水中_______物质的总量。
4.根据《分析实验室用水规格和试验方法》(GB/6682-92)规定,分析实验室用水分为_______个等级:_______、_______、_______。
5.总硬度是指_______和_______的总浓度,碳酸盐硬度又称_______,非碳酸盐硬度又称_______。
6.影响沉淀溶解度的主要因素有_______效应、_______效应、_______效应、_______效应,此外______、_______、______也影响沉淀的溶解度。
7.莫尔法以______为指示剂,佛尔哈德法以______为指示剂。
8.氧化还原滴定中,能够指示在化学计量点附近指示滴定终点的试剂叫做_______,根据指示剂的性质可分为_______、_______、_______。
9.碘量法主要用于测定水中_______、_______、_______、_______、_______和_______。
10.离子选择电极主要用于测定水中的_______、_______、_______、_______。
11.吸收曲线上最大吸收峰所对应的波长用_______表示,吸收峰向短波方向移动叫做_______,吸收峰向长波方向移动叫做;分子中产生吸收峰的主要原子或原子团叫做_______,使生色基团所产生的吸收峰向红移的原子或原子团叫做_______。
2011年黑龙江研究生入学考试考试真题卷•本卷共分为1大题50小题,作答时刻为180分钟,总分100分,60分及格。
一、单项选择题(共50题,每题2分。
每题的备选项中,只要一个最契合题意)1.立方晶体中(110)和(211)面同归于____晶带。
(A) [110] (B) [100] (C) [211] (D)参阅答案:D2.在离子晶体中,如在部分区域构成Schottky缺点,则这个区域中阳离子空位的浓度与____持平。
(A) 阴离子空位浓度 (B) 空隙阴离子浓度 (C) 空隙阳离子浓度参阅答案:A3.两平行螺型位错,当伯氏矢量同向时,其彼此作用力____(A) 为零 (B) 相斥 (C) 相吸参阅答案:B4.能进行交滑移的位错必定是____(A) 刃型位错 (B) 螺型位错 (C) 混合位错参阅答案:B5.不能产生攀移运动的位错是____(A) 肖克利不全位错 (B) 弗兰克不全位错 (C) 刃型全位错参阅答案:A6.置换型固溶合金中溶质原子的分散是通过____完成。
(A) 原子交换机制 (B) 空隙分散机制 (C) 空位机制参阅答案:C7.材猜中能产生分散的底子原因是____(A) 温度的改变 (B) 存在浓度梯度 (C) 存在化学势梯度参阅答案:C8.A和A-B合金焊合后产生柯肯达尔效应,测得界面向A试样方向移动,则____(A) A组元的分散速率大于B组元 (B) 与(A)相反 (C) A、B两组元的分散速率相同参阅答案:A9.高分子资料是否具有和婉性首要决定于____的运动才干。
(A) 主链链节 (B) 侧基 (C) 侧基内的官能团或原子参阅答案:A10.____,位错滑移的派一纳力越小。
(A) 位错宽度越大 (B) 滑移方向上的原子间隔越大 (C) 相邻位错的间隔越大参阅答案:A11.形变后的资料再升温时产生回复和再结晶现象,则点缺点浓度下降显着产生在____(A) 回复阶段 (B) 再结晶阶段 (C) 晶粒长大阶段参阅答案:A12.退火孪晶呈现的几率与晶体的层错能的关系为____(A) 无关,只与退火温度和时刻有关 (B) 层错能低的晶体呈现退火孪晶的几率高 (C) 层错能高的晶体呈现退火孪晶的几率高参阅答案:B13.三种组元组成的试样在空气顶用X射线衍射(XRD)剖析其随温度改变而产生相变的状况,则最多可记录到____共存。
哈尔滨工业大学
2011年硕士研究生考试试题
考试科目:水分析化学考试科目代码:[873]
适用专业:市政工程、城市水资源
考生注意:答案务必写在答题纸上,并标明题号,答在试题上无效。
可以使
一.
①色度②掩蔽作用③永久硬度④参比电极⑤同离子效应⑥老
化时间⑦浊度⑧色谱流出曲线⑨溴酸钾法⑩总残渣
二.论述题(5分×8=40分)
①简述水样pH值测定原理及相关反应方程式。
②水中碱度来源和组成有哪些?在连续滴定法中如何根据测定结果判断水
中碱度组成?
③以EBT测定水中硬度为例说明金属指示剂的作用原理。
④简述化学需氧量COD测定过程和原理。
⑤说明莫尔法测定Cl-时做空白实验和加入CaCO3的目的。
⑥比较示差分光光度法与普通分光光度法的异同点。
⑦简述空心阴极灯产生锐线光源的基本原理,并简单绘图说明。
⑧简述高效液相色谱仪的组成和各部分作用。
三.填空题(2分×20=40分)
①酸碱滴定突跃范围与(1)和(2)有关。
②生活饮用水水质标准(GB5749—2006)共有106项检测指标,其中常规检测项目(3)项,非常规检测项目(4)项。
③标准偏差又称(5),当测定次数趋于无限多时称为总体标准偏差。
④EDTA分子中,有(6)个可与金属离子形成配位键的原子,其中包括(7)个氮原子和(8)个羧基氧原子。
⑤莫尔法测定水样中Cl-时以(9)为指示剂,以(10)为滴定剂。
⑥提高氧化还原反应速度的措施有(11)、(12)、(13)。
⑦pH值电位法测定过程中以(14)为指示电极和(15)为参比电极。
⑧废水中的硝基苯可用(16)检测器检测。
⑨吸收光谱法中,可见光区的吸收池采用(17),紫外光区的吸收池可用(18)。
⑩原子吸收光谱的锐线光源采用(19);(20)是原子吸收分光光度计的心脏部分。
四.计算题(10分×5=50分)
1. 取水样100ml,用0.0500mol/lHCl溶液滴定至酚酞无色时,用去15.00ml ;接着加入甲基橙指示剂,继续用HCl标准溶液滴定至橙红色,又用去9.00ml。
问水样中有何种碱度,其含量分别是多少(mg/L)?(以CaCO3计,其相对分子质量为100.1)
2. 称取铝盐混凝剂样品
3.000g,溶解后加入过量0.01mol/L的EDTA溶液50.00mL,pH值控制在5~6之间,以XO为指示剂,用0.001mol/L锌标准溶液回滴,消耗15.00mL,求混凝剂中Al2O3的质量分数(Al2O3的相对分子质量为102)。
3. 用玻璃电极测定未知水样的pH值。
将玻璃电极和另一参比电极浸入pH=5.00的标准缓冲溶液中,组成的原电池的电极电位为0.5V;将标准缓冲溶液换成水样,测得电池的电极电位为-0.3V,通过计算判断该水样的酸碱性(25℃)。
4. 用气相色谱法测定废水中苯酚的浓度时,分别取1μL不同浓度的苯酚标准溶液,测得峰高值见下表:
浓度(mg/mL)0.02 0.1 0.2 0.3 0.4 峰高h(cm)0.6 3.4 7.4 10.6 14.6
今取废水100mL浓缩100倍后去浓缩液1μL注入气相色谱仪,测得峰高为5cm,试计算废水中苯酚的浓度(mg/L)。
5. 用紫外吸收光谱法测定消毒水样中ClO2含量。
取标准储备液(1.00μg/mL)0.0,1.0,2.0,3.0,5.0,7.0,和9.0mL配制一系列标准溶液,定容至50mL,在λmax=360nm处测定对应的吸光度A,数据见下表。
0.00 1.00 3.00 5.00 7.00 9.00 ClO2标样
(mL)
吸光度A 0.00 0.07 0.20 0.37 0.50 0.63 取水样5.00mL,稀释至50mL,在相同条件下测得吸光度A=0.42。
绘制标准曲线并求出水样中ClO2含量(mg/L表示)。